三七总皂苷调控miR-1231保护高糖下肾小球系膜细胞的研究
田 昕,单婉鑫,石 艳,王陆飞*
(1.吉林大学第二医院,吉林 长春130041:2.吉林大学药学院,吉林 长春130021)
糖尿病肾病(diabetic nephropathy,DN)是由糖尿病引发的肾脏功能损害,此病已逐渐成为危害程度极大的糖尿病微血管并发症之一[1]。肾小球系膜细胞(mesangial cells,MCs)是肾小球内极其活跃的细胞,肾小球系膜细胞异常增殖并伴随着胞外基质的大量合成是DN的早期主要病理特征之一,且DN与炎症反应密切相关[2]。MicroRNA(miRNA)广泛存在于真核生物中,在基因调控中发挥重要作用。研究表明,miRNA在肾小球疾病中也扮演着重要的角色。一些miRNAs在肾小球肥大和肾小球系膜细胞增殖中起到了调节作用[3-4]。三七总皂苷(panax notoginseng saponins,PNS)为五加科中药材三七的主要活性成分,具有预防和治疗糖尿病肾病的作用,具体机制尚不明确。本课题组前期通过microRNA芯片技术预测出三七总皂苷可恢复高糖引起的人肾小球系膜细胞中miR-1231的下调,为DN的防治提供了新的思路。本研究旨在研究PNS对高糖诱导下HMCs增殖的影响以及从microRNA的角度来探讨PNS对DN分子水平上的作用机制。
1 材料与方法
1.1 主要试剂和仪器DMEM低糖培养基、DMEM高糖培养基(普诺赛生命科技有限公司,武汉),胎牛血清(赛百慷生物技术股份有限公司,上海),胰蛋白酶(翌圣生物科技股份有限公司,上海),三七总皂苷(南京景竹生物科技有限公司),TransScript反转录反应体系One-Step gDNA Removal(北京全式金生物技术股份有限公司),hsa-miR-1231(金开瑞生物工程有限公司),IL-6、TNF-α一抗购于上海碧云天生物技术有限公司,GAPDH 一抗及二抗购于ABclonal,ECL底物发光显色试剂盒购于上海威奥生物科技有限公司。CO2培养箱(日本松下公司),Strata-gene实时荧光定量PCR仪(博日科技有限公司),TG16-W台式高速冷冻离心机(英泰仪器有限公司,长沙),SDS-PAGE微型凝胶电泳及转膜设备(美国Bio-Rad公司)。
1.2 HMCs的复苏、培养及分组液氮中取出细胞冻存管,在37 ℃水浴锅中1 min解冻。加4 mL的DMEM低糖培养液(10%胎牛血清、1%双抗)1 000 rpm离心5 min,弃上清。加入2 mL DMEM低糖完全培养基吹散细胞,再加入8 mL DMEM低糖完全培养基。将其混合后,移到25 cm2的培养皿中,于5% CO2,37℃下孵育24 h,之后更换培养基,并继续培养。将HMCs分为空白对照组(CON),高糖组(HG)和三七总皂苷组(PNS)。
1.3 CCK-8法检测各组HMCs增殖能力选择3~5代的HMCs,胰酶消化离心,按照每个孔3×103个的细胞将细胞悬液接种到96孔板中,每孔加200 μL,每组平行设6个复孔。边缘孔用无菌PBS填充。分别经5.6 mM D-葡萄糖(CON)、30 mM D-葡萄糖(HG)的培养液和6.25、12.5、25、50、100、200 μg/mL的三七总皂苷处理24 h,向每孔加入10 μL CCK-8溶液,置于培养箱内孵育1~4 h。在酶联免疫检测仪上选定450 nm波长,利用空白对照孔调零,再测得各组的吸光度(OD)值。
1.4 Real-time PCR法检测miR-1231表达采用全式金EasyPure○RmiRNA Kit试剂盒提取microRNA,紫外分光光度计检测A260/A280在1.8和2.0之间的RNA纯度,逆转录采用TransScript miRNA First-Strand cDNA Synthesis试剂盒,采用TransStart Tip Green qPCR SuperMix进行Real-time PCR。反应结束后,计算机分析并计算终产物的融解曲线,采用2-ΔΔCt方法分析相关基因的表达水平。
1.5 miR-1231靶基因预测及功能和信号通路分析对miR-1231进行靶基因的初级筛选,采用以下microRNA靶基因数据库TargetScan(http://www.targetscan.org/vert_72/)进行预测分析,并采用Cytoscape软件将miR-1231与靶基因的调节网络可视化作图分析。以GeneOntology和KEGG数据库对所确定的靶基因进行功能富集及信号通路的可视化分析。
1.6 ELISA法检测PNS对HMCs中TNF-α、IL-6分泌情况的影响用0.05 mol/L pH为9.6的碳酸盐包被缓冲液将抗体稀释至蛋白质含量为1~10 μg/mL。在每个聚苯乙烯板反应孔中加100 μL溶液,4 ℃过夜。次日弃去孔内溶液,再用PBS洗涤3次,每次3 min。细胞上清液300 g离心10 min,立即检测。加稀释好的待测样品100 μL于上述孔中,37℃孵育1 h后洗涤。每孔加入100 μL酶标抗体(现配现用),37 ℃孵育1 h后洗涤。每孔加入100 μL TMB底物溶液(现配现用),37 ℃孵育30 min。孵育完成后,向每个孔中加入50 μL 2 mol/L硫酸终止反应。在ELISA检测仪上设定检测波长为450 nm,用空白对照孔调零后测定各孔的OD值。
1.7 Western blot法检测炎症因子蛋白表达水平提取各组细胞蛋白,应用BCA蛋白定量试剂盒检测以上各样本蛋白浓度,用微量进样器吸取20 μL蛋白样品,注入梳孔内。用80 V恒压电流电泳到蛋白样品到达层积胶与分离胶界限处时,立即切换至120 V恒压电泳。设定200 mA恒流转膜1 h,将凝胶条带转至PVDF膜上,转膜结束后将PVDF膜放入TBST中在摇床上晃动1 min,以洗去残余转膜液,再将膜浸入5%脱脂奶粉中封闭,孵育1~2 h。4 ℃过夜,回收一抗,TBST洗3×15 min。再加入稀释好的二抗,室温孵育1 h,TBST洗3×15 min。将 ECL发光底物 A液和 B液以1∶1的比例混合在一起,并在整个 PVDF膜上均匀地铺满,反应1 min,使用 Tanon 4200化学发光成像系统进行曝光和显影。应用Image-Pro Plus 6.0分析各组条带的灰度值,统计结果。
1.8 统计学方法SPSS19.0软件分析统计数据,所有数据用平均数±标准差表示,组间差异用方差分析进行统计学检验,组间两两比较采用最小显著差法(LSD)。P<0.05为差异具有统计学意义。
2 结果
2.1 CCK-8法检测三七总皂苷对高糖下HMCs增殖的抑制作用与CON组相比,HG组细胞OD值显著升高(P<0.01);与HG组相比,各个浓度的三七总皂苷组OD值均显著降低(P<0.05)。结果表明,三七总皂苷对高糖环境诱导的细胞过度增殖的抑制作用具有一定的浓度依赖性,50 μg/mL的三七总皂苷已经能显著降低高糖环境引起的细胞增殖,细胞OD值已降低到与CON组相近水平,所以本实验选用50 μg/mL的三七总皂苷进行后续的实验(图1)。
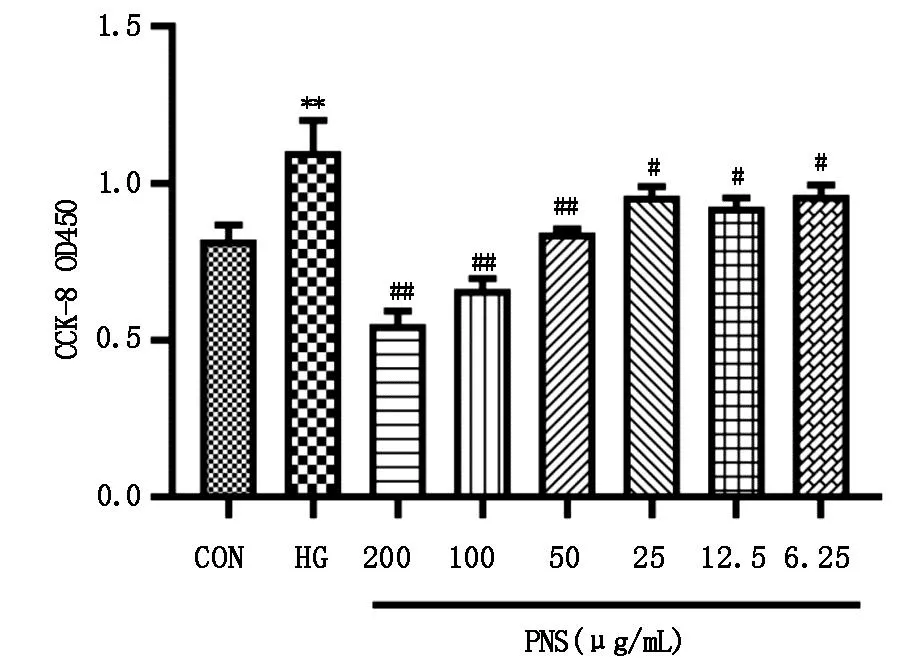
图1 三七总皂苷对高糖诱导下HMCs增殖的影响
2.2 Real-time PCR法检测三七总皂苷对高糖下HMCs miR-1231的调控作用与CON组相比,HG组miR-1231显著下调(P<0.01),与HG组相比PNS组miR-1231表达量显著上升(P<0.05)(图2)。
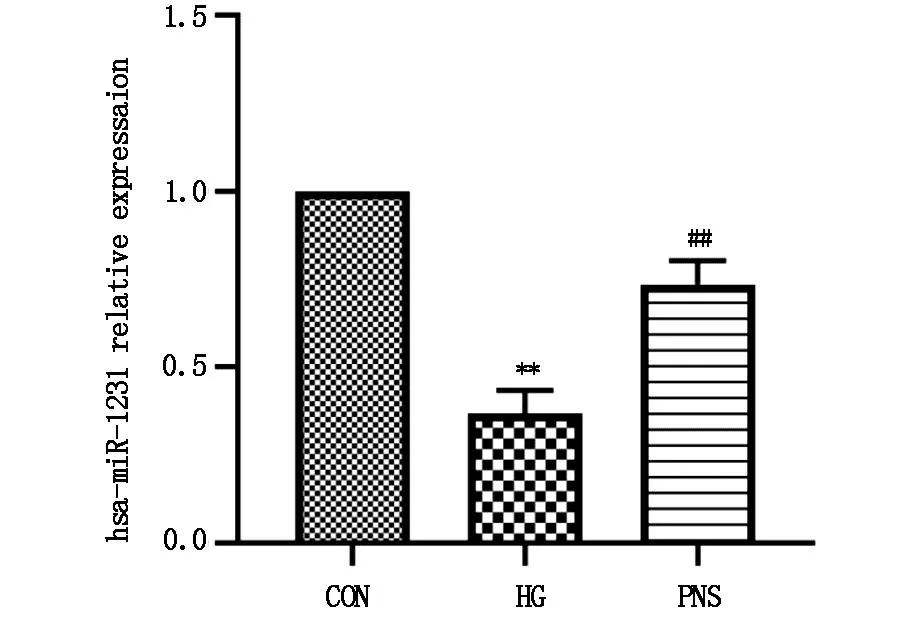
图2 miR-1231的含量测定
2.3 miR-1231靶基因预测及通路富集采用Targetscan数据库对miR-1231进行靶基因预测,发现miR-1231的靶基因有IGF1、TMED1、GSTT2等(图3)。以KEGG数据库对miR-1231的靶基因进行信号通路分析,发现与miR-1231相关的通路有Parathyroid hormone synthesis、secretion and action、EGFR tyrosine kinase inhibitor resistance、MAPK signaling pathway等。用Cytoscape软件将排列前20的信号通路可视化(图4)。由信号通路气泡图可知,MAPK signaling pathway所形成的原点最大,pvalue值最小,说明MAPK signaling pathway与miR-1231密切相关(图5)。以GeneOntology对miR-1231的靶基因进行生物功能富集可知,miR-1231的靶基因参与调控肾小球系膜细胞内蛋白质转运、转录辅助抑制因子结合等生物学功能(图6)。
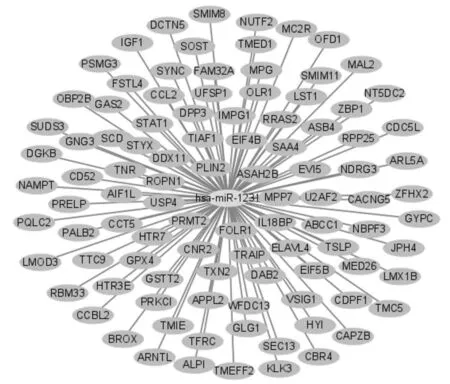
图3 miR-1231靶基因预测

图4 信号通路网络图
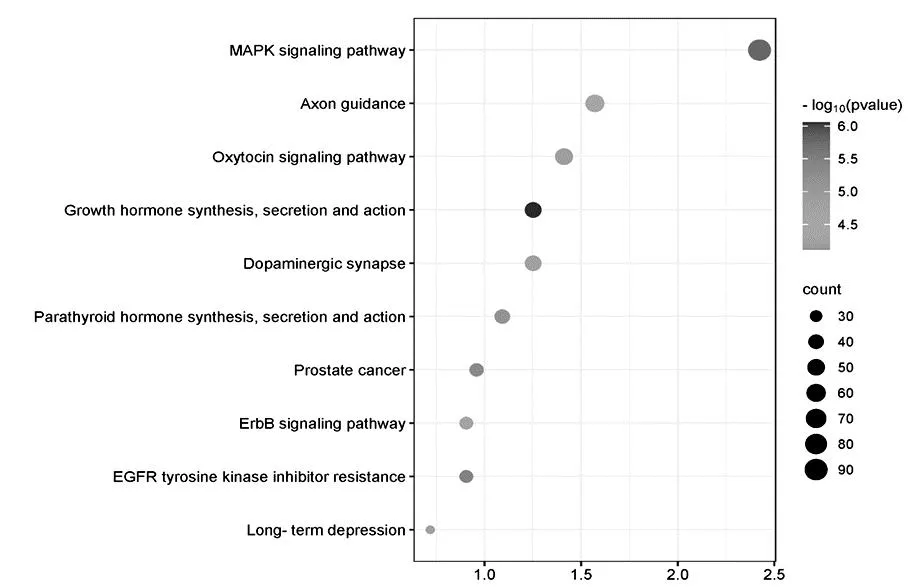
图5 信号通路气泡图
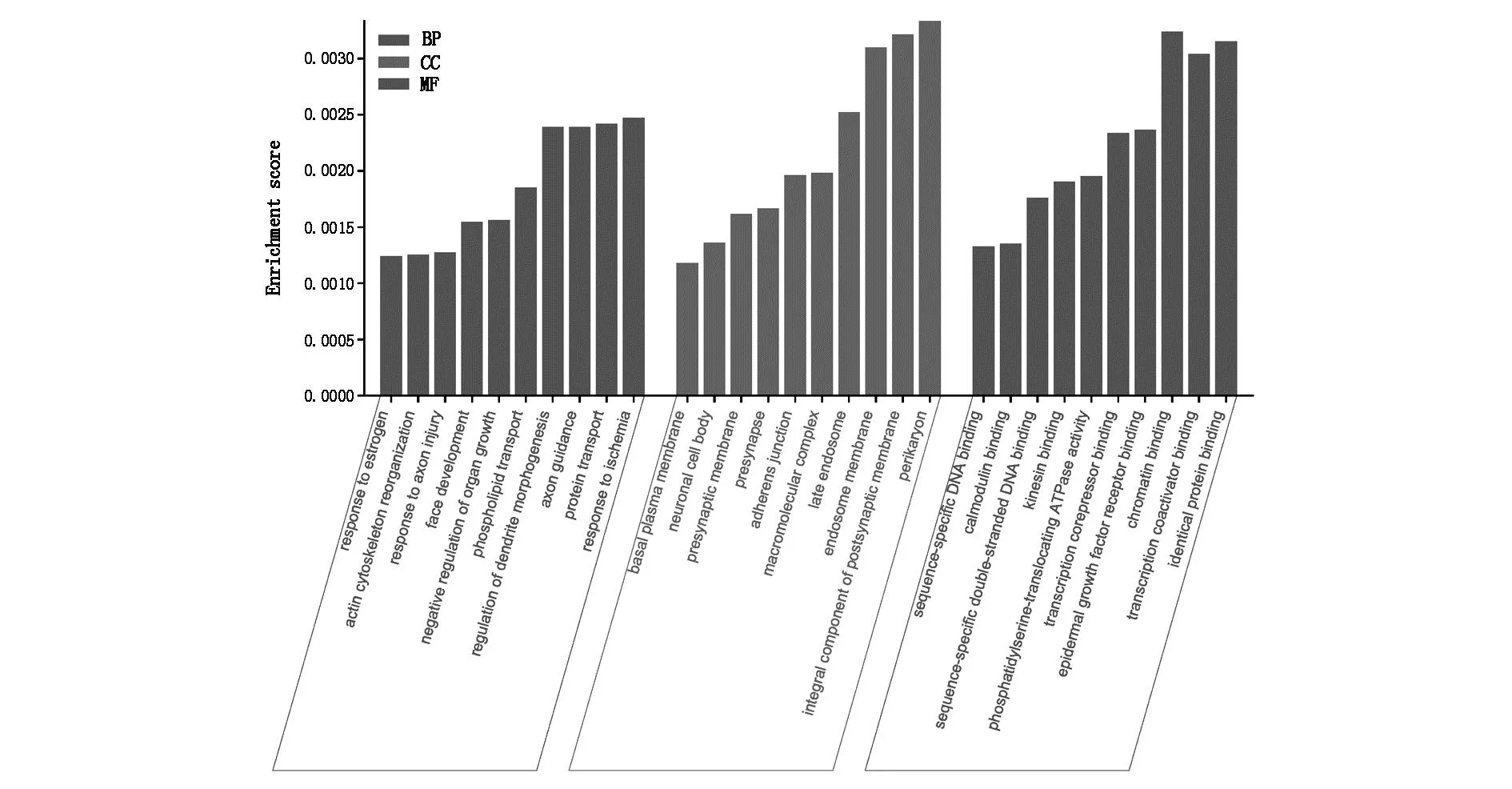
图6 生物学功能分析
2.4 三七总皂苷对高糖下HMCs炎症的抑制作用采用ELISA法检测细胞上清液中TNF-α、IL-6的含量,HG组细胞上清液中TNF-α、IL-6水平较CON组显著升高(P<0.01),PNS组较HG组相比TNF-α、IL-6含量均显著降低(P<0.01)(图7)。采用Western blot法针对炎症因子的蛋白表达进行了检测,结果表明,HG组细胞中TNF-α、IL-6蛋白表达水平较CON组显著升高(P<0.01),PNS组较HG组相比TNF-α、IL-6蛋白表达量显著降低(P<0.01)(图8)。
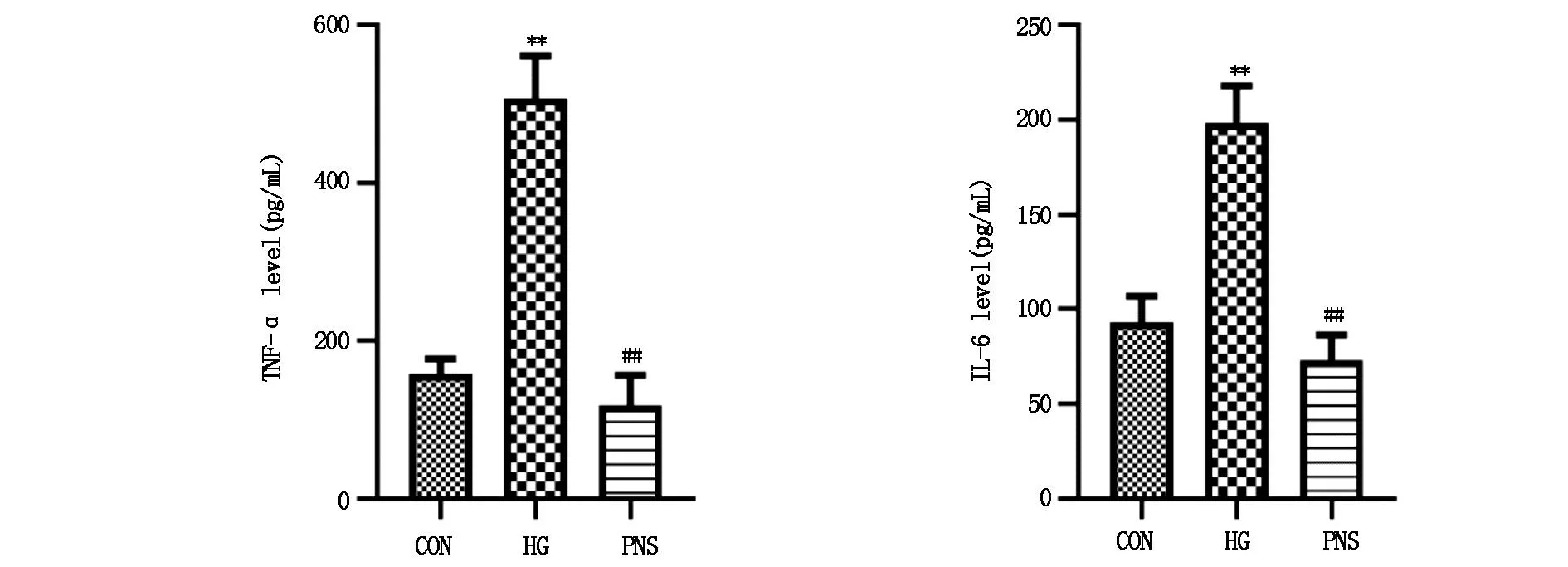
图7 各组细胞炎症因子分泌情况
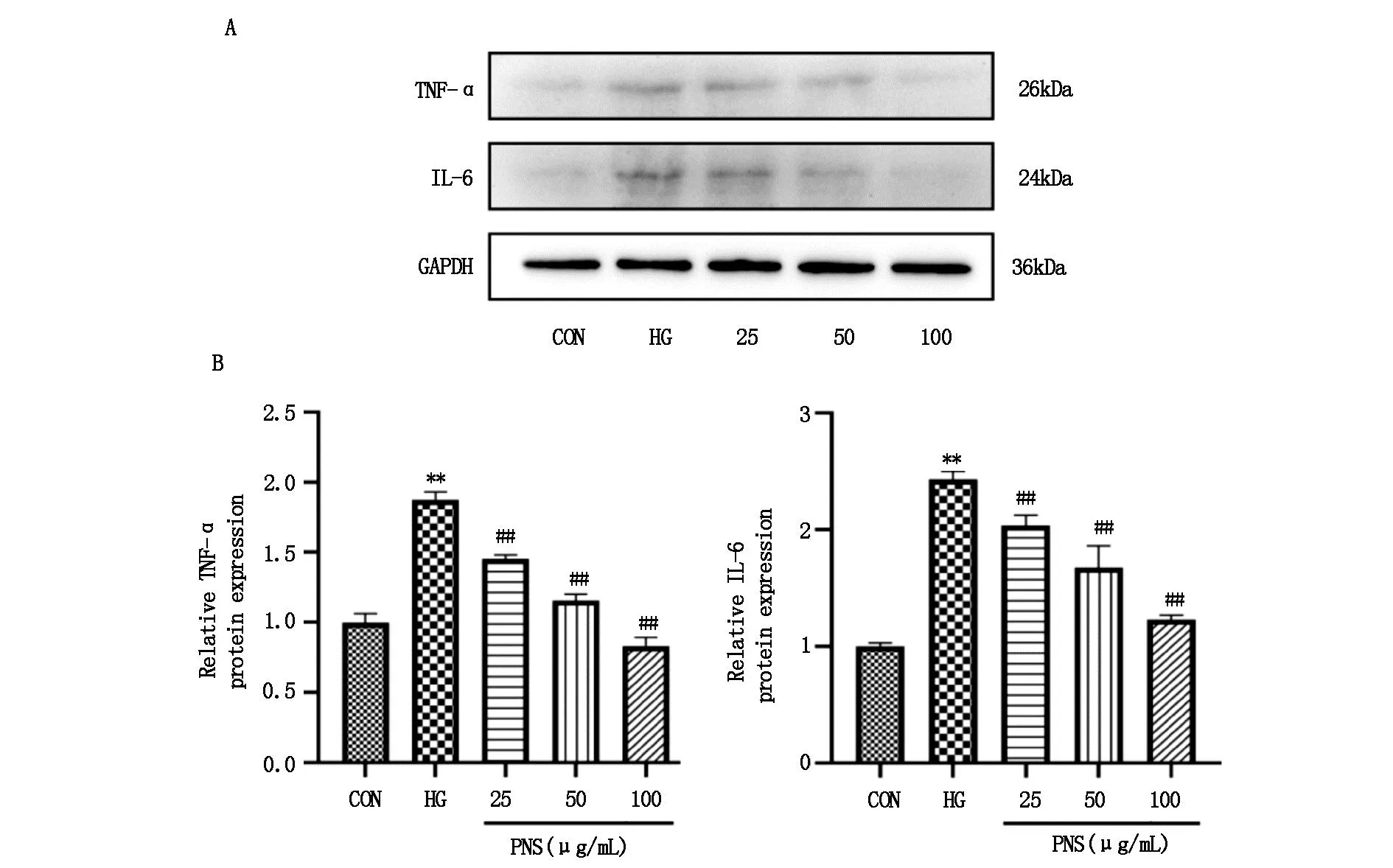
图8 HMCs内TNF-α、IL-6蛋白表达情况
3 讨论
DN是一种糖尿病肾小球硬化症,具有遗传因素、高血糖等诱因,是一种伴有血管损伤和肾小球血流动力学变化的肾小球代谢紊乱综合征。DN状态下,肾小球病变主要包括系膜细胞肥大、基底膜增厚和系膜基质增生等。MCs是DN极其重要的靶细胞,持续的高糖环境能够诱发其异常增殖以及炎症反应的发生[5-6]。PNS是从中药材三七中提取的主要活性成分,其具有扩张血管、增强微循环、抗炎、抗氧化、抗休克、抗肿瘤等功能[7-8]。目前PNS已被证实具有肾脏保护作用,减缓糖尿病肾病的发展[9],但其机制尚不明确。
本实验采用CCK-8法探究了三七总皂苷对HMCs的增殖的影响,发现三七总皂苷可以抑制高糖诱导的细胞过度增殖,且其抑制作用具有浓度依赖性,并选用50 μg/mL的三七总皂苷进行后续实验。
miRNA是各种细胞活动的强大调节剂,调控着细胞的生长、分化、发育和凋亡。miRNA也被证明可以在与糖尿病发生发展相关的组织中发挥作用,包括胰腺、骨骼肌和脂肪组织[10]。近年来,在糖尿病肾病中,miRNA具有靶向炎症、纤维化、氧化应激等作用[11]。已有报道证明miRNA通过介导炎症来调节糖尿病肾病[12]。
在前期实验中,通过microRNA芯片分析预测出三七总皂苷可上调高糖下HMCs内miR-1231的表达,但三七总皂苷是否通过调控miR-1231实现对高糖下HMCs的保护作用尚不明确。
有研究表明,miR-1231可调控肿瘤细胞的发展[13-14]。但miR-1231对于DN及高糖下肾小球系膜细胞的作用未有文献报道,通过Real-time PCR法结果发现,PNS可恢复高糖引起的HMCs miR-1231的下调。对miR-1231进行了生物信息学分析,预测到miR-1231的靶基因有IGF1、TMED1、GSTT2等;且通过KEGG通路富集以及GO分析,得到miR-1231与丝裂原活化蛋白激酶(MAPK)通路密切相关。研究发现,MAPK信号通路可以通过激活NF-κB转录因子来调节炎症因子的表达。在炎症过程中,炎症因子如IL-1β、IL-6、TNF-α等的表达水平会升高,而MAPK信号通路的激活可以促进这些炎症因子的表达[15-16]。PNS被证实对多种实验性炎症模型具有良好的抗炎活性。在本实验中,采用ELISA和Western blot法对炎症因子的表达量进行了检测,发现PNS可显著抑制高糖下HMCs中TNF-α和IL-6的高表达,起到良好的抗炎作用。
综上所述,三七总皂苷可通过上调miR-1231的表达有效地改善高糖引起的HMCs过度增殖,并起到一定的抗炎作用。

