HRMR-VWI 技术对颅内动脉夹层的诊断和分期评估价值
杜傲波
(江门市中心医院放射科 广东 江门 529000)
颅内动脉夹层是一种危及生命的脑血管疾病,由多因素引起的颅内动脉内膜破损,动脉血流通过破损处进入中膜导致动脉管壁撕裂形成腔隙,继发腔隙内和管壁内血肿形成最终导致动脉狭窄、闭塞和破裂[1]。目前,颅内动脉夹层的病因和发病机制尚未完全清楚,主要与高血压、遗传、头颈部外伤、感染、甲状腺疾病、口服避孕药和吸烟等因素密切相关。研究表明,自发性颅内动脉夹层约占所有病例的60%[2]。其临床表现与发病部位有关,部分患者可无明显症状,也可能表现为剧烈头痛、颈胸背部撕裂样疼痛、交感神经麻痹、脑卒中或蛛网膜下腔出血等[3]。在中青年人群中颅内动脉夹层是导致脑卒中的主要原因,约占10%~25%[4]。高分辨率血管壁成像(high-resolution magnetic resonance vessel wall imaging,HRMR-VWI)能够清晰地显示血管的狭窄程度、血管壁结构,在组织对比度和空间成像分辨率方面表现出良好的优势且安全性高无辐射,已被广泛用于诊断大血管病变。本研究选取2018 年1 月—2022 年12 月在江门市中心医院就诊的100 例颅内动脉夹层患者,旨在探讨HRMR-VWI 技术对颅内动脉夹层诊断和评估分期的临床价值。报道如下。
1 资料与方法
1.1 一般资料
选取2018 年1 月—2022 年12 月在江门市中心医院就诊的100 例颅内动脉夹层患者作为研究对象,其中男性71 例,女性29 例;根据病程将患者分为急性期(0 ~3 天)23 例、亚急性期(3 ~60 天)26 例、慢性期(>60 天)51 例。不同分期患者年龄、性别比例、既往史等一般资料比较差异无统计学意义(P>0.05)。见表1。

表1 不同颅内动脉夹层患者一般资料比较
纳入标准:①未接受过其他血管内外科手术治疗;②经颅内血管造影和临床表现诊断为颅内动脉夹层;③有1 周内弥散加权成像(diffusion weighted imaging,DWI)检查的影像结果;④有颅内动脉夹层的典型症状或体征,且病情稳定;⑤无纤维性肌发育不良、血管炎、烟雾病等其他颅内血管病变以及颅内肿瘤、脑膜炎等颅内疾病;⑥患者及家属均知情并签署知情同意书。排除标准:①有明显的头颈部外伤史;②有置入心脏起搏器等磁共振检查禁忌;③病变部位不在颅内段动脉;④合并严重肝肾等其他系统功能障碍;⑤临床资料不完整者。
1.2 方法
所有纳入研究的患者均行常规磁共振血管成像(MR angiography,MRA)和HRMR-VWI 检查。使用荷兰飞利浦Ingenia3.0T MRI 扫描仪,32 通道头颈联合线圈进行检查,临床医生确定成像范围。具体扫描序列为3D-TOF-MRA、T1WI-IR-TSE、T2W-MultiVane、DWI、3D-SPACE-T1WI、PDW-VISTA-brain、PDW-BB-M2D、T1W-BB。可疑病变血管以及颅脑全范围的检查使用3D-TOF MRA、3D-SPACE-T1WI 进行,明确病灶具体位置、血流信号、管腔实际狭窄程度。然后通过静脉注射0.1 mmol/kg 人造造影剂钆喷酸葡胺进行3D-SPACE 增强扫描,对病变部位进行增强显影。由两名副主任及以上级别的影像学医师阅片。
1.3 观察指标
①分析不同分期内动脉夹层不同病变部位的临床表现;②比较不同分期MRA 和HRMR-VWI 对颅内动脉夹层典型影像学特征的检出率;③比较不同分期夹层血管壁定量参数的差异;④不同分期HRMR-VWI 典型影像分析。
1.4 统计学方法
采用SPSS 22.0 统计软件分析数据。符合正态分布的计量资料以均数±标准差(±s)表示,两组之间比较采用t检验,多组之间比较采用单因素方差分析;计数资料以频数(n)、百分率(%)表示,采用χ2检验,以P<0.05 表示差异有统计学意义。
2 结果
2.1 不同血管病变部位颅内动脉夹层的分期情况
急性期椎动脉颅内段病变比例显著高于大脑中动脉和颈内动脉硬膜外段,亚急性期椎动脉颅内段和颈内动脉硬膜外段比例显著低于大脑中动脉,慢性期椎动脉颅内段和颈内动脉硬膜外段比例显著高于大脑中动脉(P<0.05)。见表2。

表2 不同血管病变部位颅内动脉夹层的分期情况[n(%)]
2.2 比较MRA 和HRMR-VWI 对颅内动脉夹层不同分期典型影像学特征的检出率
HRMR-VWI 在急性期和亚急性期对内膜/双腔征的检出率高于MRA,差异具有统计学意义(P<0.05),壁间血肿及动脉瘤样扩张或凸出检出率差异无统计学意义(P>0.05);在慢性期两者对典型影像学特征的检出率比较,差异均无统计学意义(P>0.05)。见表3。

表3 比较MRA 和HRMR-VWI 对颅内动脉夹层不同分期典型影像学特征的检出率[n(%)]
2.3 比较不同分期夹层血管壁定量参数的差异
急性期夹层血管壁定量参数均高于亚急性期和慢性期,差异具有统计学意义(P<0.05)。见表4。
表4 比较不同分期夹层血管壁定量参数的差异(±s)

表4 比较不同分期夹层血管壁定量参数的差异(±s)
分期血管壁增强相对信号强度壁间血肿相对信号强度壁厚指数狭窄百分比急性期(n=23)1.69±0.762.84±0.570.81±0.130.44±0.15亚急性期(n=26)1.43±0.391.24±0.310.73±0.090.41±0.11慢性期(n=51)1.37±0.361.19±0.290.76±0.110.23±0.08 F 3.48853.0603.27135.600 P<0.05<0.001<0.05<0.001
2.4 不同分期HRMR-VWI 典型影像分析
颅内动脉夹层不同分期典型影像学分析见图1 ~图3。图1:急性期,患者男,65 岁,影像可见脉瘤样扩张及双腔征;图2:亚急性期,患者男,44 岁,可见壁内血肿信号增高;图3:慢性期,患者女,可见内膜瓣。

图1 急性期
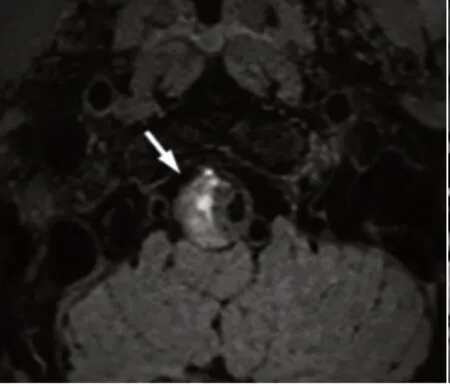
图2 亚急性期

图3 慢性期
3 讨论
尽管颅内动脉夹层的发病率较低,但高致残率和致死率严重威胁着人类的健康。此外,其临床表现不典型,准确地诊断颅内动脉夹层对临床医生是一个挑战。一直以来在临床上诊断颅内动脉夹层的“金标准”是数字减影血管造影(digital subtraction angiography,DSA)。然而,使用DSA 诊断颅内动脉夹层能观察到典型的夹层影响病例不超过10%。此外,作为一种有创的检查DSA 还会引起血肿和严重的神经系统并发症,甚至导致动脉夹层加重[5]。研究表明,MRA 作为一项成熟的影像检查技术,对颅内动脉夹层典型影像的检出准确率与DSA 相当,且还可以对壁间血肿显影[6]。然而,由于颅内动脉夹层的管径小导致空间成像分辨率低,严重限制了这些传统检查手段的适应[7]。
相比于其他技术,HRMR-VWI 可以从不同层面充分显示血管壁结构,在诊断狭窄原因、分析斑块成分、判断斑块的稳定与否对其他检测技术是完美的补充。研究表明,在诊断颅内动脉粥样硬化和非粥样硬化中HRMR-VWI 具有明确的临床价值[8]。研究表明,随着HRMR-VWI 在临床的普及,颅内动脉夹层的检出率得到显著提升[9]。颅内动脉夹层形成的影像改变主要与其病理生理有关,当血液进入膜剥离的内膜后导致真、假腔及壁内血肿的形成,当病情进展后会引起动脉壁凸出从而形成夹层动脉瘤。此外,在急性期或亚急性期影像学检出内膜瓣被认为是诊断颅内动脉夹层的一个重要的指标。壁内血肿和血管壁强化程度的定量分析也是评估颅内动脉夹层分期的重要指标[10]。本研究结果表明,在急性期和亚急性期HRMR-VWI 对内膜/双腔征的检出率显著高于MRA(P<0.05),在慢性期两者对典型影像学特征的检出率差异无统计学意义(P>0.05),急性期夹层血管壁定量参数均显著高于亚急性期和慢性期(P<0.05)。
综上所述,HRMR-VWI 通过在颅内动脉夹层早期对典型影像指标的检出,以及对血管壁定量指标的动脉分析,在诊断颅内血管病变、评估分期和判断预后具有重要的指导意义。

