卵巢透明细胞癌的MRI 表现及误诊原因分析
卢艳丽,费 莹(通信作者),奚晓雪
(1 苏州市立医院影像科 江苏 苏州 215002)
(2 苏州市立医院妇科 江苏 苏州 215002)
卵巢癌是妇科常见恶性肿瘤之一,约90%的卵巢癌为上皮型,最常见为浆液性癌;卵巢透明细胞癌(ovarian clear cell carcinoma,OCCC)以往比较少见,近年来有文献报道OCCC 的发病率约占卵巢癌的5%~20%,超过了黏液性癌,是第二常见上皮性卵巢癌[1];而相比其他类型卵巢癌,OCCC 对化疗药物的敏感性差,预后更差,因此早期诊断十分重要;但因上皮性肿瘤的MRI 表现具有较多共性,重叠较多,本病术前常被误诊。本文回顾性分析16 例经手术病理证实的OCCC 患者的临床资料及其MRI 影像特征,探讨其影像表现,分析误诊原因,以提高对本病的认识,提高术前诊断准确率。
1 资料与方法
1.1 一般资料
回顾性分析2013 年11 月—2020 年12 月于苏州市立医院经手术病理证实为卵巢透明细胞癌的19 例患者信息,其中有完整临床资料并术前进行MRI 检查的患者16 例,年龄47 ~71 岁,中位年龄55 岁,平均年龄55.6 岁;16 例中12 例为体检发现盆腔包块,2 例因腹痛来诊,其中1 例发现盆腔包块4 年,近期感觉增大,1 例因阴道少量流血来诊;2 例合并子宫内膜异位症;6 例患者CA125 正常;10 例患者CA125 不同程度升高(64.90 ~515.00 U/mL),其中8 例同时伴有CA199升高(67.14 ~614.09 U/mL)。肿瘤分期采用国际妇产科协会(FIGO)[2]标准。
1.2 方法
采用Philips intera achieva 1.5T 和Siemens skyra 3.0T 超导MRI 扫描仪,体线圈(1.5T)和相控阵体线圈与脊柱线圈联合使用(3.0T),行常规MRI 平扫及增强扫描;常规MRI 序列包括轴位T1WI(TR 500 ms,TE 11/20 ms)、 轴位及矢状位T2WI(TR 2 980/3 624 ms,TE 104/100 ms)、 轴 位T2-FS(TR 3 020/3 994 ms,TE 101/70 ms),层厚7 mm,层间距0 mm,FOV 240 mm×240 mm,矩阵384×384/372×270,NEX 2。DWI 采用轴位单次激发平面回波技术,TR 4 030/899 ms,TE 61/63 ms,层厚7 mm,层间距0 mm,FOV 240 mm×240 mm,矩阵150×150/124×124,NEX 2;b 值为0、800 s/mm2。增强扫描采用对比剂Gd-DTPA,经肘静脉推注,速率2 mL/s,依次行轴位、矢状位、冠状位T1WI 增强扫描。
1.3 图像分析
由两位具有十年以上腹盆部放射诊断经验的高年资医师对MRI 图像进行共同阅片,取得一致意见后记录病灶MRI 特征,包括肿瘤部位、大小、形态、边界、包膜、成分(囊/实/囊实性)、单房/多房、结节形态、数目、大小,观察结节囊变情况,囊性部分的T1WI/T2WI/DWI信号、实性结节的T1WI/T2WI/DWI 信号以及增强后囊、实性部分的强化特征。
2 结果
2.1 病灶分布、大小、形态及边界
16 例患者共17 个病灶,起源于左侧卵巢9 例,右侧卵巢6 例,双侧卵巢1 例;17 个病灶16 个类椭圆形(94.11%),1 个不规则形(5.88%),边缘分叶状;15 例囊实性肿块,长径8.1 ~18.3 cm,中位数10.6 cm,1 例双侧实性肿块长径分别为3.0 cm 和4.1 cm。16 例病灶边界均清晰,包膜完整。
2.2 MRI 表现
肿瘤以囊实性肿块为主,14 例单房大囊(图1),1 例多房大囊(图2);囊实性肿块内均见较大附壁结节(2.30 cm×3.55 cm ~9.45 cm×4.21 cm),伴或不伴小乳头(直径小于1 cm),结节、乳头为局限性,宽基底;结节不同程度囊变,长径大于4 cm 结节囊变明显(图3)。15 例囊实性病灶,实性结节或结节实性部分T1WI 呈等低信号,T2WI 呈高信号,DWI 呈高信号,增强扫描明显持续强化,其中一小乳头T2WI 呈低信号,增强后无强化;囊性部分2 例T1WI 呈高信号,12 例T1WI 呈低信号,1 例多房病灶各房信号不同,T1WI 呈稍高或低信号;囊性部分T2WI 均呈高信号;增强后无强化。
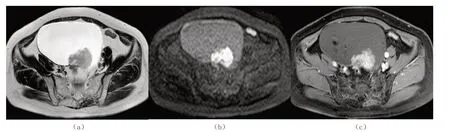
图1 单房大囊图

图2 多房大囊图

图3 结节囊变图
本组1 例双侧实性病灶同时合并子宫内膜透明细胞癌,T1WI 呈低信号,T2WI 呈高信号,病灶内见小裂隙样囊性变,DWI 呈明显高信号,增强后明显持续强化,裂隙样囊变无强化。
2.3 肿瘤分期及术前误诊情况
本组16 例患者均未见腹水,未见盆腔及远处转移。术后FIGO 分期Ⅰ期11 例(68.75%),Ⅱ期2 例(12.50%),Ⅲ期3 例(18.75%)。16 例中仅7 例术前诊断为卵巢透明细胞癌,9 例误诊,其中6 例误诊为浆液性囊腺癌,1 例误诊为黏液性囊腺癌,2 例误诊为卵巢内膜样癌。
3 讨论
3.1 临床特点
OCCC 最早在1973 年被WHO 确认为一种独立的组织亚型[3],发病机制尚不明确,目前多认为是起源于苗勒氏管的卵巢恶性肿瘤[4],约占卵巢癌的5%~10%,虽然恶性程度较高,但其5 年生存率较其他类型卵巢癌高,这是因为约75%的OCCC 被发现时处于国际妇产科联盟(FIGO)分期Ⅰ期,本组11 例患者(68.75%)术后FIGO 为Ⅰ期,接近于文献报道[5]。OCCC 一般多见于成年女性,平均年龄55 岁,本组患者年龄47 ~71 岁,中位年龄55 岁,平均年龄55.6 岁,与文献报道基本一致[5]。OCCC 已经被许多研究证实与卵巢子宫内膜异位症相关[6],本组中两例OCCC 合并内膜样囊肿或内膜样囊肿伴癌变,低于Stamp 等报道的51%[7],可能是由于样本量较小。CA125在OCCC 中的诊断价值Kobayashi 等[8]认为并不确切,国内黄丹萍等[9]将OCCC 与高级别浆液性癌比较,两组CA125 差异无统计学意义,而CA199 升高OCCC 更常见。本组OCCC 中CA125 升高占62.5%,CA199 升高占50.0%,与黄丹萍报道的62%和52%比例相似。
3.2 MRI 影像学表现
OCCC 主要表现为体积较大的囊实性肿块,多为单侧,双侧发病少见,本组15 例OCCC 为单侧(93.75%),均为大囊结节型,结节较大,单发或者多发,宽基底附着于囊壁,本组15 例中仅1 例最大结节长径未达4 cm;结节内伴有不同程度囊变,本组长径大于4 cm 的结节囊变明显,这可能是由于管囊状结构较多,分泌黏液;或结节具有明显的纤维血管轴心伴明显透明变性。乳头一般较小,形态规则,信号及强化均匀。囊性成分T2WI 均呈高信号,T1WI 信号复杂,本组12 例T1WI 呈低信号,2 例T1WI 呈稍高信号,1 个多房病例各房信号高低不同,可能与出血及囊液蛋白成分不同有关[10]。增强实性结节及结节实性部分均明显强化,一小乳头T2WI 呈低信号,扩散无受限,增强无强化,可能是病灶远离血管,缺血导致的营养不良性钙化。
3.3 鉴别诊断及误诊原因分析
(1)OCCC 表现为囊实性时与其他卵巢上皮性肿瘤影像表现有重叠,本组病例6 例误诊为浆液性囊腺癌,误诊原因均为体积较大囊实性肿块,有附壁结节,结节表面凹凸不平,呈颗粒样,实性成分明显强化,与乳头状浆液性囊腺癌表现类似;浆液性囊腺癌常单侧或双侧发生,形态不规则,边界不清,单房或有厚薄不均分隔,囊腔内缘毛糙,实性成分较OCCC 多,实性结节较OCCC 不规则,囊实性成分多嵌插分布,腹水、瘤内钙化及腹膜种植较OCCC 多见[11-12]。另外CA199 升高在OCCC 中更为常见[9]。1 例误诊为黏液性囊腺癌,是因为本例为多房,囊内分隔厚薄不均,且各房内囊液信号高低不同与黏液性囊腺癌类似,本组病例囊壁及分隔壁见多发结节,且结节内伴明显囊变,这可能有助于二者鉴别。(2)与卵巢内膜样癌鉴别,本组2 例误诊为卵巢内膜样癌,误诊原因为二者均属于子宫内膜异位相关性卵巢癌,临床特点表现出很多相似点[13],本组两例患者有内膜异位病史,子宫内膜有增厚,大囊伴多发结节,故误诊为内膜样癌;卵巢内膜样癌囊实性为主,囊内结节常为多发,呈同心圆样宽基广泛分布于囊壁或环壁软组织样改变,而OCCC 结节呈局灶性分布,并且OCCC的结节高宽比(HWR)较卵巢内膜样癌大[14]。OCCC结节囊变较内膜样癌多发且明显。(3)与卵巢颗粒细胞瘤鉴别,卵巢颗粒细胞瘤可表现为实性和囊实性,有明显包膜,多囊,囊腔大小不等,囊壁较厚而规则[15],囊实性典型表现为“蜂窝征”或“海绵征”,病灶较大,跨腹盆生长时可以出现“束腰征”[16];实性颗粒细胞瘤需与实性OCCC 鉴别,二者常规序列信号类似,前者囊变多位于病灶边缘,而后者病灶内常可见裂隙样囊变。此外颗粒细胞瘤常伴雌激素水平升高,子宫内膜增厚。(4) 与转移瘤鉴别,后者具有原发肿瘤病史,多来源于胃肠道,多伴有腹水及腹腔转移;本组1例双侧实性OCCC 因合并有内膜病变,故而考虑到转移可能。
综上所述,OCCC 的MRI 表现具有一定特征性,单侧发生,病灶较大,类椭圆形,边界清晰,包膜完整,单房大囊为主,常有大的附壁结节,结节内伴囊变。仔细分析其影像征象,结合临床资料有助于与卵巢来源的其他囊实性肿块为主肿瘤鉴别。

