一株耐盐甲醛降解菌Achromobacter sp.WY0的分离及降解特性研究
杨宗政,孙 炜,张天宇,孙 静,孟 珠,吴志国,3
(1.天津科技大学 化工与材料学院,天津 300457; 2.天津科技大学 海洋与环境学院,天津 300457;3.天津市卤水化工与资源生态化利用重点实验室,天津 300457;4.远大健康科技(天津)有限公司,天津 301699)
甲醛作为重要的化工材料和有机溶剂,广泛用于生产化纤地毯、塑料地砖、油漆、涂料等各种建筑材料[1]。但甲醛已被各类环保机构列为一类致癌物质,能与人体内的蛋白质结合,使其凝固,严重危害人体健康[2-3]。目前针对甲醛污染,已有一些典型的治理方法,例如催化法[4]、吸附法[5]和生物法[6]等。其中,生物法主要以环境中的具有相应耐受功能或降解能力的细菌或真菌为处理材料,能够保证较低的成本,在实际甲醛废水的处理中相比催化、吸附等物理化学方法,更能达到理想的效果,而且处理后不会产生额外的有毒有害污染物。因此,甲醛的生物降解已成为国内外学者的研究热点。
近年来,国内外研究者就如何利用微生物降解甲醛进行大量的研究,筛选出多种菌株,有甲基杆菌(Methylobacteriumsp.)[7]、假单胞菌(Pseudomonassp.)[8]和芽孢杆菌(Bacillussp.)[9]等,但降解能力强弱不一,主要是由于在高质量浓度甲醛(≥200 mg/L)环境下,微生物活性将受到抑制,降解能力下降。韩茜等[10]通过驯化培养(甲醛质量浓度由2.5 mg/L逐步升高至20 mg/L)分离出1株BacillusamyloliquefaciensXF-1,完全降解100 mg/L的甲醛需34 h。张弘驰等[11]以黄芪作为菌源,驯化并筛选出降解甲醛的内生真菌溜曲霉AL06(甲醛驯化质量浓度由50 mg/L逐步提高至100 mg/L),该菌140 h对200 mg/L甲醛的降解率为85.3%。张明等[12]固定培养基甲醛质量浓度,反复转接驯化,最终分离出1株甲基营养菌,44 h可将300 mg/L甲醛完全降解。现有报道多为驯化培养甲醛降解微生物,且物种种类较少,降解甲醛能力有限,鲜有研究对菌株的降解动力学进行分析,因此,优化驯化条件,筛选具有优良安全性及降解能力的新种属菌株对甲醛降解微生物多样性具有重要的推动作用。
本文取天津某污水处理厂的好氧池活性污泥,在实验室逐步驯化甲醛降解菌,筛选出一株具有优良甲醛耐受性及降解能力的菌株A.marplatensisWY0,研究其在不同培养条件(接种量、温度、pH值、盐度、初始甲醛质量浓度、碳源、氮源)下的生长及甲醛降解效果,并通过three-half-order方程动力学模型与WY0的降解数据相拟合以探究菌株生长和初始甲醛质量浓度之间的关系,研究结果可推进无色杆菌的降解多样性并为甲醛污染的原位修复提供重要种质资源。
1 材料与方法
1.1 材料
1.1.1 菌种来源
本研究所用活性污泥取自天津某污水处理厂好氧池,该污泥颗粒结构紧凑,经测定污泥质量浓度(MLSS)为3 000~4 000 mg/L,污泥SV30为30%~35%。
1.1.2 培养基
无机盐培养基(g/mL):NaCl 0.001 g,NH4Cl 0.001 34 g,K2HPO40.001 g,KH2PO40.000 5 g,MgSO4·7H2O 0.000 2 g,调节适合的pH,定容至一定体积,121 ℃ 20 min灭菌后备用。
LB培养基(g/mL):牛肉膏0.005 g,蛋白胨0.010 g,NaCl 0.005 g,定容至一定体积,121 ℃ 20 min灭菌后备用。
固体培养基:液体培养基中加入适量的琼脂。
1.2 方法
1.2.1 菌种富集与驯化
将适量活性污泥加入到100 mL无菌水中连续培养(摇床温度调整为30 ℃,转速调整为180 r/min),培养2 h后从菌悬液中取10 mL接种于LB培养基中,相同条件下培养24 h,取10 mL富集菌液(用无机盐溶液置换LB溶液)接种到90 mL的无机盐培养基(含10 mg/L甲醛)中,待培养液明显浑浊后,取培养液10 mL转接于含有20 mg/L甲醛的无机盐培养基中。在同样的培养条件下按梯度不断提高甲醛质量浓度反复富集驯化,直至甲醛质量浓度提升至100 mg/L,将最后一次具有明显浑浊现象的富集液涂布于含有一定量甲醛的无机盐固体培养基,选择菌落形态良好的菌株保种后进行下一步实验。
1.2.2 菌株生长曲线和甲醛降解率测定
(1)菌株生长曲线测定。取适量菌株种子活化液于LB培养基(使初始OD600≈0.01)中连续培养(摇床温度调整为30 ℃,转速调整为180 r/min)。取样时间为2 h,测定菌液样品的OD600,绘制WY0的生长曲线,并采用SGompertz模型[13-14]拟合生长过程。通过公式(1)与公式(2)计算菌株的最大比生长速率U,并通过R2评价模型拟合度。
ln(Nt)/N0)=a×exp{-exp[-kx(x-xc)]}
(1)
由此可以得到U的计算公式:
U=a×k/e
(2)
式中,t为时间,h;Nt和N0分别表示在时间t时和初始时间时的微生物数量,CFU/g;xc为达到最大生长速率的时间,h;a为最大菌数Nt和初始菌数N0的差值;k为xc时的相对生长速率;e=2.718 2。
(2)甲醛质量浓度测定。采用乙酰丙酮法测定甲醛质量浓度[15]。根据该方法将制备好的样品在60 ℃中水浴15 min,测量样品的OD414(需将样品冷却至室温),设置去离子水样品作为CK对照,得到样品的OD414值后,利用公式(3)计算甲醛降解率[16]。
(3)
式中,OD0为未接菌样品在414 nm处的吸光度,OD1为接种WY0样品在414 nm处的吸光度。
1.2.3 菌株鉴定及系统发育树构建
(1)形态学及生理生化鉴定。将菌株接种于固体LB培养基中观察其菌落形态,采用扫描电镜(JSM-IT300LV)在10 000×下观察菌株WY0的形态特征。参照《伯杰氏细菌鉴定学手册》测定菌株部分生理生化指标。
(2)16S rDNA序列鉴定。取在LB培养基中生长至对数生长期的菌液,用试剂盒法对该菌的基因组DNA进行提取,以提取的基因组DNA为模板,采用细菌通用引物(27F:5′-AGAGTTTGATCCTGGCTCAG-3′,1492R:5′-GGTTACCTTGTTACGACTT-3′)进行PCR扩增。扩增产物送至苏州安升达生物科技有限公司测序,将测序结果在NCBI数据库中进行BLAST比对,并采用邻接法构建其系统发育树,获得菌株WY0的生物学地位。
1.2.4 菌株生长及降解甲醛特性
以100 mL无机盐培养基(含甲醛200 mg/L)为基础,设置不同体积比的接种量(4%、6%、8%、10%、12%和14%)、不同培养温度(15、20、25、30、35、40和45 ℃)、不同pH(3、4、5、6、7、8、9、10)、不同NaCl质量浓度(10、20、30、40、50和60 g/L)、不同外加碳氮源(葡萄糖、蔗糖、乙酸钠、蛋白胨、尿素、硫酸铵)进行单因素实验,设置培养箱转速为180 r/min进行菌液培养,间隔2 h取一次样,测定各个样品的OD414与OD600,并计算甲醛降解率,最终确定其最适宜的甲醛降解条件。
菌株在不同初始甲醛质量浓度下的降解,根据以上实验确定的最佳接种量、温度、pH值以及NaCl质量浓度接种于不同初始甲醛质量浓度(200~1 000 mg/L)的无机盐培养基中,在180 r/min的培养箱中间隔2 h取一次样,测定培养基中的生物量和甲醛含量,以上实验均重复3次。
1.2.5 甲醛降解动力学分析
在微生物降解甲醛的过程中,降解底物甲醛既作为微生物的唯一碳源,又因为其毒性会对微生物生长产生抑制作用,因此本研究采用three-half-order动力学方程[17]来描述不同初始甲醛质量浓度的降解动力学,如公式(4)所示:
(4)
式中:t为时间,h;St为t时的甲醛质量浓度,mg/L;S0为初始甲醛质量浓度,mg/L;k1为一阶速率常数;k2为二阶速率常数。
用Origin软件将实验数据与动力学方程拟合。
2 结果与分析
2.1 甲醛降解菌的筛选与鉴定
通过甲醛培养基培养、筛选分离得到其中对甲醛降解能力最强的菌株,将其命名为WY0。WY0为革兰氏阴性菌,菌落表面平整,不透明,菌体为杆状,大小在1.8~2.0 μm,菌株WY0的扫描电镜照片及具体的菌落形态如图1所示,菌株的生理生化结果如表1所示。
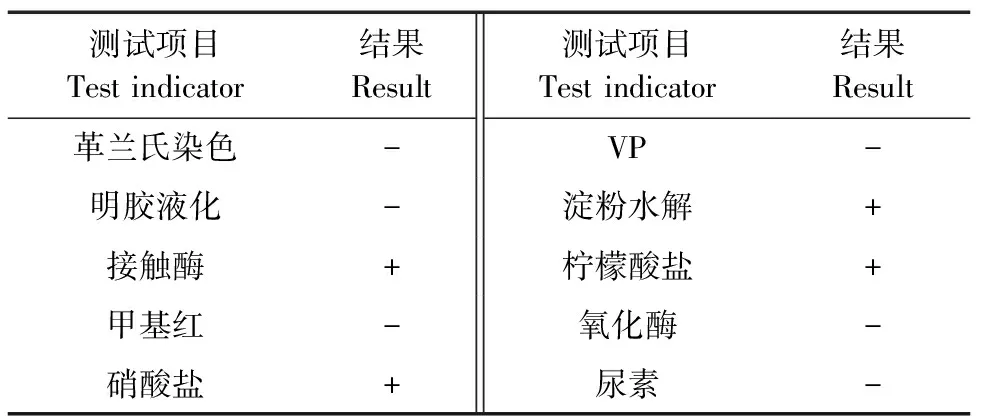
表1 菌株的生理生化实验结果
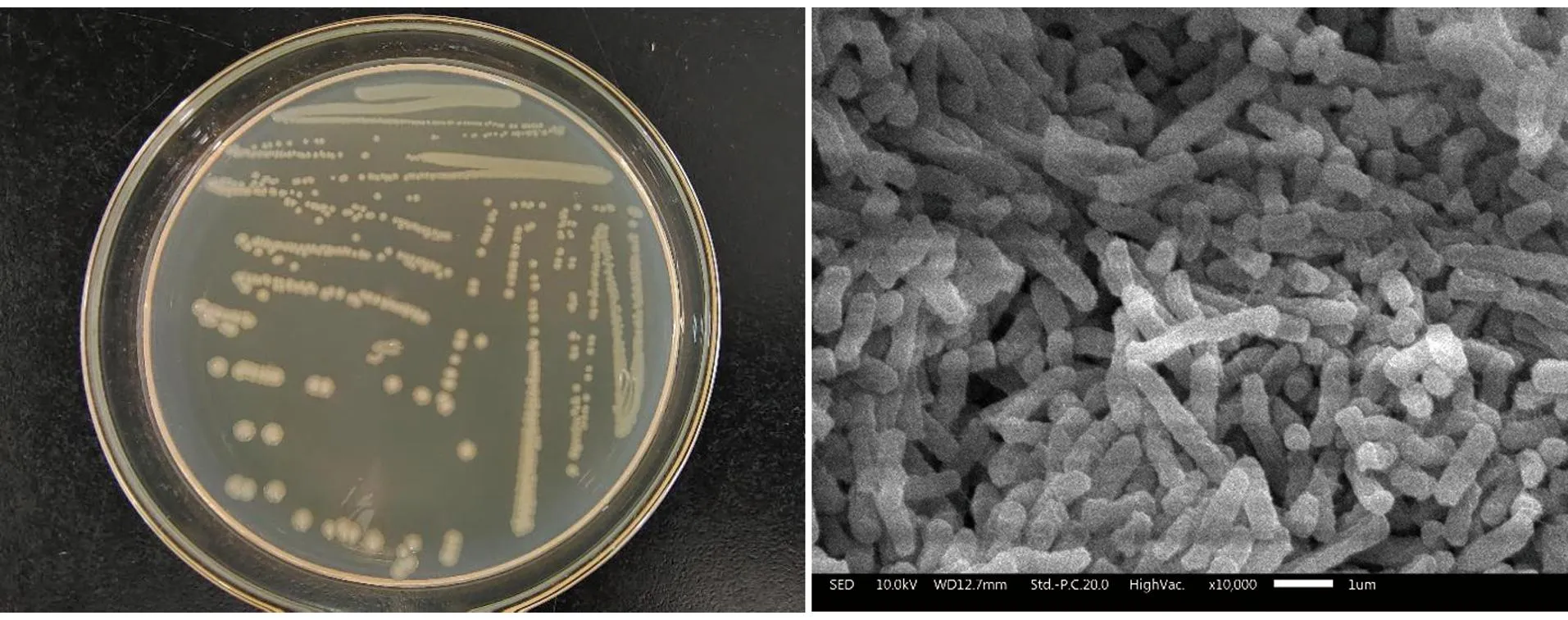
图1 菌株WY0在LB培养基及扫描电镜下的形态(10 000×)
菌株WY0的16Sr DNA序列进化树如图2所示。菌株WY0与马氏无色杆菌(A.marplatensisEU150134)相似性为99.85%,根据同源性结果分析该菌株为马氏无色杆菌(A.marplatensis)。该菌株的基因序列已提交至NCBI,其注册号为ON872520。
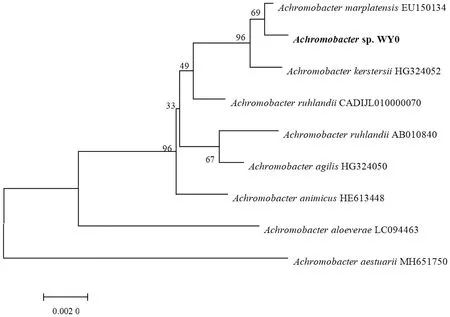
图2 菌株WY0的16S rDNA序列进化树
2.2 菌株的生长曲线及模型拟合
菌株WY0的生长曲线如图3所示。菌株整个生长过程中存在4 h的迟缓期,随后生长速率快速提高,在4~8 h达到最大,随之进入对数生长期,直至第24小时达到对数生长期末期,此阶段培养基中WY0的菌密度在2.0上下波动。经过SGompertz模型拟合,R2=0.98,通过公式(1)、公式(2)计算得到菌株的xc为3.44 h;最大比增长速率U=a×k/e=0.603。
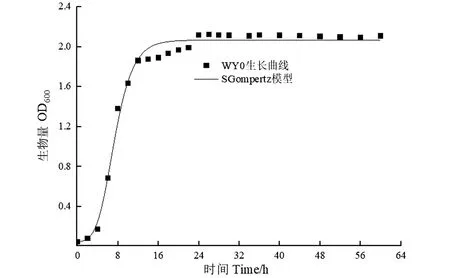
图3 SGompertz模型拟合的Achromobacter sp.WY0的生长曲线
2.3 接种量对菌株WY0降解甲醛的影响
从图4可以看出,当接种量体积分数为4%时,18 h内对200 mg/L甲醛的降解率为69.4%,并且前6 h存在明显的降解迟缓期,当接种量体积分数逐步增加至6%~8%时,菌株的甲醛降解效率显著提升,对应的迟缓期也逐步缩短;当接种量体积分数为10%~12%时,18 h内WY0可将培养基中200 mg/L的甲醛完全降解,而当接种量体积分数为14%时,甲醛降解效率有所降低,仅有92.35%。显然,适当提升接种量有助于提高微生物的甲醛降解效率,但过高的接种量对会加剧微生物之间的竞争关系,导致降解效率下降。综合考虑选择体积分数10%作为实验中菌株WY0的最佳接种量。
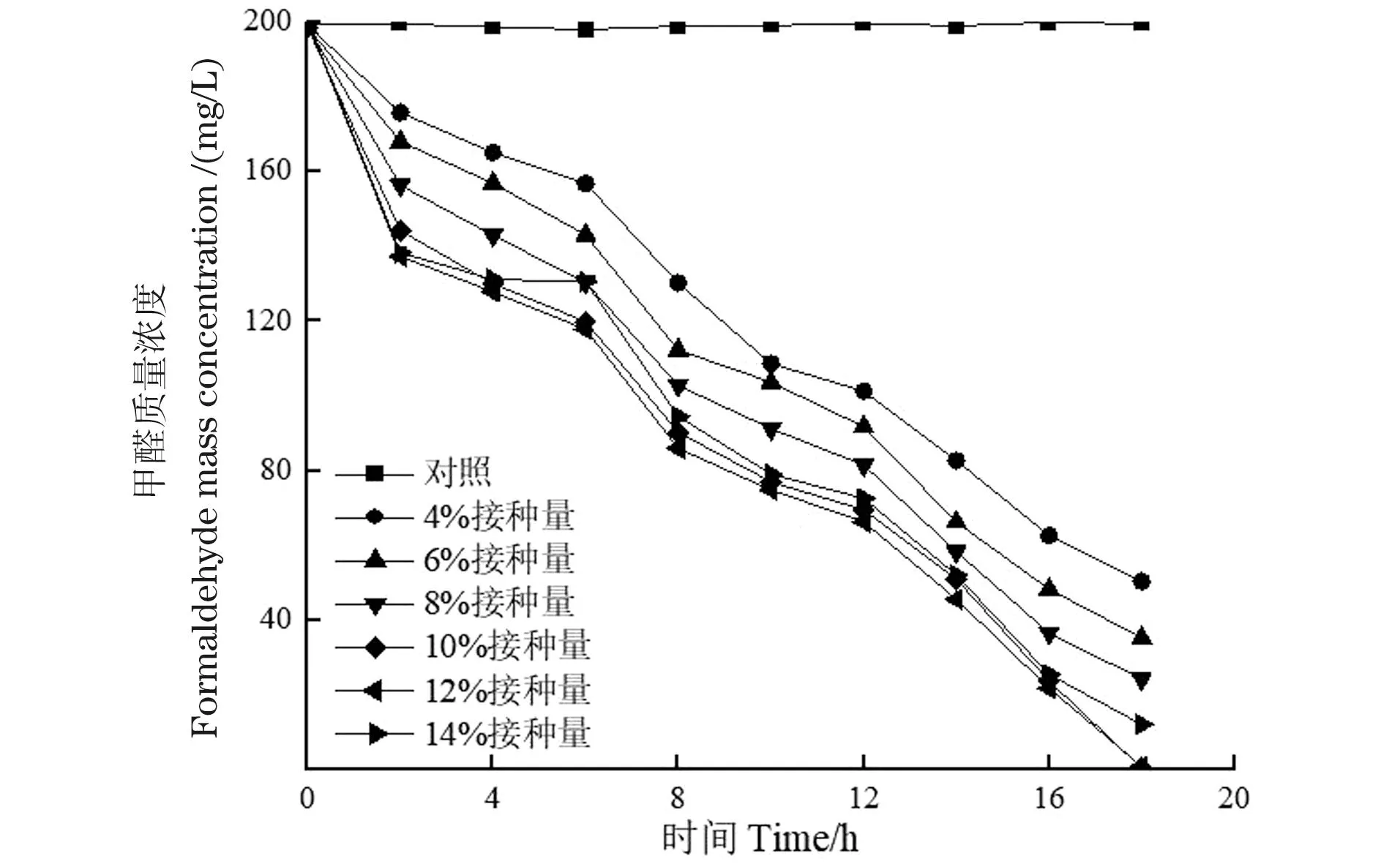
图4 不同接种量对菌株WY0生长及降解甲醛的影响
2.4 温度对菌株WY0降解甲醛的影响
从图5可以看出,菌株最适生长和降解甲醛的温度为30 ℃(甲醛降解率为99.75%、OD600为0.9),并且在25~35 ℃对200 mg/L的甲醛降解率都在85%以上,同时菌株也呈现出良好的生长状态。同时由图5也可知,该菌株在15 ℃降解率为15.3%,在45 ℃降解率为20.1%且生物量也很低,这可能是因为温度过高和过低都会使与甲醛降解的酶活性降低甚至失活,使菌株代谢速率变慢,从而影响菌株对甲醛的降解。
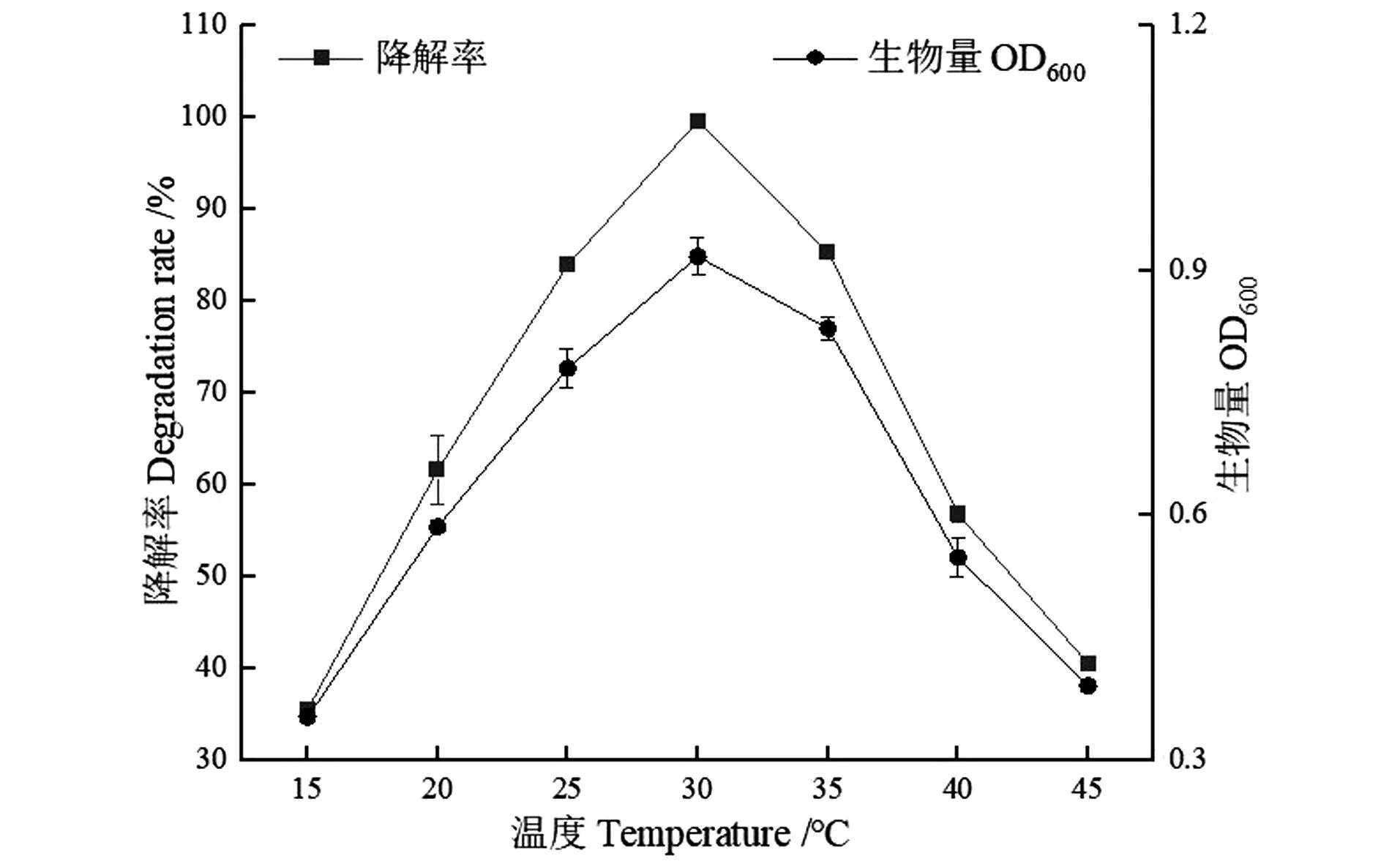
图5 温度对菌株WY0生长及降解甲醛的影响
2.5 pH对菌株WY0降解甲醛的影响
pH对WY0甲醛降解效果、菌密度的影响如图6所示。当pH 3~6时,pH与甲醛降解率、WY0菌密度呈现正向相关性,在pH 6时,WY0在18 h的OD600值达到最高,为0.9,甲醛的降解率也达到最大;当pH 6~10时,pH与甲醛降解率、WY0菌密度呈现负向相关性,碱性条件严重抑制WY0对甲醛的降解。因此WY0的最适甲醛降解pH为6。
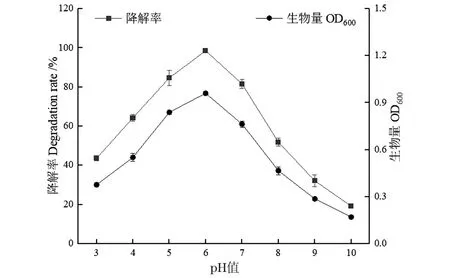
图6 pH对菌株WY0生长及降解甲醛的影响
2.6 NaCl质量浓度对菌株WY0降解甲醛的影响
由图7可知,当培养基的NaCl为10 g/L时,菌株WY0对甲醛的降解率最高,为99.25%。随着盐度的增加,菌株WY0的生长情况及对甲醛的降解率也随之降低。当盐分为20~30 g/L时,盐度的提高对菌株的生长抑制作用相对较小,甲醛去除率的下降幅度不大,该菌可适合此含盐废水环境。当盐分增加至40~60 g/L时,菌株对甲醛的去除率影响较大,尤其是在盐度为60 g/L时,甲醛去除率下降至20%以下。可能原因是超高盐度破坏菌株细胞渗透压平衡,再加上甲醛本身对菌株的毒害作用,使菌株在不良环境下难以生存,代谢缓慢,对WY0去除甲醛产生明显的抑制作用。
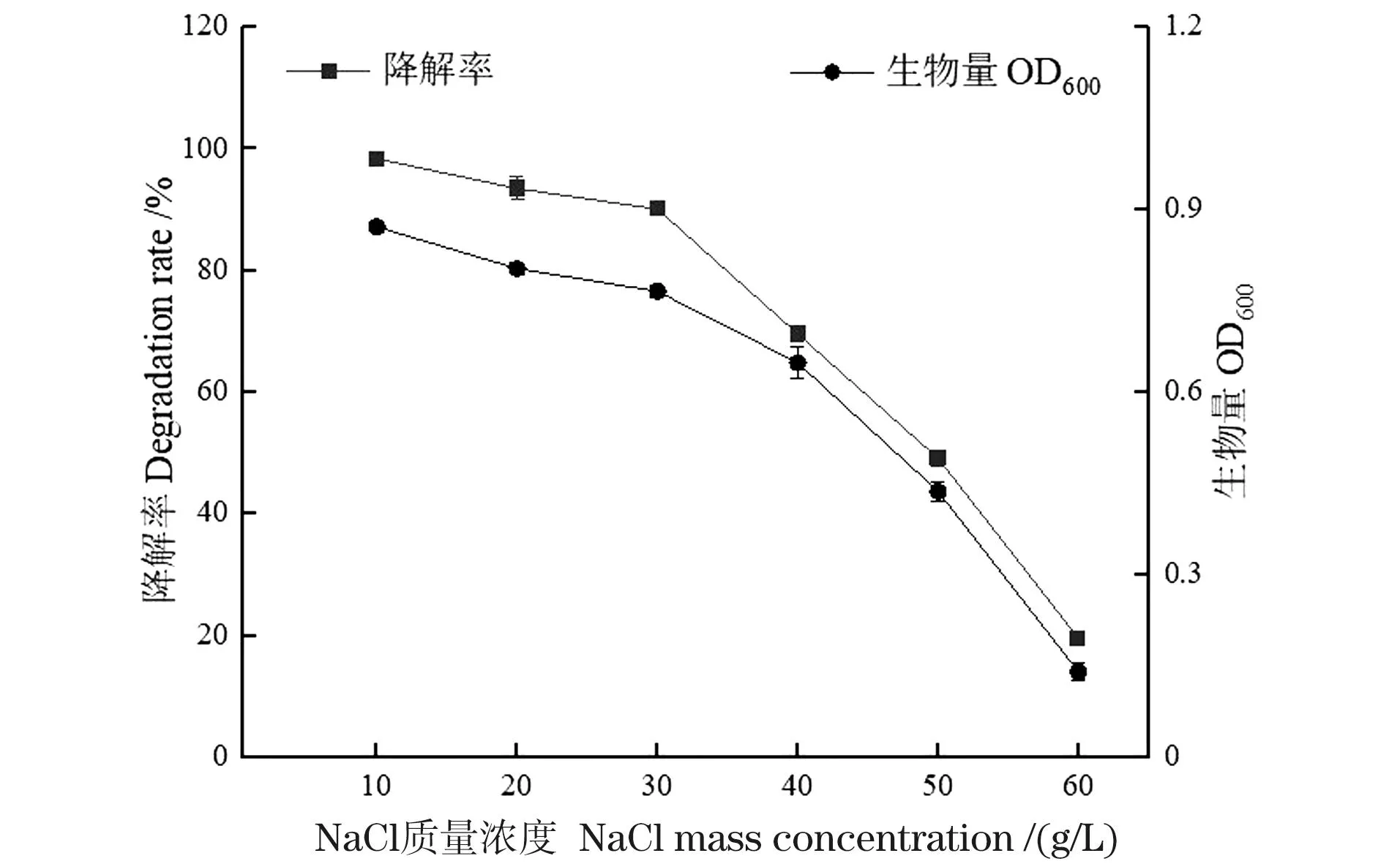
图7 NaCl对菌株WY0生长及降解甲醛的影响
2.7 外加碳氮源对菌株WY0降解甲醛的影响
不同碳氮源对WY0降解甲醛的影响如图8所示。添加碳氮源对菌株WY0降解甲醛具有显著影响,含有外加碳氮源的实验组相同时间对甲醛的降解率均高于对照组。显然,WY0更容易利用葡萄糖,葡萄糖实验组菌株的甲醛速率最快,12 h即可完全降解200 mg/L的甲醛。外加碳氮源为菌株WY0提供了更丰富的营养环境,进而促进其对甲醛的降解。
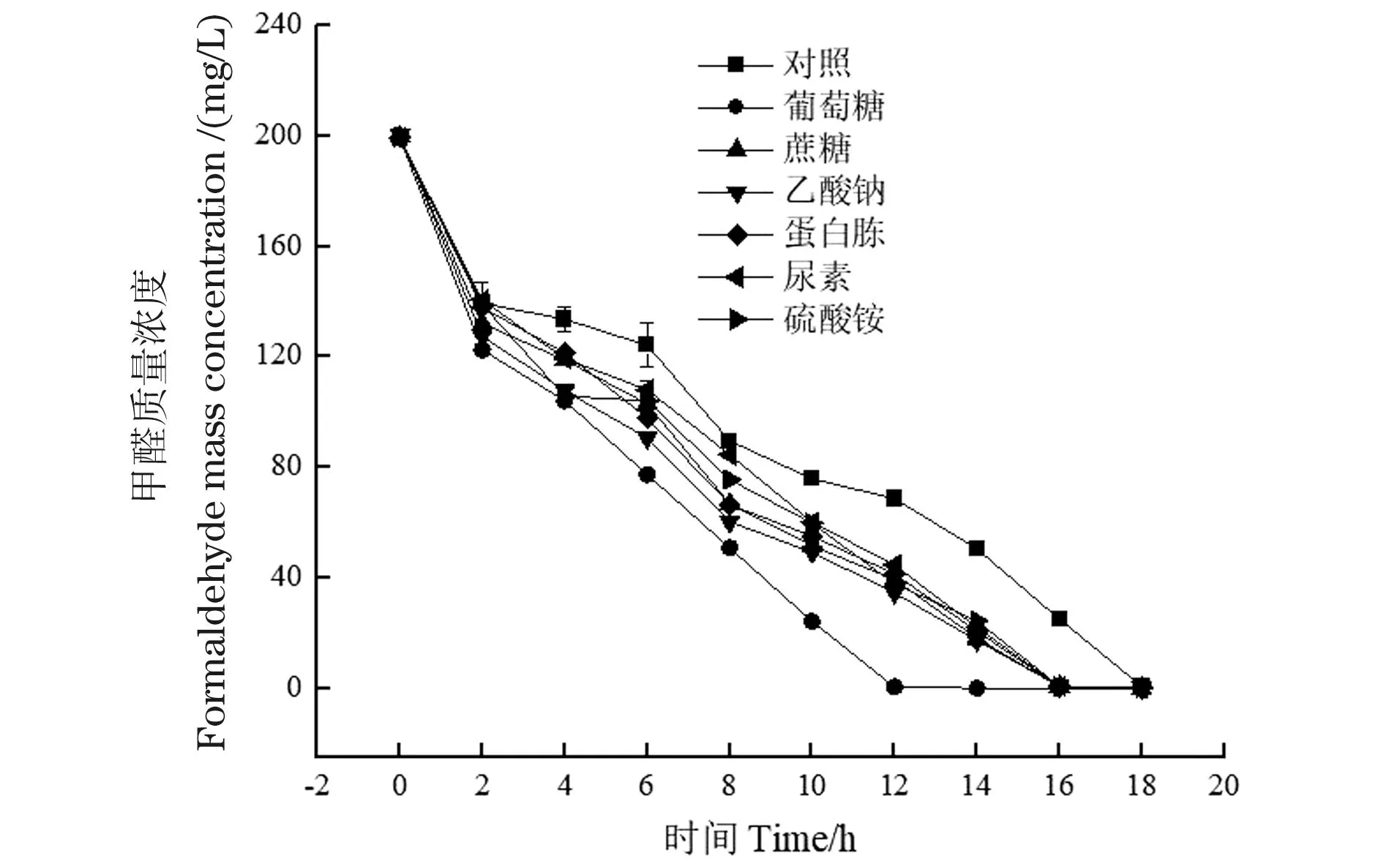
图8 外加碳氮源对菌株WY0降解甲醛的影响
2.8 菌株WY0生长与甲醛降解
WY0降解200 mg/L甲醛过程中其生长状态与甲醛质量浓度随时间的变化曲线(最优降解条件下)见图9。由图9可知,WY0经历了近4 h的迟缓期,在此期间甲醛质量浓度下降缓慢,4 h后进入快速降解阶段,甲醛质量浓度快速下降,并在18 h后达到稳定期,此时培养基中WY0的菌密度达到0.93,甲醛的降解率也达到99.2%,整个降解过程中甲醛降解速率保持稳定。
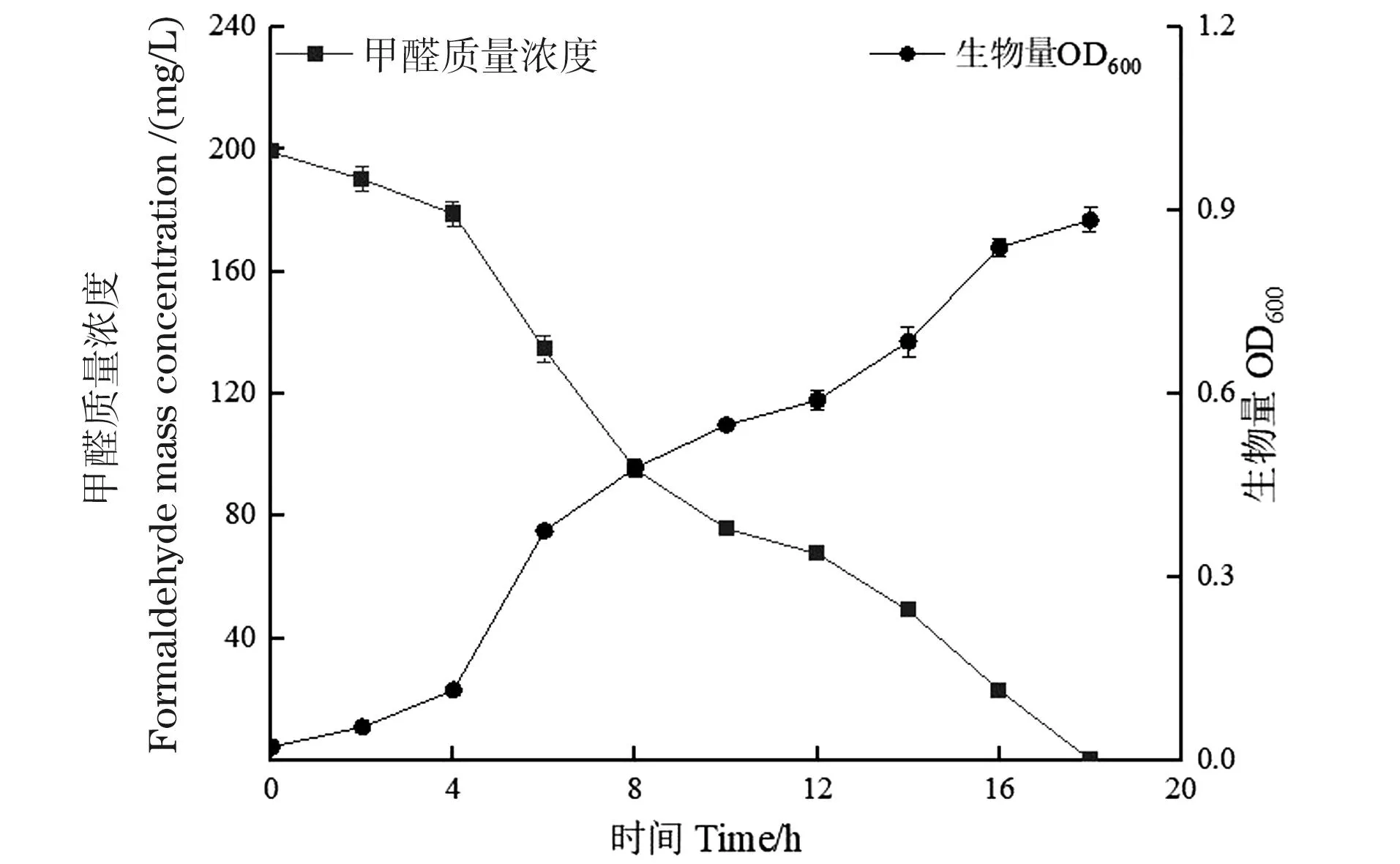
图9 最佳条件下菌株WY0的生长及甲醛降解曲线
2.9 甲醛降解率动力学
菌株在不同初始甲醛质量浓度下随时间的变化如图10所示。当初始甲醛质量浓度为200 mg/L时,WY0完成降解过程需18 h。随着初始甲醛质量浓度的不断提高,菌株的迟缓期也相应增加。当甲醛质量浓度为500 mg/L时,WY0的降解过程受到一定程度抑制,50 h才达到98.71%的降解率。而初始甲醛质量浓度为900 mg/L时,菌株降解甲醛的时间进一步增加。随着甲醛质量浓度进一步提升至1 000 mg/L,菌株WY0无法正常降解甲醛。实验结果表明,甲醛质量浓度高于900 mg/L时,菌株WY0的生长和降解过程受到明显抑制,迟缓期大大延长。
为了模拟WY0降解甲醛的动力学行为,采用Three-Half-Order对WY0在不同初始甲醛质量浓度下的降解过程进行拟合,不同初始甲醛质量浓度下three-half-order模型方程拟合结果如图11所示,模型回归参数统计结果如表2所示。相关系数(R2)值均大于0.96,表明WY0的甲醛降解过程与three-half-order模型良好吻合。
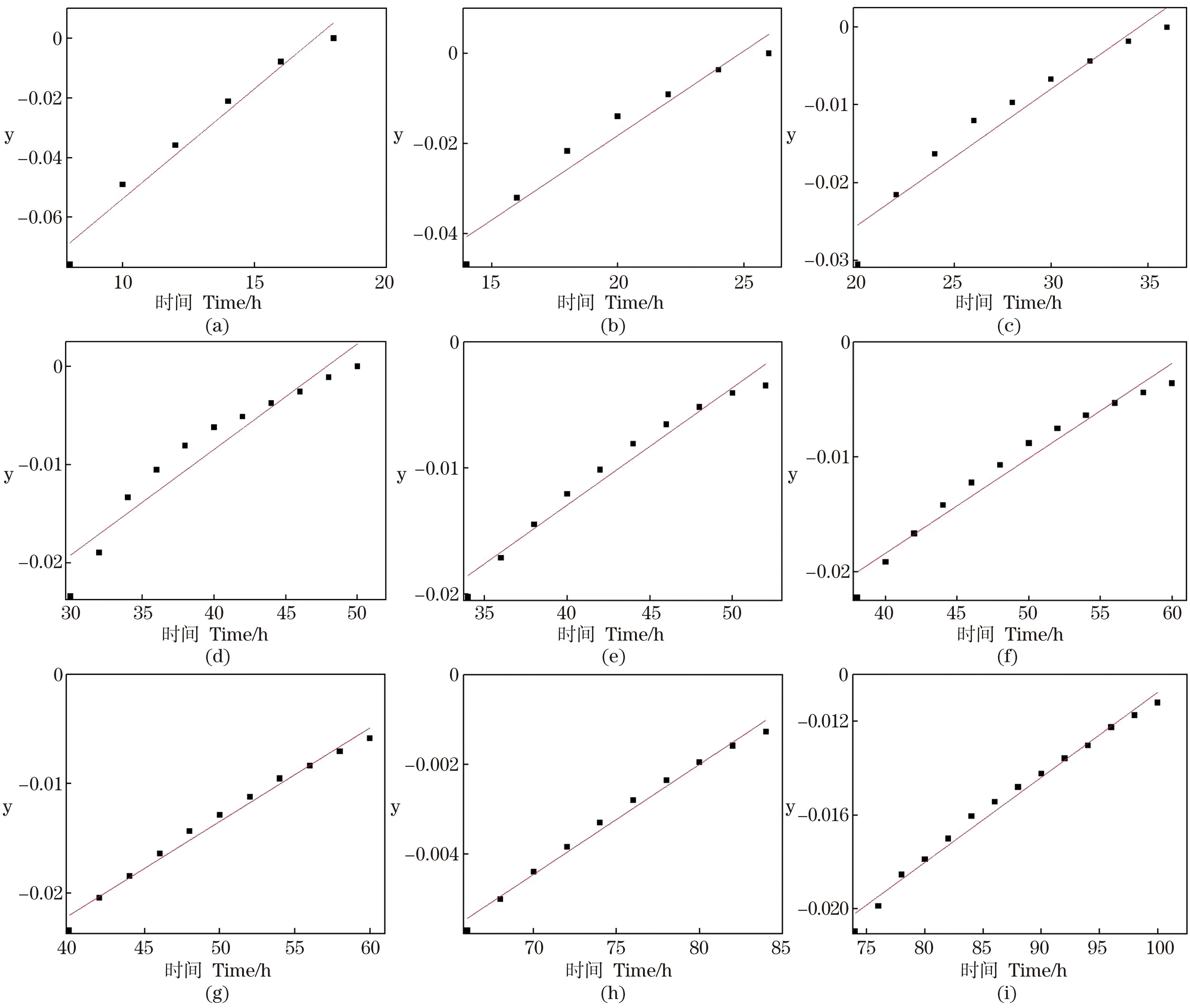
(a)~(i)分别为甲醛质量浓度200~1 000 mg/L。
3 讨论与结论
探究了不同环境因子对WY0菌株降解甲醛的影响及其降解动力学,分别从接种量、温度、pH、NaCl质量浓度、碳氮源种类及不同初始甲醛质量浓度下菌株WY0的降解过程等方面展开讨论。
接种量大小会对菌株降解底物的过程产生直接的影响,接种量过小会使菌株生长缓慢;接种量大时,会增加反应体系的负荷[18]。WY0接种量体积分数为4%、6%、8%时,甲醛降解效率明显偏低,难以抵抗甲醛的毒害作用,而接种量体积分数为12%、14%时,相对于10%接种量WY0的降解效率并没有显著提升,这很好地印证了上述结论。
温度是影响微生物生长繁殖的重要因素,温度不适合可能导致酶功能受损,最终减缓生物代谢,导致甲醛降解缓慢且效率低下[19]。WY0具有典型的嗜中温的特点,在30 ℃的条件下有着极为高效的甲醛降解能力,与Li等[20]由土壤中筛选的甲醛降解菌相一致。
pH影响菌株对碳源、氮源等营养物质的吸收以及生理生化酶的活性[21],pH对菌株降解甲醛的影响研究结果也表明,pH对甲醛降解菌WY0的生长情况和降解性能具有较为显著的影响,且菌株WY0对甲醛的降解率与其生长情况呈正相关,这与孔芳等[22]的研究相似。
NaCl质量浓度过高容易使微生物发生盐析作用,对其胞内生理生化酶与代谢活性造成破坏,抑制其生长[23]。一旦微生物生长环境中盐质量浓度超标,极易降低微生物对甲醛的处理效率。本研究中菌株WY0的最佳NaCl质量浓度为10 g/L,说明相比低盐或无盐条件,菌株在一定盐浓度条件下更容易生长,这与颜培等[24]的研究结果相似。此外,菌株WY0虽然能耐受一定的盐质量浓度(30 g/L),但超过其耐受范围时,超高浓度的盐离子会抑制微生物的呼吸系统及酶系统,对菌株代谢活动产生不利影响[25],使其甲醛降解效率严重降低。
不同甲醛质量浓度下的降解过程均可分为两个阶段:初始迟缓期和快速降解期[26],两阶段的降解程度又取决于初始甲醛质量浓度。菌株WY0在最佳降解条件下对200 mg/L甲醛的降解过程中,存在4 h的短期迟缓期,而后保持稳定的降解速率直至降解完成,而周雪媚等[27]筛选的甲醛降解菌Pseudomonasputida在降解400 mg/L甲醛的过程中前8 h反应迅速,无迟缓期,但在8 h后进入稳定期,降解速率大幅降低,相比之下菌株WY0表现出良好的降解稳定性。
动力学过程分析显示,菌株WY0对不同含量甲醛的降解过程与Three-Half-Order模型良好吻合,k1随着甲醛质量浓度的增大呈现减小的趋势,说明在甲醛质量浓度增大的过程中一阶降解速率随之减少,但并未对不同质量浓度下快速降解期的降解速率产生明显影响。
基于上述特性,A.marplatensis(WY0)在甲醛污染修复领域具有较高的应用价值,但不能忽视其生物安全性。参考《人间传染的病原微生物名录》的分类原则,WY0为微生态活菌中除芽孢杆菌与条件致病菌以外的范畴,属于第四类病原微生物,是通常不会引起人或动物发生疾病的微生物[28],且对植物具有良好的健康促进作用[29-30],具有较高的生物安全性及研究价值。
本研究从活性污泥中分离出一株甲醛降解菌,经鉴定分析为无色杆菌属(Achromobactersp.),命名为WY0,其最大生长速率所需时间xc为3.44 h(SGompertz模型),相关性系数R2为0.989。WY0能够在18 h完全降解200 mg/L的甲醛,在接种量10%,生长温度30 ℃,pH 6的条件下甲醛降解效果最佳。其降解不同初始质量浓度甲醛动力学与Three-Half-Order动力学模型拟合良好,相关性系数(R2)均大于0.96,一阶速率常数k1与甲醛质量浓度呈负相关。WY0在耐盐性、甲醛降解效率、安全性等特性方面均具有较大的优势,可作为良好的甲醛污染治理材料。

