lncRNA SNHG15通过调控miR-942-5p表达减轻Aβ25-35诱导的PC12细胞氧化应激和细胞凋亡的研究*
张文娟,戴婷丽,李 沛
青海省人民医院:1.健康管理部;2.病理科;3.神经内科,青海西宁 810000
阿尔茨海默病(AD)是一种慢性进行性神经系统退行性疾病,其发病机制复杂,与β淀粉样蛋白(Aβ)沉积、tau蛋白神经纤维缠结、神经元丢失、神经炎症、氧化应激等密切相关,AD患者脑中神经元丢失的机制可能是凋亡引起的;目前药物治疗只能改善一些症状,还有部分患者治疗不佳[1-3]。研究表明长链非编码RNA(lncRNA)参与了AD相关的病理生理学进展,确定lncRNA相关的竞争性内源RNA网络可以有助于AD诊断和未来治疗策略[4]。小核仁RNA宿主基因15(SNHG15)是一种lncRNA,研究报道lncRNA SNHG15可通过调节微小RNA(miR)-455-3p/肿瘤蛋白P53诱导性核蛋白1轴促进氧-葡萄糖剥夺/复氧诱导的神经元凋亡、炎症和氧化损伤[5]。抑制lncRNA SNHG15通过靶向miR-183-5p/叉头转录因子1轴防止脑缺血再灌注损伤[6]。StarBase在线分析软件预测发现lncRNA SNHG15与miR-942-5p有结合位点。研究报道miR-942-5p在氧化低密度脂蛋白诱导的血管内皮细胞中表达下调,circ_0003204通过调节miR-942-5p/组蛋白去乙酰化酶9调控氧化低密度脂蛋白诱导的血管内皮细胞中的细胞生长、氧化应激和炎症[7]。但尚未有报道明确lncRNA SNHG15和miR-942-5p在AD中的功能和调节机制。因此,本实验旨在探讨miR-942-5p参与的AD细胞模型中,lncRNA SNHG15对β淀粉样蛋白25-35(Aβ25-35)诱导的PC12细胞氧化应激和凋亡的机制。
1 材料与方法
1.1材料 源自大鼠肾上腺嗜铬细胞瘤的PC12细胞购自美国ATCC公司,DMEM培养基、Aβ25-35购自美国Sigma公司,lncRNA SNHG15小干扰RNA(si-SNHG15)、miR-942-5p模拟物(miR-942-5p)、miR-942-5p抑制剂(anti-miR-942-5p)及相应的阴性对照si-NC、miR-NC、anti-miR-NC购自上海生工生物公司,Trizol试剂、荧光定量试剂盒、逆转录试剂盒购自日本Takara公司,miRNA提取试剂盒购自上海翌圣生物公司,miRNA逆转录试剂盒购自上海博尔森公司,超氧化物歧化酶(SOD)试剂盒、丙二醛(MDA)试剂盒购自上海碧云天生物公司,蛋白提取试剂盒、双荧光素酶报告基因试剂盒、凋亡检测试剂盒购自北京索莱宝公司,抗体B细胞淋巴瘤-2(Bcl-2)蛋白、Bcl-2相关X蛋白(Bax)、甘油醛-3-磷酸脱氢酶(GAPDH)、羊抗兔二抗购自英国abcam公司。
1.2方法
1.2.1细胞处理、分组 采用DMEM培养基培养PC12细胞,以40 μg/L的Aβ25-35处理PC12细胞建立损伤模型,记为Aβ25-35组,正常培养的细胞记为Con组;将si-SNHG15、si-NC、miR-942-5p及miR-NC转染至PC12细胞后用40 μg/L的Aβ25-35处理,记为Aβ25-35+si-SNHG15组、Aβ25-35+si-NC组、Aβ25-35+miR-942-5p组、Aβ25-35+miR-NC组;将lncRNA SNHG15干扰表达载体分别与miR-942-5p抑制剂、阴性对照转染至PC12细胞后用40 μg/L的Aβ25-35处理,记为Aβ25-35+si-SNHG15+anti-miR-942-5p组、Aβ25-35+si-SNHG15+anti-miR-NC组。
1.2.2实时荧光定量PCR(qRT-PCR)检测lncRNA SNHG15、miR-942-5p相对表达水平 提取各组细胞总RNA,逆转录成cDNA,按照荧光定量试剂盒进行qRT-PCR,以GAPDH、U6为内参,用2-ΔΔCt法计算lncRNA SNHG15、miR-942-5p相对表达水平,其中miR-942-5p通过使用特定的RNA提取试剂盒并通过茎环法逆转录成cDNA然后进行PCR反应。lncRNA SNHG15上游引物序列:5′-CACAAGAGTGCCTGCCATC-3′,下游引物序列:5′-GGCAGCCACTGAAGGTATC-3′; miR-942-5p上游引物序列:5′-AGGGTCTTCTCTGTTTTGGC-3′,下游引物序列:5′-GTTGTGGTTGGTTGGTTTGT-3′。
1.2.3酶联免疫吸附试验检测SOD活性、MDA表达水平 收集各组细胞,胰酶消化后,离心,收集上清液,通过使用相应的试剂盒检测细胞SOD活性和MDA表达水平,具体操作步骤严格按试剂盒说明书进行。采用酶标仪检测各组指标吸光度,最后绘制标准曲线,分析其表达水平变化。
1.2.4流式细胞术检测细胞凋亡 收集各组细胞,使用预冷的磷酸盐缓冲液(PBS)洗涤后加入500 μL的结合缓冲液重悬细胞,然后加10 μL Annexin V-FITC和5 μL PI,避光孵育10 min,快速使用流式细胞仪检测细胞凋亡情况。
1.2.5蛋白质印迹法(Western blot)检测蛋白表达 收集各组细胞,加入含蛋白酶抑制剂的裂解液提取各组细胞总蛋白,参照BCA蛋白定量试剂盒操作步骤检测蛋白质浓度。蛋白质变性后使用10%聚丙烯酰胺凝胶进行电泳并转至聚偏二氟乙烯膜,加入5%脱脂牛奶在室温下将膜封闭1 h,然后加入Bax、Bcl-2、GAPDH一抗(1∶1 000),在4 ℃孵育过夜,加二抗(1∶2 000)室温孵育2 h后采用ECL法显影,采用凝胶成像分析仪扫描条带灰度值,以GAPDH为内参,分析Bax、Bcl-2蛋白条带的灰度值。
1.2.6双荧光素酶报告实验 构建lncRNA SNHG15野生型、突变型荧光素酶载体(WT-SNHG15和MUT-SNHG15)。将PC12细胞接种到6孔板中,使用Lipofectamine 2000转染试剂将WT-SNHG15和MUT-SNHG15分别与miR-NC或miR-942-5p mimics共转染至细胞,24 h后按照说明书检测荧光素酶活性。
将pcDNA、pcDNA-SNHG15、si-NC、si-SNHG15转染至PC12细胞,用1.2.2中方法检测miR-942-5p表达水平。
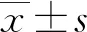
2 结 果
2.1lncRNA SNHG15、miR-942-5p在Aβ25-35诱导的PC12细胞中的表达 与Con组比较,Aβ25-35组PC12细胞中lncRNA SNHG15表达水平升高,miR-942-5p表达水平降低(P<0.05),见表1。

表1 lncRNA SNHG15和miR-942-5p在Aβ25-35诱导的PC12细胞中的表达
2.2抑制lncRNA SNHG15表达对Aβ25-35诱导的PC12细胞氧化应激和凋亡的影响 Aβ25-35组PC12细胞中lncRNA SNHG15、MDA、Bax表达水平及细胞凋亡率较Con组高,SOD活性、Bcl-2表达水平较Con组低(P<0.05);Aβ25-35+si-SNHG15组PC12细胞中lncRNA SNHG15、MDA、Bax表达水平及细胞凋亡率较Aβ25-35+si-NC组低,SOD活性、Bcl-2表达水平较Aβ25-35+si-NC组高(P<0.05)。见图1、表2。
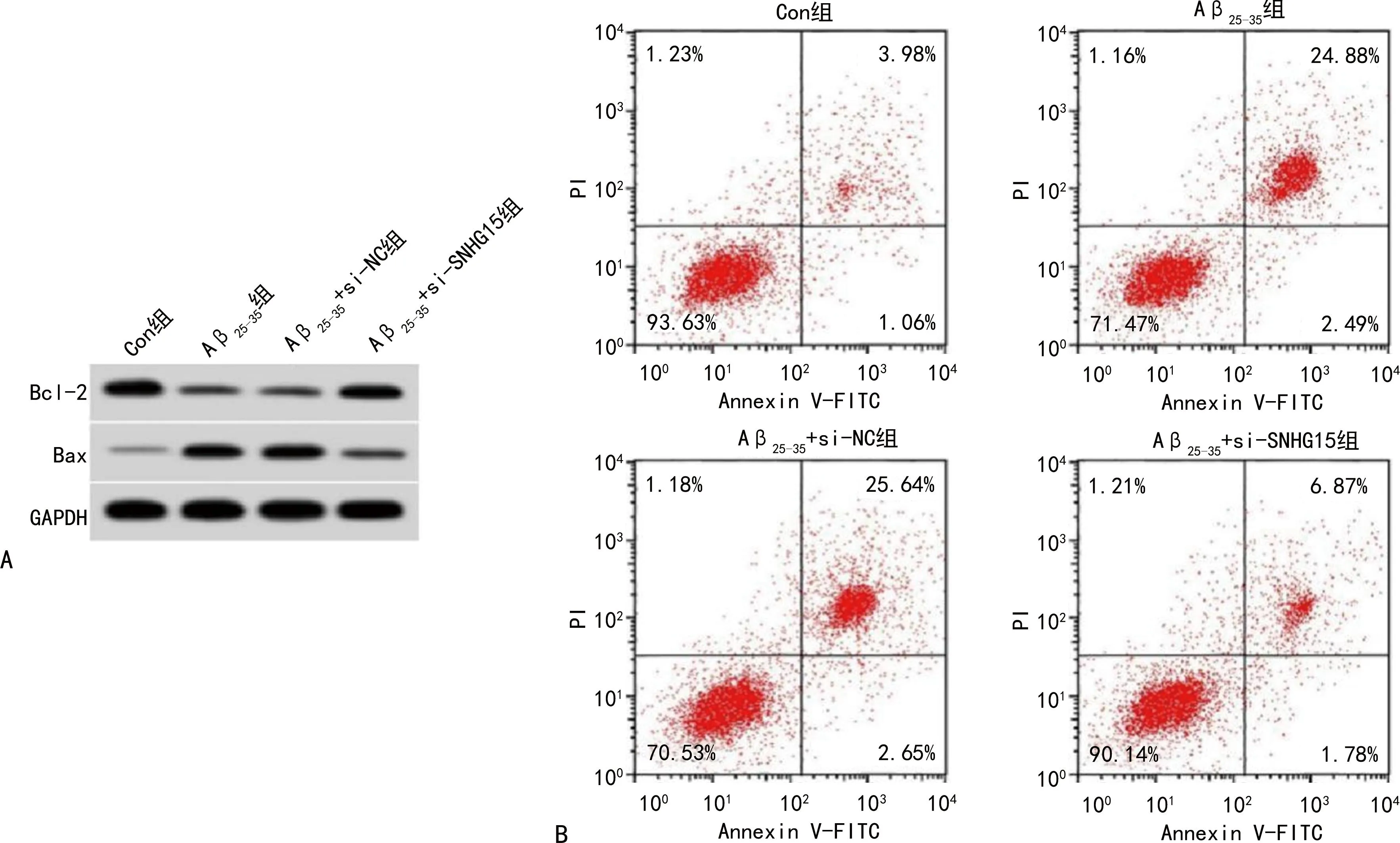
注:A为凋亡相关蛋白Western blot效果图;B为细胞凋亡流式图。

表2 抑制lncRNA SNHG15表达对Aβ25-35诱导的PC12细胞氧化应激和凋亡的影响
2.3lncRNA SNHG15靶向调控miR-942-5p StarBase在线分析软件预测lncRNA SNHG15与miR-942-5p有互补的核苷酸序列,见图2。双荧光素酶报告结果显示,与miR-NC+WT-SNHG15比较,miR-942-5p+WT-SNHG15相对荧光素酶活性下降(P<0.05),与miR-NC+MUT-SNHG15比较,miR-942-5p+MUT-SNHG15相对荧光素酶活性基本不变(P>0.05),见表3。pcDNA-SNHG15组miR-942-5p表达水平(0.42±0.04)低于pcDNA组(1.00±0.06),差异有统计学意义(P<0.05),si-SNHG15组miR-942-5p表达水平(3.23±0.33)高于si-NC组(1.01±0.06),差异有统计学意义(P<0.05)。
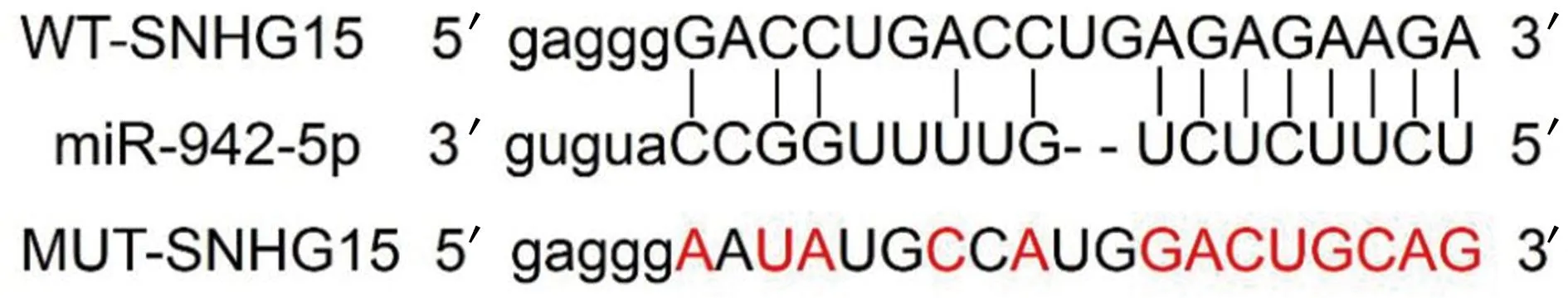
图2 lncRNA SNHG15与miR-942-5p互补的核苷酸序列

表3 双荧光素酶报告实验结果
2.4miR-942-5p过表达对Aβ25-35诱导的PC12细胞氧化应激和凋亡的影响 Aβ25-35+miR-942-5p组SOD活性、miR-942-5p、Bcl-2表达水平较Aβ25-35+miR-NC组高,MDA、Bax表达水平及细胞凋亡率较Aβ25-35+miR-NC组低(P<0.05),见图3、表4。

注:A为凋亡相关蛋白Western blot效果图;B为细胞凋亡流式图。

表4 miR-942-5p过表达对Aβ25-35诱导的PC12细胞氧化应激和凋亡的影响
2.5下调miR-942-5p表达逆转了抑制lncRNA SNHG15表达对Aβ25-35诱导的PC12细胞氧化应激和凋亡的作用 与Aβ25-35+si-SNHG15+anti-miR-NC组比较,Aβ25-35+si-SNHG15+anti-miR-942-5p组SOD活性、miR-942-5p、Bcl-2表达水平降低,细胞凋亡率及MDA、Bax表达水平升高(P<0.05),见图4、表5。

表5 下调miR-942-5p表达逆转了抑制lncRNA SNHG15表达对Aβ25-35诱导的PC12细胞氧化应激和凋亡的作用
3 讨 论
AD是一种起病隐匿的退行性神经系统疾病,在AD早期病理改变发生时,氧化应激发挥重要作用,Aβ可能为氧化应激作用下的适应性产物;抗氧化应激能力丧失和Aβ沉积,最终引起AD病理改变的发生与发展[8-10]。Aβ25-35通常用于诱导AD体外模型,Aβ25-35聚集在神经元周围,不仅对神经元有直接的毒性作用,还会增强神经元对氧化应激和自由基的敏感性,导致神经元凋亡[11]。SOD是抗氧化酶,MDA是脂质过氧化产物,它们均是氧化应激指标,已有研究发现,AD患者血清中MDA表达水平升高,SOD活性降低[12]。本实验用Aβ25-35诱导PC12细胞建立AD细胞模型,结果显示,PC-12细胞中SOD活性、Bcl-2表达水平降低,MDA、Bax表达水平及细胞凋亡率升高,表明Aβ25-35诱导了PC12细胞凋亡和氧化应激的产生,提示AD细胞模型建立成功。
有研究发现,lncRNA可以与各种RNA和蛋白质相互作用调控细胞增殖、分化、凋亡等生命过程,在维持细胞生理状态,以及一系列人类疾病中起着关键作用,包括神经退行性疾病,一些lncRNA可以通过Aβ沉积、突出重塑和记忆形成参与AD的病理过程[13-14]。研究报道lncRNA SNHG15在心肌梗死患者和缺氧心肌细胞中高表达,其可通过调控miR-188-5p/磷酸酶及张力蛋白同源基因轴调节缺氧/再灌注损伤后的心肌细胞凋亡[15]。缺血皮质中lncRNA SNHG15表达水平升高,其过表达增强了氧糖剥夺/复氧介导的神经元凋亡及小胶质细胞氧化应激和炎症因子的表达[16]。本实验结果显示,Aβ25-35诱导PC12细胞后,lncRNA SNHG15表达上调,与上述研究类似,提示lncRNA SNHG15可能参与AD疾病的发展过程。抑制lncRNA SNHG15表达可以抑制Aβ25-35诱导的PC12细胞凋亡,降低氧化应激反应,但lncRNA SNHG15在AD中的作用机制尚不清楚。
已发现lncRNA可通过靶向调节miRNA参与AD发生过程。例如,β位淀粉样前体蛋白裂解酶1在Aβ诱导的神经细胞中表达增加,抑制β位淀粉样前体蛋白裂解酶1可通过靶向下调miR-374b-5p减轻神经细胞炎症,增强神经元活力[17]。目前的研究发现,脂多糖处理的HK-2细胞中miR-942-5p表达水平降低,miR-942-5p过表达通过靶向叉头框蛋白O3A抑制脂多糖诱导的HK-2细胞炎症和凋亡[18]。lncRNA SOX2-OT通过靶向miR-942-5p/DP5加重阿霉素诱导的心肌细胞凋亡[19]。上述研究表明,miR-942-5p与细胞凋亡和炎症相关,但其在AD中的作用还不明确。本研究结果显示,Aβ25-35诱导的PC12细胞中miR-942-5p表达水平降低,且过表达miR-942-5p可抑制Aβ25-35诱导的PC12细胞凋亡和氧化应激,提示miR-942-5p参与AD的发生过程。此外,本研究通过生物信息学预测和实验发现,lncRNA SNHG15可靶向下调miR-942-5p表达,推测抑制lncRNA SNHG15可能通过上调miR-942-5p减轻Aβ25-35诱导的细胞氧化应激,并抑制细胞凋亡,提示抑制lncRNA SNHG15可通过上调miR-942-5p来阻止AD的发展。深入研究后发现,下调miR-942-5p能够减弱lncRNA SNHG15低表达对Aβ25-35诱导的PC12细胞氧化应激和凋亡的阻碍作用,这也证实了笔者之前的推测。但本研究尚未证实lncRNA SNHG15和miR-942-5p在AD中的具体表达情况,后续将通过回顾性临床研究探索lncRNA SNHG15和miR-942-5p在AD患者中的表达来验证本研究推测,为AD的治疗提供分子靶点。
综上所述,在AD细胞模型中,抑制lncRNA SNHG15表达通过上调miR-942-5p表达减轻Aβ25-35诱导的PC12细胞氧化应激和细胞凋亡。这些结果为深入了解lncRNA SNHG15在AD进展中的作用提供了希望,并可能为寻找新的AD治疗方法和诊断标志物提供了可能。

