肢端肥大症患者生长激素、胰岛素样生长因子-1与骨代谢、糖脂代谢的相关性研究*
马 淼,刘 杰,马瑞敏,李萍燕,鲁 静,许惠文,于丹葳,张国军
首都医科大学附属北京天坛医院实验诊断中心/北京市免疫试剂临床工程技术研究中心/国家药监局体外诊断质量控制重点实验室,北京 100070
肢端肥大症是一种起病隐匿的慢性进展性内分泌代谢性疾病[1]。患者的临床表现多为生长激素(GH)、胰岛素样生长因子-1(IGF-1)长期过度分泌所致,并伴有心血管并发症、糖脂代谢并发症、呼吸系统并发症、骨和骨关节系统并发症[2]、神经系统并发症和肿瘤相关并发症等。我国肢端肥大症临床流行病学数据不详,国外报道肢端肥大症患病率为(2.8~13.7)/100 000,年发病率为(0.2~1.1)/100 000[3]。患病无明显的性别差异,确诊时中位年龄在40.5~47.0岁,延迟诊断长达4.5~9.0年,延迟诊断会显著增加肢端肥大症患者并发症发生率和治疗难度[1]。
既往研究发现,50%~70%的肢端肥大症患者并发骨关节病的概率是健康人群的2倍,常累及肩、膝和髋关节[4],肢端肥大症患者的椎体骨折患病率是健康人群的3~8倍[5],多数患者伴发糖脂代谢异常。肢端肥大症及其相关并发症严重影响患者的健康、生活质量与寿命。本研究通过对肢端肥大症患者血清GH、IGF-1与骨代谢标志物、糖代谢、脂代谢的指标进行相关性分析,为降低肢端肥大症患者骨和骨关节系统并发症发病率,降低患者因病致残的风险,早期诊断与干预患者糖脂代谢异常,提供实验依据。
1 资料与方法
1.1一般资料 回顾性分析了2019年5月至2023年5月首都医科大学附属北京天坛医院收治的37例确诊为肢端肥大症患者的临床资料,其中男17例,女20例,平均年龄(40.62±13.84)岁。纳入的肢端肥大症患者均符合肢端肥大症诊断标准;患者未使用过活性维生素D、降钙素、雌激素、糖皮质激素、免疫抑制剂等影响骨代谢的药物,未使用过降糖、降脂类药物。排除合并严重肝肾功能障碍、透析、恶性肿瘤等患者。
1.2仪器与试剂 采用西门子IMMULITE2000 XPi及其配套试剂测定GH、IGF-1水平。采用罗氏e602全自动免疫分析仪及其配套试剂测定25-羟维生素D[25(OH)D]、总Ⅰ型胶原氨基端延长肽(TP1NP)、骨钙素(BGP)、β胶原特殊序列(β-CTX)等骨代谢标志物水平。采用日立LABOSPECT 008/008AS全自动生化分析仪及其配套试剂检测钙离子(Ca2+)、磷离子、空腹血糖(FBG)、甘油三酯(TG)、胆固醇(CHO)、高密度脂蛋白(HDL)、低密度脂蛋白(LDL)等骨代谢、糖代谢、脂代谢指标水平。采用日立LABOSPECT 008/008AS全自动生化分析仪,采用德国德赛诊断系统有限公司载脂蛋白(Apo)A1测定试剂盒(免疫)检测ApoA1、采用德国德赛诊断系统有限公司ApoB测定试剂盒(免疫)检测ApoB。
1.3方法 肢端肥大症患者于清晨空腹采集静脉血5 mL,所有测定项目均采用促凝管。促凝管采集标本后,放置15 min,3 000 r/min离心10 min后,分离血清进行检测。
1.4统计学处理 采用SPSS26.0进行数据处理和分析,计量资料均进行正态性检验,符合正态分布数据采用Pearson相关性分析,不符合正态分布数据采用Spearman相关分析,以P<0.05为差异有统计学意义。
2 结 果
2.1肢端肥大症患者GH和IGF-1与骨代谢标志物的相关性分析 受检测量程限制,GH>40 ng/mL均按照GH=40 ng/mL统计。Pearson/Spearman相关性分析结果显示,肢端肥大症患者GH与TP1NP、BGP、β-CTX、磷离子呈正相关(P<0.05),与25(OH)D、Ca2+无关(P>0.05)。IGF-1与TP1NP、BGP、β-CTX、磷离子呈正相关(P<0.05),与25(OH)D、Ca2+无关(P>0.05),见表1。
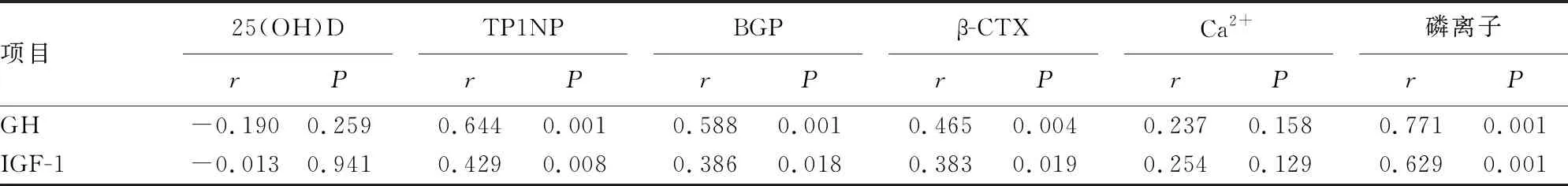
表1 肢端肥大症患者GH和IGF-1与骨代谢标志物的相关性分析
2.2肢端肥大症患者GH和IGF-1与糖代谢指标的相关性分析 受检测量程限制,GH>40 ng/mL均按照GH=40 ng/mL统计。Pearson/Spearman相关性分析结果显示,肢端肥大症患者GH与FBG呈正相关(P<0.05),IGF-1与FBG无关(P>0.05),见表2。

表2 肢端肥大症患者GH和IGF-1与糖代谢指标的相关性分析
2.3肢端肥大症患者GH和IGF-1与脂代谢指标的相关性分析 受检测量程限制,GH>40 ng/mL均按照GH=40 ng/mL统计。Pearson/Spearman相关性分析结果显示,肢端肥大症患者GH与TG呈正相关(P<0.05),与HDL呈负相关(P<0.05),与CHO、LDL、ApoA1、ApoB无关(P>0.05)。IGF-1与TG呈正相关(P<0.05),与HDL呈负相关(P<0.05),与CHO、LDL、ApoA1、ApoB无关(P>0.05),见表3。

表3 肢端肥大症患者GH和IGF-1与脂代谢指标的相关性分析
3 讨 论
肢端肥大症为长期、慢性内分泌性疾病,病理性骨折、糖脂代谢紊乱等肢端肥大症相关并发症严重影响和威胁患者身心健康,降低患者生活质量,因此早期预警和干预至关重要。目前临床上用于诊断肢端肥大症的实验室指标为GH、IGF-1。临床上通过测定GH和IGF-1水平来监测肢端肥大症患者疾病活动状况和术后生化控制程度,且检测GH、IGF-1的方法正在不断地更新中,而是否采用新的分析方法评价治疗情况需要临床进一步评估[6]。
GH具有促进骨的线性生长、骨重建、骨骼肌生长、糖脂代谢及免疫调节作用[7]。IGF-1可促进成骨细胞分化、增殖、募集,促进成骨细胞胶原及骨钙素合成,加快骨矿化[8]。GH和IGF-1是骨稳态的调节因子。GH可促进成骨细胞和软骨形成,抑制脂肪形成。GH还通过IGF-1直接或间接地刺激成熟成骨细胞的功能,通过骨钙素的羧化,从而破坏破骨细胞的产生[9]。由此可见,GH、IGF-1在骨代谢中具有重要作用,而肢端肥大症患者长期处于GH、IGF-1过度分泌状态,其对肢端肥大症患者骨和骨关节系统产生巨大影响。
骨代谢生化指标来源于骨、软骨、软组织、皮肤、肝、肾、小肠、血液及内分泌腺体等,包括由成骨细胞或破骨细胞分泌的酶和激素,以及骨基质的胶原蛋白代谢产物或非胶原蛋白[10]。通过检测血液、尿液中骨代谢生化指标水平,可以了解骨组织新陈代谢情况,用于评价骨代谢状态、骨质疏松诊断分型、预测骨折风险、代谢性骨病的鉴别诊断[7]。本研究所涉及的肢端肥大症患者骨代谢标志物,包括25(OH)D、TP1NP、BGP、β-CTX、Ca2+、磷离子。检测肢端肥大症患者血清中的骨代谢标志物,分析GH、IGF-1与以上骨代谢指标的相关性有重要意义。其中25(OH)D为钙磷代谢调节指标,BGP是骨组织中含量最丰富的非胶原蛋白,TP1NP是Ⅰ型前胶原N-端前肽,这两个标志物是骨形成标志物,其在血清中的水平是反映新骨形成的特异性指标[11]。β-CTX是使用最广泛的胶原降解标志物,β-CTX的水平反映了破骨细胞的骨吸收活性[10]。既往研究表明,控制GH水平可以改善骨转化异常,降低患者骨折发生风险[12],然而由于骨微结构的不可逆性损伤,部分肢端肥大症患者即使病情控制稳定,仍存在较高的椎体骨折风险。本研究结果显示,GH与TP1NP、BGP、β-CTX均呈正相关,与既往研究结果相符。陈焕等[13]发现,肢端肥大症患者骨形成标志物骨钙素及TP1NP与骨吸收标志物β-CTX与IGF-1水平独立相关,肢端肥大症患者随着治疗后生化指标异常的缓解,骨形成及骨吸收标志物水平同时下降,本研究中与上述研究结果部分相符,但未涉及治疗后生化缓解骨代谢标志物的相关研究。另外,研究报道肢端肥大症患者的皮肤面积增加,这可能导致25(OH)D合成增加和骨化三醇产生增加[14]。本研究受样本量较小的限制,尚未发现GH、IGF-1与25(OH)D之间的关系,因此需要更多样本的验证和深入研究。此外,有研究表明血清中IGF-1水平下降与骨折的发生率密切相关,因此IGF-1水平可以作为骨折风险评估的指标[15]。
已知健康人生理情况下,钙磷代谢处于动态平衡状态,血钙和血磷浓度相对稳定。除了熟知的甲状旁腺激素、降钙素、1,25(OH)2D3可调节钙磷代谢外,GH和IGF-1也可调节钙和磷的代谢[16],有学者发现,活跃的肢端肥大症与轻度高磷血症、高钙血症和高钙尿倾向有关[16]。其中部分肢端肥大症患者可出现高钙尿和肾结石。既往研究表明,GH和IGF-1主要通过影响维生素D代谢来影响钙稳态,已知活性维生素D3具有升高血钙、血磷的作用。CONSTANTIN等[16]研究结果提示,肢端肥大症患者钙、磷水平变化与IGF-1水平及骨转化增加有关。本研究结果显示GH、IGF-1与磷离子呈正相关,与既往研究结果部分相符。此结果提示持续性高GH、IGF-1水平可导致高磷血症,长时间的高磷血症可导致钙代谢障碍。
另外,笔者还分析了GH与FBG的相关性,肢端肥大症发生糖尿病的机制与肝脏和外周胰岛素抵抗及肝内葡萄糖生成增加有关[17],GH分泌过多会出现胰岛素抵抗和葡萄糖不耐受表现。既往研究结果表明,肢端肥大症患者容易并发糖耐量减低和糖尿病,其发生率在16%~56%[18]。有回顾性研究发现,有47.1%的肢端肥大症患者在诊断时患有糖尿病,而25.4%的患者存在空腹糖耐量受损或糖耐量减低,只有27.4%的患者糖耐量正常[19],本研究结果与以上结论相符,分析结果显示GH与FBG呈正相关,提示肢端肥大症患者血清高GH水平可能导致患者FBG升高,从而造成患者空腹糖耐量受损,进而导致罹患糖尿病的风险增加。因此监测肢端肥大症患者GH水平,有利于糖尿病的早期干预与诊断,临床上应当予以重视。
既往研究表明,GH能代偿高胰岛素血症的抗脂肪分解作用,可通过抑制胰岛素刺激脂肪分解,在脂蛋白调节中起重要作用[20]。GH是脂肪细胞因子产生的重要调节器,其对脂肪细胞的影响可能是激活脂肪细胞膜上的β肾上腺素能受体,产生降脂效应,或者激活对GH敏感的脂酶,促进脂肪溶解[21]。GH通过增加脂肪分解引起游离脂肪酸水平升高,进而导致高甘油三酯血症,高密度脂蛋白胆固醇降低,13%~51%的肢端肥大症患者出现血脂紊乱[22],本研究结果显示GH与TG呈正相关,GH、IGF-1与HDL呈负相关,与既往研究结果相符。有研究发现,GH可降低TG、LDL的水平[22],探究其机制可能为GH使肝脏LDL受体mRNA表达上调,从而使肝脏摄取LDL的能力提高,加速脂肪分解,使LDL生成率下降、消除增加,从而达到降血脂的作用,进而进一步降低动脉粥样硬化的发生,笔者的研究结果符合以上结论。HDL具有清除外周组织胆固醇的作用,肢端肥大症患者GH、IGF-1的过度分泌,导致HDL降低,患者罹患动脉粥样硬化的风险或将增加。以上研究结论提示临床应重视肢端肥大症患者由于GH、IGF-1水平变化造成血脂代谢紊乱相关并发症的产生。
综上所述,GH和 IGF-1过量分泌可影响骨代谢、钙磷代谢,增加肢端肥大症患者病理性骨折的风险,影响糖代谢、脂代谢,从而导致糖脂代谢紊乱。因此,肢端肥大症患者应严格控制GH、IGF-1水平。同时应长期监测GH、IGF-1水平,从而对骨和骨关节系统并发症、糖尿病、高脂血症做到早发现、早诊断、早治疗。本研究因需要排除应用过降糖药、降脂药的肢端肥大症患者,故而导致样本量偏小,所以具有一定的局限性,在今后的研究中将增大样本量,深入研究肢端肥大症患者骨代谢标志物的变化及其内在机制,降低肢端肥大症患者骨和骨关节系统并发症发病率,降低患者因病致残的风险,提高患者生存质量。

