全身免疫炎症指数和凋亡相关斑点样蛋白对脑卒中诊断的价值研究*
栾 鑫,李国歌,丁耀威,孙嘉潞,李晓彤,姜文灿,史一君,张国军
首都医科大学附属北京天坛医院实验诊断中心/北京市免疫试剂临床工程技术研究中心/国家药品监督管理局体外诊断试剂质量控制重点实验室,北京 100070
脑卒中是中国国民健康面临的一项重大挑战,属于严重的慢性非传染性疾病。它具有高发病率、高致残率、高死亡率、高复发率和高经济负担这五大特点[1-2]。根据2019年全球疾病负担数据显示,我国脑卒中的患病率整体上升,并且患者数量居世界首位[3]。脑卒中可分为脑梗死、脑出血和蛛网膜下腔出血3种类型,其中脑梗死是最常见的类型,约占87%[4]。目前,脑卒中的诊断主要依赖于影像学(CT和MRI)证据,但存在一定局限性。由于缺乏早期特异敏感的诊断方法,依靠临床症状和影像结果来确诊脑卒中,患者的病程可能会错过“黄金救治时期”。因此,寻找既灵敏又特异的血清学标志物,以期对脑卒中进行早预防、早诊断、早治疗十分有必要。
近年来有研究指出,炎症反应在脑卒中发生发展及继发性脑损伤中至关重要[5-6]。全身免疫炎症指数(SII)是一个综合的炎症指标,反映了宿主免疫炎症状态[7]。炎症小体驱动的神经炎症反应在脑卒中发生发展中起着核心作用[8-11],凋亡相关斑点样蛋白(ASC)参与了炎症小体的组装,起到重要的衔接作用,其斑点的形成被称为炎症小体激活的标志[12-13]。本研究旨在探讨入组人群的ASC水平和SII在不同类型及严重程度脑卒中患者中的临床意义。
1 资料与方法
1.1一般资料 选取2022年1—9月在首都医科大学附属北京天坛医院就诊的357例脑卒中患者为病例组,其诊断均符合《中国脑血管病疾病分类2015》[14]相关标准。纳入标准:(1)年龄>18周岁;(2)临床资料完整;(3)均无其他神经系统疾病及颅脑疾病;(4)到院均行头颅 CT 或 MRI 检查确诊为脑卒中。排除标准:(1)因基础疾病或其他因素导致的脑卒中(如脑肿瘤、颅脑外伤、中枢神经系统感染及颅神经炎等);(2)发病超过两周及基线资料不完整;(3)妊娠及哺乳期女性;(4)伴有严重心、肝、肾功能衰竭。357例脑卒中患者中脑梗死患者259例,脑出血患者98例。同时选取同时期健康管理中心表观健康的体检者204例为对照组,纳入标准:(1)年龄18~80岁;(2)无严重感染、恶性疾病或周围血管疾病史;(3)非妊娠及哺乳期女性。本研究已获得首都医科大学附属北京天坛医院伦理委员会批准(伦理审批号:KY-2020-076-02)。
1.2方法
1.2.1观察指标 收集入组人群一般资料,包括年龄、性别、疾病史(高血压、糖尿病、高脂血症)、吸烟史、饮酒史和用药史(降压药、降糖药、降脂药)。血常规(中性粒细胞计数、单核细胞计数、淋巴细胞计数、血小板计数)由医院检验科进行测定,应用迈瑞(BC-6900)全自动血液细胞分析仪及配套试剂进行测定,SII=中性粒细胞计数×血小板计数/淋巴细胞计数;全血经3 000 r/min离心15 min,取上清液,于-80 ℃下保存待测,ASC水平测定使用的试剂盒(磁微粒化学发光免疫分析法)和全自动化学发光测定仪均由北京北方生物技术研究所有限公司提供。研究对象在治疗之前,均按照规定要求进行了血液采集。
1.2.2患者分组 根据临床诊断,将病例组分为脑梗死组(259例)和脑出血组(98例);根据美国国立卫生研究院卒中量表(NIHSS)评分评估脑卒中严重程度(NIHSS评分越高则神经功能缺损越严重),将患者分为轻型脑卒中组(NIHSS评分≤3分,156例)、中重型脑卒中组(NIHSS评分>3分,201例)[15]。
1.3统计学处理 采用SPSS26.0 统计学软件进行数据分析和Graphpad Prism 9.4.0进行图形绘制。不呈正态分布的计量资料以M(P25,P75)表示,组间比较采用Mann-WhitneyU检验;计数资料以例数和百分率表示,组间比较采用χ2检验;采用多因素Logistic回归进行危险因素分析;采用受试者工作特征(ROC)曲线下面积(AUC)评估单项指标和联合检测模型诊断脑梗死的效能。以P<0.05为差异有统计学意义。
2 结 果
2.1两组一般资料比较 与对照组比较,病例组年龄、男性、伴有高血压、糖尿病、高脂血症、吸烟史、饮酒史和用药史占比较高,SII、ASC水平较高(P<0.05)。见表1。

表1 两组一般资料比较[M(P25,P75)或n(%)]
2.2影响因素分析 将本研究中所纳入的传统危险因素进行单因素Logistic回归分析[16],分析结果发现,年龄、性别、高血压、糖尿病、高脂血症、吸烟史、饮酒史、用药史(降压药、降糖药、降脂药)及ASC、SII是脑卒中发生的危险因素。在单因素分析的基础上,进行多因素Logistic回归分析,结果显示,ASC和SII是脑卒中发生的独立危险因素(P<0.05)。见表2、3。

表2 单因素分析
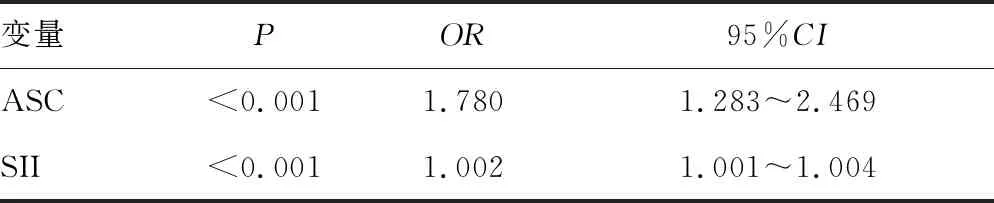
表3 多因素分析
2.3ASC和SII的诊断效能分析 通过ROC曲线分析发现,ASC和SII用于诊断脑卒中的AUC分别为0.786和0.789(P<0.05),ASC和SII联合检测的AUC最大(0.847),这表明联合检测能增加脑卒中诊断的灵敏度和特异度。见表4。

表4 ASC和SII的诊断效能分析
2.4ASC和SII在不同类型、不同严重程度脑卒中患者中的比较 ASC水平、SII在脑出血组中明显高于脑梗死组(P<0.05),中重型脑卒中组高于轻型脑卒中组(P<0.05),见图3。

注:A、B分别为脑梗死组、脑出血组ASC水平、SII比较;C、D分别为轻型脑卒中组、中重型脑卒中组ASC水平、SII比较。
2.5ASC和SII对不同类型、不同严重程度脑卒中患者的诊断效能分析 ASC和SII用于鉴别诊断脑梗死和脑出血的AUC分别为0.606和0.676(P<0.05),鉴别诊断轻型与中重型脑卒中的AUC分别为0.573和0.589(P<0.05)。ASC和SII联合诊断的AUC与单独使用SII、ASC诊断的AUC比较,差异无统计学意义(P>0.05)。见表5。

表5 ASC和SII对不同类型、不同严重程度脑卒中患者分析
3 讨 论
尽管脑梗死与脑出血的原发性损伤过程不同,但神经细胞的损伤均释放损伤相关模式分子(DAMPs),促进炎症反应[6,17]。
ASC是一种相对分子量为22×103的二聚体蛋白,其N端的热蛋白样结构域和C端半胱天冬酶募集结构域均属于死亡结构域家族,可发挥同源蛋白间相互作用[18]。ASC在生理状态为可溶性单体,但在各种病理状态,如脑卒中所导致的神经细胞死亡及DAMPs的释放均会导致ASC聚集成斑点状并激活炎症小体[19]。此外,ASC斑点具有朊病毒蛋白的播种行为及蛋白酶抵抗性,被细胞吞噬会募集细胞质内可溶性ASC,并充当危险信号扩大炎症反应[20]。血清ASC水平对于脑卒中的临床价值研究结果较少,动物实验结果表明,ASC在脑卒中6 h后水平升高;氯尼达明与ASC结合可以减轻脑梗死后的炎症性损伤,并改善患者神经功能结局[21];Raf激酶抑制蛋白与ASC结合,干扰炎症小体的组装,减轻脑出血后神经元焦亡和脑损伤[22]。有临床试验结果显示,血清和血清源性外泌体中的ASC可作为脑梗死的生物标志物[23]。本研究结果表明,病例组血清ASC水平明显高于对照组,且具有良好的诊断效能;脑出血组血清ASC水平高于脑梗死组。从结果分析,血清ASC水平与脑卒中发生和严重程度有着密切关系。
SII作为基于外周淋巴细胞、中性粒细胞和血小板计数的新型综合指标,反映了适应性免疫应答、炎症反应和血栓形成这3个过程[24]。相比其他基于白细胞的炎症指标,如血小板与淋巴细胞比值、淋巴细胞与单核细胞比值,SII更可靠、更具代表性、更全面地反映局部免疫和全身炎症反应的平衡状态,与心血管疾病的发生、发展及预后等密切相关[25]。有研究显示,较高的SII与脑梗死、脑出血的风险增加相关[26]。本研究进一步证实,脑卒中患者的SII明显高于对照组。目前,SII与不同类型及严重程度脑卒中的相关研究较少。本研究结果显示,脑出血组的SII明显高于脑梗死组,中重型脑卒中组SII高于轻型脑卒中组,差异均有统计学意义(P<0.05)。
在本研究中,多因素Logistic回归分析结果表明,ASC、SII是影响脑卒中发生的独立危险因素。此外,脑出血组的ASC水平、SII均高于脑梗死组,其主要原因可能是在脑出血中,血肿扩张期间的剪切力和占位效应会导致脑组织的快速破坏,并导致神经元和神经胶质细胞的即时坏死及血脑屏障的破坏,大量细胞碎片被释放到细胞外空间并侵入体循环。而在脑梗死的最初几个小时通常不存在细胞坏死和崩解,其细胞死亡和血脑屏障的打开是一个渐进的过程[27-28]。ROC曲线分析结果显示,单项指标ASC及SII(AUC均在0.7以上)均对脑卒中的诊断有意义,二者联合检测时,对脑卒中的诊断意义更为明显(P<0.05)。此外,SII、ASC水平在鉴别诊断脑梗死和脑出血、轻型脑卒中与中重型脑卒中均具有良好的诊断效能(P<0.05)。
综上所述,ASC水平、SII的升高与脑卒中的发生密切相关。ASC和SII联合检测可为临床医生诊断脑卒中提供有效的参考。此外,ASC水平、SII在不同类型和严重程度的脑卒中患者中存在明显差异。然而,由于本研究仅为单中心、小样本研究,存在某种程度的偏倚,尚需进一步多中心、大样本验证和评价ASC、SII对于脑卒中患者筛查和诊断的意义。

