犀角地黄汤治疗ITP的疗效及其作用机制
胡哲 胡辉 杨舟 赵早云 王跃
(湖南中医药大学第一附属医院 1血液肿瘤科,湖南 长沙 410007;2消毒供应室)
原发免疫性血小板减少症(ITP)是临床上常见的血液系统免疫性疾病,主要表现为血小板(PLT)计数明显减少,并伴有皮肤黏膜、内脏等出血,严重的损害患者的生命健康〔1〕。目前,临床上ITP治疗多以西药为主,主要包括激素、血小板生成刺激素、单克隆抗体及免疫抑制剂等,但是上述治疗药物存在不良反应多、价格昂贵等缺点〔2,3〕。中医辩证法在治疗ITP患者中具有一定优势,能够明显改善临床症状,且具有不良反应少、疗效显著等优点,已经成为ITP治疗药物选取的新方向〔4〕。犀角地黄汤出自《备急千金要方》,具有增强免疫功能、清心凉血及清热止血等功效,已在临床及实验研究中得到广泛证实〔5〕。研究显示,犀角地黄汤能够通过维持ITP大鼠外周血辅助性T细胞17/调节性T细胞(Th17/Treg)免疫细胞平衡,调节白细胞介素(IL)-17、IL-35细胞因子表达,增加PLT计数,从而达到改善ITP作用〔6〕。但是,有关犀角地黄汤通过何种机制调节Th17/Treg免疫细胞平衡,并最终参与ITP的分子机制尚不完全清楚。Toll样受体(TLR)4/骨髓样分化因子(MyD88)/核因子(NF)-κB信号通路参与调控炎症反应、氧化应激及细胞免疫功能等〔7,8〕。研究发现,抑制TLR4/MyD88/NF-κB信号通路能够明显抑制Th17细胞分化,促进Treg细胞分化,从而改善Th17/Treg细胞失衡,并最终抑制机体炎症反应〔9〕。但是,有关TLR4/MyD88/NF-κB信号通路介导的Th17/Treg细胞失衡在ITP中研究尚无相关报道。本研究探究犀角地黄汤对ITP的疗效及其作用机制。
1 材料与方法
1.1动物 雄性,SPF级,SD大鼠,周龄6~8 w,体质量(200±15)g,购于上海斯莱克实验动物有限责任公司〔生产许可证号:SCXK(沪)2020-0008〕,实验大鼠置于(25±2)℃,相对湿度45%~55%的动物房内适应性喂养1 w,期间正常饮食、饮水,昼/夜12 h交替光照。
1.2药物与主要试剂 犀角地黄汤由水牛角(替代犀牛角)45 g、白芍12 g、丹皮9 g、生地黄30 g组成,药材均购自北京同仁堂药店。犀角地黄汤组方药材均经冷水浸泡30 min,其中水牛角预先煎煮30 min,而后与其余药材共同继续煎煮60 min,制备并浓缩为水剪剂1 g/ml;醋酸泼尼松pain(浙江仙居制药股份有限公司,规格:5 mg/片,国药准字H33021207);完全弗氏佐剂(Sigma公司,批号:Lot#SLBZ9884);IL-6、IL-17、转化生长因子(TGF)-β1、IL-10、IL-35检测试剂盒(上海酶联生物科技有限公司,批号:ml063160、ml063129、ml022522-2、ml037888、ml063154);苏木素-伊红(HE)检测试剂盒、蛋白浓度测定试剂盒、山羊抗兔二抗、山羊抗小鼠二抗、β-actin抗体(碧云天生物技术,批号:C0105S、P0009、A0239、A0258、AF0003);TLR4抗体、MyD88抗体、NF-κB抗体、p-NF-κB抗体(Cell Signaling Technology公司,批号:14358、4283、8242、3033)。
1.3仪器 全自动血细胞分析仪(美国Abbott公司,型号:CELL-DYN1700);酶标仪(山东恒美科技,型号:HM-SY96S);荧光倒置显微镜(日本/奥林巴斯Olympus,型号:CKX53);离心机(湖南湘仪离心机有限公司,型号:HT165R);凝胶成像系统(美国Bio-Rad伯乐公司,型号:Gel Doc XR+)。
1.4兔抗大鼠血小板血清制备 腹腔注射1%戊巴比妥钠40 mg/kg麻醉SD大鼠,腹主动脉取血,放入EDTA抗凝管内,1 000 r/min,离心10 min,收集血小板,使用磷酸盐缓冲液(PBS)洗涤血小板并调整浓度为1×109个/L,之后与完全弗氏佐剂充分混合制备成佐剂抗原。将上述佐剂抗原于新西兰兔后肢足垫、背部多处进行皮下注射。佐剂抗原于首次注射后的7、14、28 d进行重复上述步骤。末次注射后3 d后新西兰兔心脏采血,3 000 r/min,离心10 min,收集上清液,即为兔抗大鼠血小板血清(APS)〔6〕,并将其放置于-80 ℃冰箱内待用。
1.5ITP模型构建、分组及给药干预 将50只SD大鼠随机分为正常对照组、模型组、犀角地黄汤低剂量组、犀角地黄汤高剂量组、泼尼松组,每组10只。除正常对照组外,其余各组均采用腹腔注射APS构建ITP模型(采用生理盐水稀释APS,稀释比例为1∶4,浓度为0.7 ml/200 g,连续注射3 d)。于造模后7 d,正常对照组和模型组生理盐水灌胃;依据文献〔6〕及大鼠与人体表面积等效剂量换算,犀角地黄汤低、高剂量组分别给予0.012 5 g/kg、0.050 0 g/kg犀角地黄汤灌胃;泼尼松组给予9.1 mg/kg泼尼松灌胃,1次/d,连续灌胃14 d,各组灌胃体积均为10 ml/kg。
1.6外周血象检测 各组于造模前、给药前(腹腔注射APS造模后7 d)及给药后(各组大鼠连续药物干预14 d),大鼠尾静脉取血,全自动血细胞计数仪检测各组PLT计数。于连续给药14 d时进行血红蛋白(Hb)含量检测。
1.7脾脏及胸腺指数检测 各组连续给药14 d后称量体质量,腹腔注射1%戊巴比妥钠40 mg/kg麻醉大鼠并颈椎脱臼处死,解剖分离脾脏及胸腺,取出血液及筋膜组织,称量脾脏及胸腺质量,计算脾脏和胸腺指数。脾脏指数=脾脏重量(mg)/大鼠体质量(g);胸腺指数=胸腺质量(mg)/大鼠体质量(g)。
1.8血清IL-6、IL-17、TGF-β1、IL-10、IL-35含量检测 各组大鼠连续灌胃给药干预14 d后,腹腔注射1%戊巴比妥钠40 mg/kg麻醉大鼠后,腹主动脉取血,放置于抗凝离心管内,4 ℃,3 000 r/min,离心10 min,收集上层血清。参照ELISA检测试剂盒说明书进行血清IL-6、IL-17、TGF-β1、IL-10、IL-35含量检测。
1.9Th17和Treg细胞占比测定 各组大鼠末次给药结束后24 h,腹腔注射1%戊巴比妥钠40 mg/kg麻醉大鼠,腹主动脉取血,分离外周血中单核细胞,向重悬细胞中加入适量异硫氰酸荧光素(FITC)标记的CD4抗体,30 min后加入FITC标记的IL-17A抗体及PE标记的Foxp3抗体,4 ℃条件下,避光孵育30 min,流式细胞仪对上述细胞信号进行采集,并通过软件分析Th17/Treg细胞比例。
1.10脾脏和胸腺组织病理学检测 各组大鼠连续给药14 d后,腹腔注射1%戊巴比妥钠40 mg/kg麻醉大鼠并颈椎脱臼处死,解剖分离脾脏及胸腺,剪去部分组织放置于10 %多聚甲醛固定液中进行组织固定24 h,切片后行HE染色观察各组脾脏和胸腺组织病理学变化。
1.11脾脏组织TLR4/MyD88/NF-κB通路蛋白表达检测 各组干预14 d后,立即将大鼠处死,剪取大鼠脾脏组织并提取总蛋白;二喹啉甲酸(BCA)法测定各组脾脏组织蛋白质浓度;蛋白上样;凝胶电泳;湿转法转膜;5%BSA室温封闭2 h;分别赋予TLR4抗体(1∶1 000)、MyD88抗体(1∶500)、p-NF-κB抗体(1∶1 000)、NF-κB抗体(1∶1 000)及β-actin抗体(1∶2 000),4 ℃ 条件下孵育16 h;37 ℃条件下二抗孵育60 min;去除二抗后TBST洗膜15 min;滴加显影液于Gel Doc XR+成像系统中显影拍照,并通过ImageJ软件分析蛋白相对表达量。
1.12统计学分析 采用SPSS20.0软件进行多因素方差分析,组间两两比较采用LSD-t检验。
2 结 果
2.1犀角地黄汤对ITP大鼠一般情况的影响 正常对照组反应灵敏、精神状态良好,饮食、饮水均正常;其余各组造模7 d后出现活动能力明显减弱,饮食、饮水下降,皮肤出血,精神状态较差等现象。与模型组相比,各药物干预组活动能力明显增强,皮肤出血点减少,精神状态得到明显改善。
2.2犀角地黄汤对ITP大鼠外周血PLT数目的影响 造模前,各组外周血PLT计数无显著差异(P>0.05)。给药前,与正常对照组相比,各造模组外周血PLT计数均显著降低(P<0.05)。连续给药14 d后,与正常对照组相比,模型组外周血PLT计数显著降低(P<0.05)。与模型组相比,犀角地黄汤低、高剂量组及泼尼松组外周血PLT计数显著升高(P<0.05)。见表1。
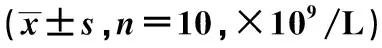
表1 各组外周血PLT数目比较
2.3犀角地黄汤对ITP大鼠Hb浓度、脾脏及胸腺指数的影响 连续给药14 d后,与正常对照组相比,模型组外周血Hb浓度显著降低,脾脏和胸腺指数均显著升高(P<0.05)。与模型组相比,犀角地黄汤低剂量组、高剂量组及泼尼松组外周血Hb浓度显著升高,脾脏和胸腺指数均显著降低(P<0.05)。见表2。
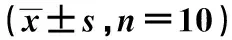
表2 各组Hb浓度、脾脏、胸腺指数、血清IL-6、IL-17、TGF-β1、IL-10、IL-35水平比较
2.4犀角地黄汤对ITP大鼠血清炎性因子及外周血Th17/Treg细胞比例的影响 与正常对照组相比,模型组血清IL-6、IL-17水平显著升高,TGF-β1、IL-10、IL-35水平均显著降低(P<0.05)。与模型组相比,犀角地黄汤低剂量组、高剂量组及泼尼松组血清IL-6、IL-17水平显著降低,TGF-β1、IL-10、IL-35水平均显著升高(P<0.05)。见表2。流式细胞术检测显示,与正常对照组相比,模型组外周血中Th17细胞百分含量明显增加,Treg细胞百分含量明显降低(P<0.05)。与模型组相比,犀角地黄汤低剂量组、高剂量组及泼尼松组外周血中Th17细胞百分含量明显降低,Treg细胞百分含量明显增加(P<0.05)。见表3。
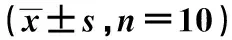
表3 各组外周血中Th17、Treg细胞比例比较
2.5犀角地黄汤对ITP大鼠脏器病理形态学的影响 脾脏组病例染色显示,正常对照组脾脏结构清晰、红髓、白髓相见分布,可见红髓充血,可见髓样生化;模型组脾脏组织结构模糊,脾脏小体部分萎缩,可见红髓明显充血,巨噬细胞明显增多。与模型组相比,犀角地黄汤低剂量组、高剂量组及泼尼松组骨髓外造血减轻,脾脏结构得到改善,巨噬细胞浸润程度减轻。胸腺病理性染色显示,正常对照组胸腺组织结构清晰,皮质及髓质分解清晰,且皮质区域淋巴细胞排列规整,髓质区域可见胸小小体,淋巴细胞减少;模型组大鼠胸腺组织结构疏松,淋巴细胞明显减少,皮质髓质分界模糊。与模型组相比,犀角地黄汤低剂量组、高剂量组及泼尼松组胸腺组织病理形态学得到不同程度改善。见图1。

图1 各组脾脏及胸腺组织病理学(HE染色,×400)
2.6犀角地黄汤对ITP大鼠脾脏TLR4/MyD88/NF-κB信号通路蛋白表达的影响 与正常对照组相比,模型组脾脏组织TLR4、MyD88、p-NF-κB/NF-κB蛋白表达均显著升高(P<0.05)。与模型组相比,犀角地黄汤低、高剂量组及泼尼松组脾脏组织TLR4、MyD88、p-NF-κB/NF-κB蛋白表达均显著降低(P<0.05)。见图2、表4。
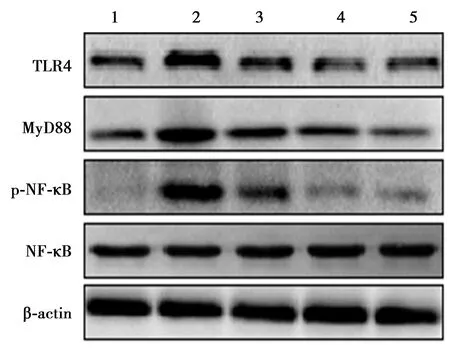
1~5:正常对照组、模型组、犀角地黄汤低剂量组、犀角地黄汤高剂量组、泼尼松组图2 Western印迹检测脾脏组织TLR4/MyD88/NF-κB信号通路蛋白
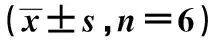
表4 各组脾脏组织TLR4、MyD88、p-NF-κB蛋白相对表达水平
3 讨 论
ITP约占出血性疾病的1/3〔10〕。ITP发病机制较为复杂,至今尚未完全阐明。研究表明,以T淋巴细胞免疫失衡及相关细胞因子分泌异常在ITP疾病进展中发挥关键作用〔11〕,但其具体致病机制尚未完全阐明。Th细胞在机体免疫系统中发挥重要作用,其可以分化成为Th1、Th2、Th17及Treg细胞等,而以Th17/Treg细胞平衡是维持机体免疫稳态的关键〔12〕。Th17是介导炎症和自身免疫性疾病的重要调节因子,主要通过产生特异性炎症细胞因子IL-6、IL-17、IL-21及IL-22等介导机体炎症反应及免疫功能异常激活。而Treg是介导免疫稳态及免疫耐受的关键,主要通过分泌IL-10、IL-35及TGF-β1等抑制性细胞因子,从而抑制T细胞介导的免疫耐受,维持免疫功能平衡及抑制炎症反应的发生,两者功能相反且处于动态平衡〔13〕。既往研究显示,当机体存在炎症、感染及自身免疫性疾病时,会导致机体免疫系统异常激活,从而导致Th17/Treg细胞平衡被打破〔14〕。研究证实,Th17/Treg失衡参与了ITP的发生发展〔15〕。因此,以Th17/Treg细胞失衡及相关细胞因子分泌异常为靶标可能是治疗ITP的关键。
祖国医学认为,ITP属“血证”“紫斑”等范畴,病机为气不摄血、阴虚火旺及血热妄行等〔16〕,其中以血热妄行为ITP主要病机,治疗多宜凉血止血、清热解毒。犀角地黄汤以犀牛角、丹皮、生地黄、白芍四味中药组成,组方中犀角具有清心解毒止血;芍药,丹皮具有清热凉血、活血化瘀之效;生地黄具有滋阴生津,辅助犀牛角凉血止血。既往研究显示,犀角地黄汤能够用于治疗系统性红斑〔17〕、ITP〔6〕及小儿过敏性紫癜〔18〕等中医辨证为血热患者。以上研究表明犀角地黄汤具有治疗ITP作用。王跃等〔6〕研究显示,犀角地黄汤能够通过维持Th17/Treg细胞平衡,从而改善ITP大鼠PLT计数。本研究结果进一步证实,犀角地黄汤具有治疗ITP作用,与维持Th17/Treg细胞平衡,抑制炎症细胞因子释放相关。但是,有关Th17/Treg细胞平衡的调节机制尚不清楚。
TLR4/MyD88/NF-κB信号通路参与介导炎症反应及免疫功能的重要调节机制。研究显示,下调TLR4表达能够抑制NF-κB向核内转移,从而参与调控Th17/Treg免疫平衡,抑制结直肠炎小鼠炎症因子表达,从而缓解结肠炎小鼠临床症状〔19〕。徐化雪等〔20〕研究显示,右美托咪定能够通过抑制TLR4/MyD88/NF-κB信号通路介导的免疫功能紊乱,从而改善原位肝癌切除术大鼠术后免疫功能抑制。以上研究提示,TLR4/MyD88/NF-κB信号通路可能通过调节Th17/Treg免疫平衡,参与ITP发生发展。本研究结果表明,TLR4/MyD88/NF-κB信号通路激活可能与ITP时Th17/Treg免疫细胞失衡相关;犀角地黄汤能够通过抑制TLR4/MyD88/NF-κB信号通路活化,改善Th17/Treg免疫细胞失衡。

