水稻小孢子培养研究进展
查中萍,郭 英,殷得所,王红波,胡建林,郑兴飞,董华林,薛 莲,胡 鹏,罗肖陨,徐得泽
(湖北省农业科学院粮食作物研究所/农业农村部作物分子育种重点实验室/粮食作物种质创新与遗传改良湖北省重点实验室,武汉 430064)
水稻(Oryza sativaL.)是中国重要的粮食作物[1,2]。常规的杂交水稻育种法需要亲本杂交之后再通过6~8 代的回交和定向筛选才能实现优良性状的遗传改良。利用单倍体育种技术则可以直接获得优良纯合个体,缩短育种进程[2,3]。水稻小孢子培养和花药培养都是常用的单倍体育种方法。Guha等[4]发现花粉粒可以脱离正常配子体发育途径转向孢子体发育并在体外诱导胚状体产生单倍体植株,单倍体培养技术逐渐发展起来。水稻花药培养技术发展迅速,该技术具有加速性状稳定、缩短育种年限、提高选择效率等优点,在种质资源创新、杂种优势利用以及水稻分子育种上被广泛应用[5-13]。小孢子培养是直接从花蕾或者花药中分离新鲜的小孢子,通过组织培养技术,采用适宜的培养基和培养条件进行培养,诱导产生胚状体从而获得单倍体植株,再通过技术手段使染色体加倍,获得纯合可育的双单倍体(DH)。与花药培养相比,小孢子培养可以排除花药壁和绒毡层细胞的干扰,研究者可以在单倍体、单细胞水平上进行遗传操作[14,15]。本研究根据水稻小孢子培养的研究情况,综述了影响小孢子培养的主要影响因素以及小孢子培养技术面临的问题,并对小孢子培养技术发展前景进行了展望。
1 小孢子分离纯化方法
水稻小孢子位于花药内,每个花药有2 000~4 000 个小孢子。小孢子分离,即将经过预处理的幼穗经常规消毒(同一般组织培养消毒流程),然后在无菌条件下从花药中分离小孢子。分离小孢子的方法可归纳为挤压法、器械法和散落法3 种。
1.1 挤压法
陈英等[16]分别用注射器内管挤压或磁力搅拌法从花药中分离出花粉,经过筛及500 r/min 离心2~3 次(每次2 min 左右),使小孢子从花药中游离到抽提液中取得纯净花粉粒,王玲仙等[17]利用玻棒挤压获得分离的小孢子。通过无菌不锈钢网或尼龙网筛去除比小孢子大的组织碎片,收集小孢子悬浮液。由于水稻花粉粒直径一般在40~65 μm,故滤网一般选择150~300 目。收集好的小孢子悬浮物从500~800 r/min 转速低速离心使小孢子纯化。前期研究发现,由于转速较低,为便于收集小孢子最好用13~15 mL 尖底玻璃离心管离心,弃上清液后加抽提液反复清洗2~3 次,以彻底洗脱悬浮液中的植物组织残液,最后用培养液(诱导培养基)清洗1 次,即可制备成小孢子悬浮液并转入培养器进行培养。
1.2 器械法
为了提高分离效果,一些研究者探索用机器分离小孢子。常用的方法是利用超速旋切机或匀浆机将水稻花药切碎,从而释放出游离小孢子。陆瑞菊等[14]、郭桂梅等[15]使用匀浆机高速旋切幼穗,悬浮液用150 目筛网过滤,滤液以700 r/min 转速离心5 min,重复3 次,收集小孢子。前期研究发现,由于水稻幼穗枝梗的木质化程度较高,放入容器直接利用旋切机或匀浆机处理后残渣较多容易堵塞滤网而影响小孢子分离效率。因此,最好去除较老的枝梗,或者剪下每朵颖花进行旋切。
1.3 散落法
选用合适渗透压的培养基对花药进行液体漂浮培养时花药会自行开裂,小孢子从花药裂口处散落到培养基中,利用这种方法收集小孢子的方法叫散落法。陈英等[16]将花药接种在液体培养基上,花药漂浮于液面,先后自然裂开,不断释放出花粉。定期将花药从培养瓶中取出,转入另外培养瓶中继续培养,再释放花粉。过一定时期再将这些花药转出,这样花药被先后转出,各培养瓶中留下不同时期由花药释放出的花粉,供继续培养。王玲仙等[17]采用碳饥饿散落法处理花药,即培养时不添加蔗糖而是用甘露醇代替来调节渗透压,研究发现采用碳饥饿散落法能加速小孢子的散落速度而且收集量大。刘成洪等[18]以21%蔗糖溶液纯化小孢子悬浮液,加无糖溶液调节渗透压以600 r/min 转速离心5 min,去除上清液后加1.5 mL 诱导培养基接种于培养皿中。
2 影响小孢子培养的主要因素
2.1 基因型
小孢子培养由花药培养发展而来,因此小孢子培养与花药培养方式相同,供体品种的基因型是影响单倍体培养的关键因素,基因型对愈伤组织或胚状体的诱导率影响较大,沈锦骅等[19]对比分析了各种类型的水稻材料后,得出各类型水稻的花药培养力由强到弱依次为糯稻、粳稻、籼粳型杂交稻、籼稻,但不同材料之间差异较大。粳稻类型相对于籼稻来说更易被诱导[12],其愈伤组织诱导率最高可达40%以上,一般也都会在10%以上[20],而籼稻类型的花药培养效率普遍偏低,其花粉培养的株产率平均只有1%~3%[16]。江树业等[21]研究表明,籼稻杂交组合中若有培养效率较高的粳稻的血缘,其杂交F1的培养效率也会较好。陈兆贵等[22]研究表明,花药培养力是受亲本控制的遗传性状,如果父本和母本的培养力均较强,F1代的培养力也会较强。何涛[23]在研究影响籼稻花药培养的因素及高培养力材料的筛选时发现,愈伤组织的诱导和绿苗的分化之间相关性显著,且均是由多基因控制的数量性状。对水稻花药培养效率的遗传解析表明,愈伤组织诱导率和绿苗分化率是由核基因控制的数量遗传性状,且这2 个性状之间没有关联,可独立遗传[24]。其中,影响花药培养力的基因被认为在1 号染色体上,而控制绿苗与白苗分化比例的基因位于10 号染色体上[25]。何平等[24]对110 个DH 系进行花药培养力的数量性状位点(QTLs)分析,得到了与愈伤组织诱导有关的5 个QTLs,分别分布在第6、7、8、10 和12 号染色体上,与绿苗分化率有关的2 个QTLs 分布在第1 号和第9 号染色体上。研究认为,如果将能提高愈伤诱导率和绿苗分化率的QTLs 聚合在一起,筛选出愈伤诱导率和绿苗分化率均较高的材料,将大幅度提升花药的培养力[13]。由此可见,小孢子培养能力与其他遗传性状相同,是一种受基因调控的遗传特性。
2.2 亲本生理状态及小孢子发育时期
亲本植株的生理状态对愈伤组织或胚状体诱导频率有直接影响。一般从发育健壮的植株上取花粉进行培养效果较好。另外,游离小孢子培养还受供体植株生长条件的影响,如温度、光照、光周期等。在气温不稳定的季节,有时同一材料、生长在同一田地中只是取穗日期前后不同,小孢子胚状体诱导率都有明显差异。据胡忠等[26]报道,在昆明粳稻孕穗期间的温度为18.5~20.0 ℃时,愈伤组织的诱导率要比气温为16~18 ℃时的诱导率高3~4 倍。
选择合适发育时期的花粉是提高小孢子培养诱导率的重要因素。花粉发育在单核靠边期是水稻花药培养的最佳时期。田间取样的适宜时间一般为晴天的8:00—10:00 或16:00—18:00,此时细胞处于旺盛的分裂期。处于单核中晚期的花粉细胞诱导愈伤组织的能力较强[27,28]。这个时期小孢子发育尚未进入配子体发育阶段,因此可以被迫增殖,表现出较高的被诱导率[29]。Chen[30]报道了花粉母细胞与四分体时期花粉在培养中停止在单核早期不产生愈伤组织,其他发育时期的花粉的愈伤组织诱导率分别为单核早期5.6%、单核中晚期35.7%、第一次分裂期6.7%、双核期0。在试验过程中,为了准确找到单核中晚期花粉细胞,人们经常用剑叶与其下一叶的叶枕间距离、颖壳的颜色及花药长度作为外部形态指标来进行幼穗的选择。通常花药的单核靠边期,穗苞饱满而不破,颖壳浅绿色,花药淡黄色,花药长度伸长至颖壳2/5~1/2 处,剑叶与下一叶的叶枕距为8~12 cm,但这种形态判断指标比较粗放,不同的材料间存在较大差异,故不同的材料取材时要综合衡量。
2.3 预处理
预处理是诱导小孢子由配子体发育转向孢子体发育的重要因素。常用的方法包括热激处理、低温处理、盐处理、辐射、渗透、化学处理等。预处理的目的在于人为地改变小孢子的内在状态,从而诱导小孢子转入孢子体发育[5]。小孢子培养由花药培养发展而来,因此,花药培养的预处理也适应小孢子培养。高温热激处理能加快小孢子分裂,从而提高花药培养的愈伤组织诱导率。热激温度和热激时间都对热激效果有影响。李大林[31]于接种前将幼穗分别于40、45、50、55 ℃和60 ℃温水中处理,发现40~45 ℃处理1~5 min 和60 ℃处理10 s 均取得诱导率高于对照的效果。郭桂梅等[15]研究证明,游离小孢子于32 ℃热激预处理2 d 能提高小孢子的愈伤组织产量和绿苗产量。低温预处理是简单易行的预处理方法,具体步骤为将幼穗保留两叶一节,用75%的乙醇棉球擦拭表面进行消毒,然后用干净的湿纱布包裹放入保鲜袋中,置于生化培养箱或冰箱中冷藏。低温处理的作用机制是延缓花粉的退化、维持花粉发育的生理环境、提高源性生长素水平并降低乙烯水平、启动雄核发育等[32]。对离体幼穗进行适当天数的低温处理可以提高花药培养效率已被多数研究证实[33,34]。陆瑞菊等[14]研究比较了5 ℃4 d 和5 ℃8 d 低温预处理对水稻花药培养的影响,发现5 ℃8 d 低温预处理的效果明显好于5 ℃4 d 的,平均愈伤组织产量提高了3.68 倍,平均绿苗产量提高了1.97倍。肖国樱[32]的研究表明,低温预处理20 d 内时间越长,水稻花药培养效果越好。张连平等[35]的研究表明,水稻花药培养10 ℃下低温预处理8 d 效果好于4 d,超过10 d 效果下降。周雄韬等[36]对4 个籼稻杂交组合的花粉在9~11 ℃下处理14 d,胚胎诱导率平均达到24.1%,绿苗率为7.93%。刘成洪等[18]对粳稻F1小孢子培养条件的优化研究表明,低温(4 ℃)处理水稻幼穗12 d 在诱导愈伤组织产量和分化绿苗产量上都要优于16 d 处理。李三和等[37]报道最适温度是10 ℃,取材后的低温预处理可以明显提高水稻花药培养的愈伤诱导率。吴永忠等[38]将花药接种于液体培养基上,预培养0、3、5、7、10 d,再将花药取出分离小孢子进行小孢子培养,表明花药预培养7 d 后的小孢子能启动分裂。郭桂梅等[15]对甘露醇渗透和化学因素进行小孢子培养预处理研究发现,花药分别于60 g/L 甘露醇和10 mg/L 秋水仙碱中预处理3 d 均能明显提高小孢子愈伤组织产量及绿苗产量。王玲仙等[17]于添加了Ficoll 和活性炭的预培养基中继续培养16 d 的花粉中成功培养出高活性的小孢子,并诱导出了愈伤组织。
2.4 基本培养基类型及生长调节剂配比
培养基中含大量元素、微量元素、附加物、生长调节剂和碳源等成分,这些成分的含量和比例对小孢子培养效率都有直接影响。培养基可分为诱导培养基、分化培养基、生根培养基。用于胚状体或愈伤组织诱导的诱导培养基是关键,已经研究出适合各种不同水稻小孢子培养的诱导培养基,如N6、合5、M8、SK3 等[3,39-41];査中萍等[3]的研究表明,改良的M8(GM8)培养基是水稻花药培养最佳诱导培养基,常见基本培养基见表1。
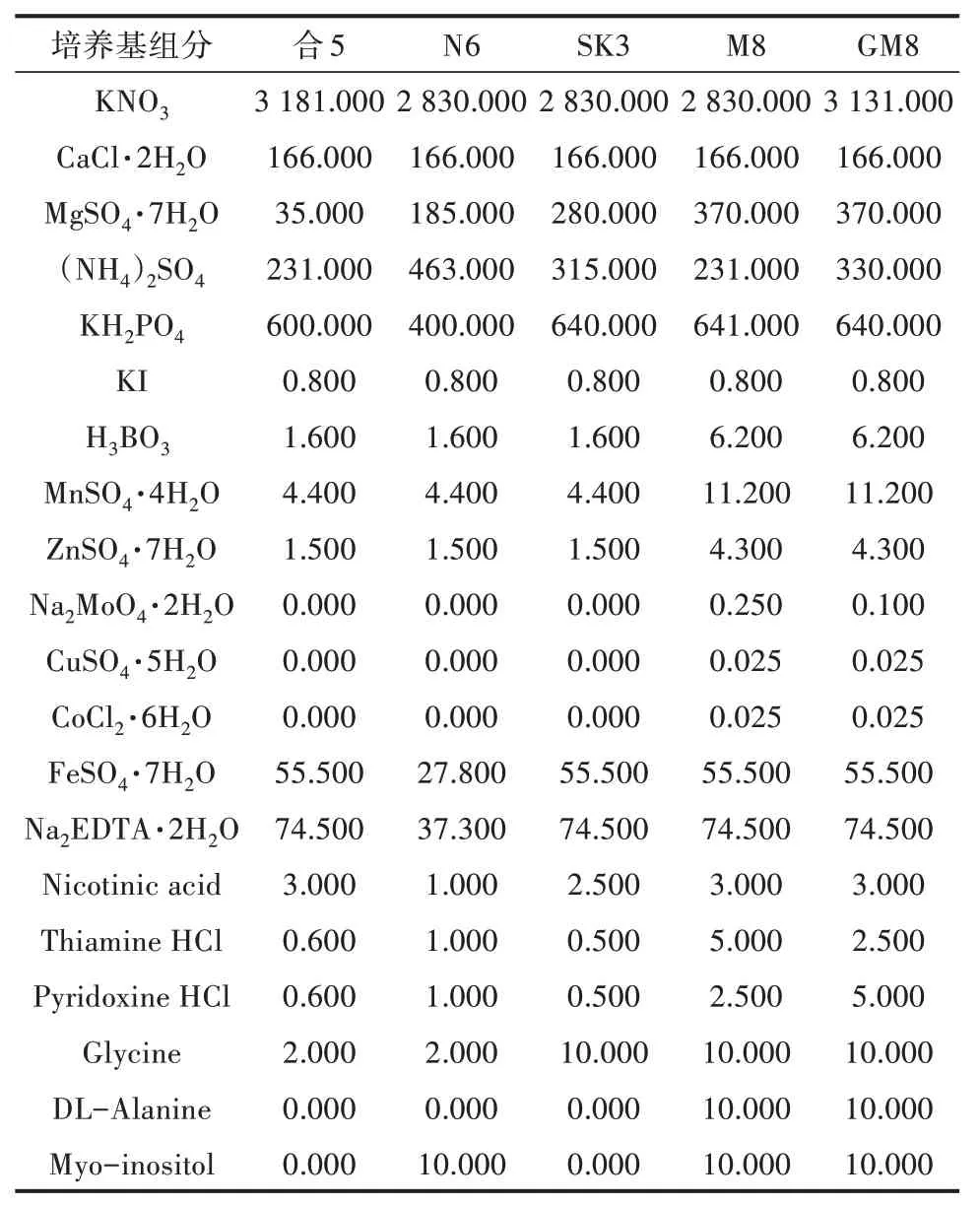
表1 小孢子培养常用基本培养基(单位:mg/L)
除基本培养基外,诱导培养基中的碳源和生长调节剂也是小孢子培养的重要影响因素。王光远等[42]认为KM8p 培养基含有多种糖、有机酸和维生素等能为水稻小孢子的分裂提供良好的营养环境,能显著提高小孢子的分裂频率,同时蔗糖浓度为6%时最有利于胚状体的发生。朱永生等[43]的研究证明,使用3%蔗糖+3%麦芽糖对胚状体的发生及培养力的改善效果更佳。适当的生长调节剂浓度和配比不仅影响小孢子的发育方向及诱导率,并对其形态发生起重要作用。用于水稻小孢子培养的外源生长调节剂有2,4-D、NAA,细胞分裂素类有KT、6-BA等。陈英等[16]报道粳稻花药培养一般只需2.0 mg/L 2,4-D 即可获得较好的诱导率,当2,4-D 浓度高于10.0 mg/L 时,虽然能提高愈伤组织诱导率,但绿苗分化率却降低。该研究表明,在水稻小孢子培养过程中,需要兼顾愈伤诱导与绿苗分化2 个阶段,合理调节2,4-D 的用量。研究报道多种生长调节剂配比更有利于水稻小孢子诱导培养,査中萍等[3]的研究证明,培养基NAA 3.0 mg/L+2,4-D 2.0 mg/L+KT 1.0 mg/L 最有利于水稻花药小孢子诱导培养。
2.5 培养方式
小孢子的培养方法有固体培养、液体培养和固液双层振荡培养。吴晖霞等[44]对液体浅层培养和Transwell-CoL 培养盘2 种培养方式进行了比较,认为液体培养中出现的通气不良问题,游离小孢子比花药培养显得更突出,沉在皿底的多细胞团或早期胚状体往往分裂迟缓、生长慢,有的停止分裂,甚至褐化。当转移这些褐化结构到固体分化培养基后,大部分不能恢复生长。采用Tarsnwell-CoL 培养盘培养游离小孢子时,由于它的构造优于35 mm 的培育皿,小孢子可以通过膜接触到液体培养基,能及时充分获得养分,而不会沉到皿底,始终处于良好的通气状态中。申娟等[45]在蔬菜类作物小孢子培养研究中发现,固液双层振荡培养的诱导频率高于固体培养和液体培养,不仅可以增加胚的数量,同时胚状体的发育也较好。分析其原因可能是固液双层振荡培养可以改善液体培养基的通气性使小孢子从活性高的液体培养基中汲取营养且胚状体长大后又不会沉没,使子叶胚产生率大大提高,胚也生长更健壮,提高了胚发育的同步性和胚的质量,促进了胚在成苗培养基上的直接成苗。王玲仙等[17]在液体培养基中加入Ficoll 和活性炭,提高了愈伤组织的诱导率。培养基的通气条件影响花粉的体胚发生,还会导致愈伤组织中的乳酸积累,引起白苗。花粉液体培养阶段时在培养基中加入Ficoll,不仅可悬浮花粉,而且可悬浮花粉发育的体胚,从而提高花粉分裂频率和得苗率,Ficoll 还能使花粉释放变慢,提高小孢子的活力,同时加入Ficoll后能提高培养基的渗透压,以提高愈伤组织再生植株的频率。
2.6 胚状体的发生及植株再生的影响
胚状体分化成植株是小孢子培养中的重要环节,该阶段主要的影响因素是培养基组分。一般的做法是参考适宜于供试材料的分化培养基组分,通过对植物生长调节剂浓度、碳源成分、pH 等条件调节进行改良。査中萍等[3]的研究发现,能同时适用籼稻、粳稻的通用分化培养基为MS+KT 2.0 mg/L+6-BA 0.5 mg/L+NAA 0.5 mg/L+蔗糖30.0 g/L,pH 为5.8。
在对游离小孢子培养形成的早期胚状体进行再分化的工作中,发现将诱导培养14、21 d 时形成的早期胚状体转移到分化培养基上,比28、35 d 时转移的效果好。选择诱导培养14~21 d,直径已达0.5 mm以上的早期胚状体转入分化培养基能获得较高的绿苗再生频率。过早将未达到直径0.5 mm 的早期胚状体转移到分化培养基上,胚状体很难继续生长;没有及时将再生的早期胚状体转移到分化培养基上时,褐化的早期胚状体会不断增加,容易丧失分化能力,或导致再生白化苗的频率增加[45]。
小孢子培养所产生的单倍体植株常表现高度不育,需诱导染色体加倍。陆瑞菊等[14]研究报道预处理液中添加适量的秋水仙碱可以提高粳稻再生植株中双单倍体植株的产量。
李朝灿[46]采用单倍体再生苗秋水仙碱浸根处理,平均加倍率达25.8%。对于水稻单倍体再生苗的浸根处理,秋水仙碱浓度以1 000 mg/L 为宜,处理时间以24 h 为宜,间歇处理加倍效果更好。用加有二甲基亚砜的秋水仙碱水溶液浸泡幼苗根和分蘖节诱发染色体加倍有很好效果[47]。杨汉民等[48]在小麦单倍体植株的加倍中也获得类似的研究结果。
3 水稻小孢子培养存在的问题
尽管小孢子培养技术有许多优势,而且水稻小孢子培养研究取得了一定进展,但仍不能广泛应用于育种,致使已育成的花培品种在生产中大面积推广的数量还不多,效益不高。表明利用小孢子培养技术育种在理论和实践上还存在不少问题。主要表现在以下几点:一是诱导频率和分化成苗率低,可重复性差,很难利用;二是水稻分化培养中均有白化苗现象发生,小孢子培养白化苗现象也很突出,虽然有一些研究从胚胎发生的细胞形态学、代谢水平、分子水平等方面探究了小孢子胚胎发生机制,但是孢子体发育的诱导机制、启动机制尚不明确。
4 水稻小孢子培养的前景展望
小孢子培养技术在十字花科、禾本科植物中应用比较成熟,在大白菜、甘蓝、菜心、小麦等植物中都建立了完整的培养体系[49]。随着对小孢子培养的深入研究和小孢子发生机理的进一步探索,依据水稻已有的花药培养体系建立更有效、更完善的水稻小孢子培养技术体系将成为可能。随着水稻小孢子培养技术体系的日益完善和成熟,游离小孢子培养技术将会更多地应用于种质创新、转基因研究和分子标记等领域。游离小孢子培养技术不仅会成为常规育种的重要组成部分,而且必将在基础研究领域发挥更大的作用。同时,利用单倍体小孢子进行诱变及突变体筛选,可以避免变异体为嵌合体,当代就能选择出隐性突变性状,在游离小孢子培养的多细胞团形成期、胚状体形成期和胚状体萌发成苗阶段分别给予选择压,最终创造出抗病、耐逆新种质。

