胃癌组织中ARHGAP4、FBLN5的表达及与病人预后的关系
周谦 孟宁 刘晟楠 郝向东
胃癌(gastric cancer,GC)是消化道常见恶性肿瘤[1]。早期治疗方法以手术为主,但大多数病人被发现时为晚期,术后容易出现复发、转移,预后较差[2]。寻找可准确进行病情及预后评估的标志物具有重要价值。扣针蛋白5(fibulin 5,FBLN5)是一种胞外基质糖蛋白,与多种恶性肿瘤细胞增殖、黏附、血管修复等密切相关[3]。Rho GTPase激活蛋白4(Rho GTPase activating protein 4,ARHGAP4)是Rho GAP家族成员,其作为肿瘤抑制因子在多种恶性肿瘤中异常表达[4-5]。研究检测并比较胃癌病人中ARHGAP4、FBLN5的表达,探讨二者对预后的影响。
对象与方法
一、对象
2013年12月~2018年12月我院收治的胃癌病人100例。纳入标准:(1)诊断符合《CSCO原发胃癌诊疗指南(2017 版)》中胃癌的诊断标准[6];(2)均在我院进行手术治疗;(3)手术后均经过临床病理证实;(4)未进行放化疗治疗。排除标准:合并有其他恶性肿瘤;预计生存期<6个月;临床资料不完整。
二、方法
1.标本采集和处理:收集病人胃癌组织及>5 cm癌旁组织于液氮中保存,迅速转移至-80 ℃冰箱保存,待测。
2.临床资料收集:包括病人年龄、性别、临床病理特征;血清肿瘤标志物癌胚抗原(carcinoembryonic antigen,CEA)、糖类抗原(carbohydrate antigen,CA)19-9、糖类抗原125(carbohydrate antigen 125,CA125)水平。CEA、CA19-9和CA125的临界值分别为5 ng/ml、39 U/ml、35 U/ml。
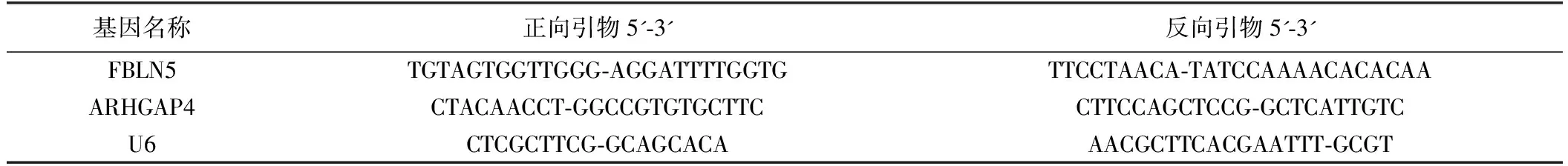
表1 实时荧光定量PCR引物序列
3.免疫组织化学法:免疫组化分析采用EnVision两步法进行。染色结果进行病理图像分析。采用半定量方法,≤3分为阴性,>3分为阳性。CD3+T、CD8+T阳性结果判读采用细胞计数法,先在低倍镜下观察整张切片,分别寻找具有代表性的肿瘤中心及侵袭性边缘阳性淋巴细胞浸润密度较高处进行观察,高倍视野内分别计数CD3+T、CD8+T淋巴细胞数目,并计算该切片内不同区域内的平均着色细胞数目作为该例CD3+T、CD8+T均值,以所有切片CD3+T、CD8+T阳性细胞数目的均数为基准,大于该计数值即为阳性表达记1分,低于该计数值即为阴性表达记0分,将2个区域内的免疫浸润细胞分别评分并计入总分,可以得到I0、I1、I2、I3、I4五个不同免疫评分值,I0~I2定义为低免疫评分,I3~I4定义为高免疫评分。
4.胃癌组织及癌旁正常组织中FBLN5、ARHGAP4 mRNA表达检测:TRIzol法提取组织总RNA,分光光度仪检测RNA浓度后反转录得到cDNA。采用ABI 7500型PCR仪实时荧光定量检测组织中FBLN5、ARHGAP4 mRNA相对表达水平,采用2-ΔΔCt法计算相对表达量。FBLN5、ARHGAP4及内参引物序列见表1。
5.随访:所有病人自术后开始定期随访(门诊或电话),观察病人的生存时间和生存率。病人均随访3年,随访终点为病人死亡或至随访截止时间。
三、统计学分析
结果
1.胃癌组织中ARHGAP4、FBLN5的表达比较:ARHGAP4的阳性表达率为18.00%,低于癌旁组织的83.00%;FBLN5的阳性表达率为70.00%,高于癌旁组织的22.00%,差异有统计学意义(P<0.05)。
2.胃癌组织及癌旁正常组织中FBLN5、ARHGAP4 mRNA表达水平比较:胃癌组织中FBLN5 mRNA表达水平为(2.52±0.51),癌旁正常组织为(1.01±0.23);ARHGAP4 mRNA表达水平为(0.65±0.17),癌旁正常组织为(1.02±0.14),两组比较差异有统计学意义(P<0.05)。
3.ARHGAP4、FBLN5与胃癌病人临床病理参数的关系:ARHGAP4表达与肿瘤部位、Lauren分型、淋巴结转移、TNM分期、分化程度显著相关(P<0.05);FBLN5、与TNM分期、Lauren分型、淋巴结转移、分化程度、CEA、CA19-9、CA125、免疫评分有关(P<0.05)。见表2。
4.Kaplan-Meier生存分析:本研究100例病人中,共有88例病人完成3年随访,末次随访日期2019年5月。Kaplan-Meier分析结果显示,FBLN5高表达组病人3年累积生存率为57.53%(42/73),低于低表达组病人的86.67%(13/15)(Log rank χ2=4.040,P=0.044);ARHGAP4高表达组病人3年累积生存率80.00%(20/25),高于低表达组病人的55.55%(35/63)(Log rank χ2=5.294,P=0.021)。

表2 ARHGAP4、FBLN5与临床病理参数的关系
5.影响胃癌病人生存状况的单因素分析:根据随访结果统计,胃癌病人总的1年、3年生存率分别为79.55%和62.50%。单因素分析结果显示,FBLN5和ARHGAP4表达、分化程度、淋巴结转移、肿瘤直径、TNM分期、CEA、CA19-9、CA125、免疫评分均是影响病人预后的因素(P<0.05)。
6.影响胃癌病人生存状况的Cox回归分析:以是否死亡为因变量,以单因素分析中有统计学意义的因素为自变量进行Cox回归分析,结果显示:淋巴结转移、分化程度、TNM分期、FBLN5阳性、CEA>5 ng/ml、CA19-9>39 u/ml、CA125>35 u/ml、高免疫评分是影响胃癌病人生存状况的危险因素(OR分别为2.335、1.455、2.967、2.302、7.111、6.993、7.548、5.678;95%CI分别为1.151~4.738、1.037~2.042、1.079~8.157、1.095~4.839、2.084~24.266、2.079~23.524、1.269~44.907、1.123~28.704;P<0.05)。ARHGAP4高表达是胃癌病人生存状况的保护因素(OR:0.516,95%CI:0.281~0.947;P<0.05),FBLN5高表达是胃癌病人生存状况的危险因素(OR:2.302,95%CI:1.095~4.839)。见表3。
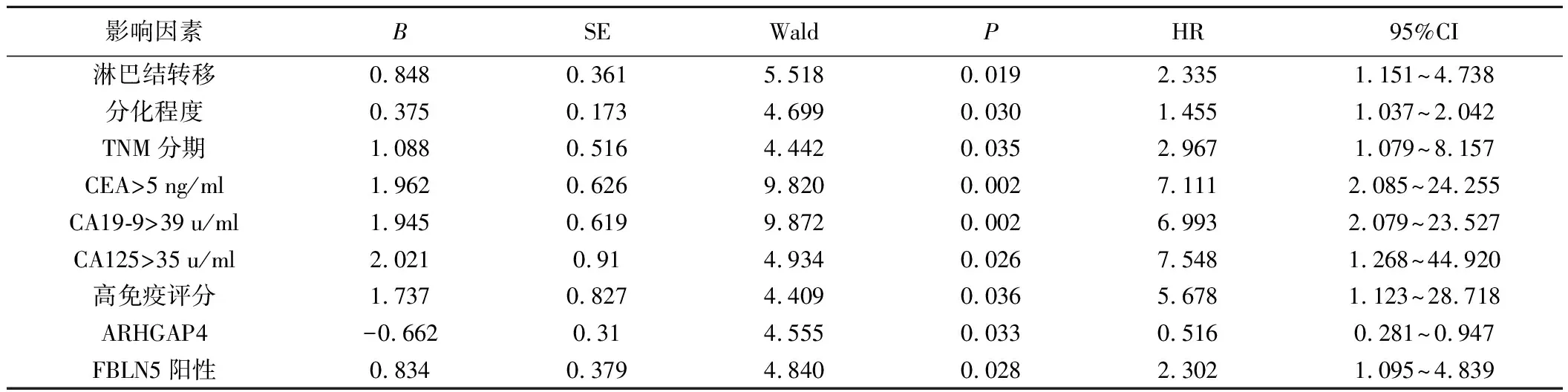
表3 多因素Cox回归分析胃癌病人生存状况的影响因素
讨论
FBLN5是一种纤维蛋白,可以增强内皮细胞的黏附力[7]。有研究表明,FBLN5在前列腺癌、肺癌中作为一个抑癌基因发挥作用[8-9]。FBLN5在鼻咽癌、乳腺癌及胃癌中发挥促癌基因作用[10-11]。在本研究中,胃癌组织中FBLN5表达升高,与文献报道相一致[11],表明FBLN5在胃癌中发挥促癌基因作用,与疾病关系密切,对胃癌的预防具有重要参考价值;与胃癌病人的临床病理特征相关性分析表明,FBLN5与TNM分期、Lauren分型、淋巴结转移、分化程度、肿瘤直径有关,提示FBLN5与胃癌的发展进程密切相关。FBLN5低表达病人3年累积生存率高于高表达病人,FBLN5可能通过影响或调控某个促癌基因的表达,从而影响病人预后,提示FBLN5可作为预测胃癌病人预后的潜在指标。
ARHGAP4可通过催化活性GTP结合态向无活性GTP结合态转化,从而发挥其功能[12],并参与抑制多种细胞过程,如基因转录、细胞增殖、迁移及侵袭等[13]。有研究发现,ARHGAP4在肝癌组织中表达升高,可通过正向调控己糖激酶2的表达促进肝癌细胞的生长[14]。胃癌组织中ARHGAP4表达较癌旁组织降低,提示ARHGAP4在胃癌发展中发挥抑癌基因作用。ARHGAP4表达与肿瘤部位、TNM分期、Lauren分型、淋巴结转移、分化程度有关,提示ARHGAP4可为病情评估提供参考依据。胃癌组织中ARHGAP4表达降低,其抑制肿瘤细胞活性的能力下降,间接促进了肿瘤细胞的增值及迁移,从而影响疾病发展进程;生存分析结果显示,ARHGAP4高表达组病人3年累积生存率显著高于低表达组,可见ARHGAP4表达与胃癌病人预后关系密切。本研究结果显示,淋巴结转移、分化程度、TNM分期、FBLN5、ARHGAP4、CEA>5 ng/ml、CA19-9>39 u/ml、CA125>35 u/ml、高免疫评分均是影响胃癌病人预后的因素,进一步证明FBLN5、ARHGAP4在胃癌发展中发挥重要作用。
综上所述,胃癌组织中FBLN5高表达,ARHGAP4呈低表达,二者共同参与了胃癌的发生发展进程,均是影响胃癌生存状况的因素,联合检测二者在胃癌病人中的表达可为临床胃癌的诊断、治疗和预后评估提供指导。二者在胃癌中的具体作用机制还不明确,其结果需要进一步加大样本量进行验证。

