大花海棠‘比哥’离体快繁再生体系的初步建立
陈彩霞,黄敏,赵怡,曹传取,王吉升,史志话,汪葛峰,高俊山
(1安徽农业大学生命科学学院,合肥 230036;2合肥华绿种苗有限公司,合肥 230041)
0 引言
秋海棠属为全球第六大属被子植物,目前已知近2050种物种,也是世界著名的观赏花卉[1-4]。大花海棠‘比哥’是多年生草本花卉,隶属于秋海棠科秋海棠属,是德国班纳利(Benary)种子公司选育出来的杂交一代品种,以四季秋海棠和竹节秋海棠为主要亲本的杂种后代[5-6]。‘比哥’系列按叶色和花色可分为绿叶红花型、铜叶红花型、铜叶玫红花型。‘比哥’系列品种结合了多种秋海棠的优点,具有早花、花大、花多、花叶颜色丰富、花期长、抗性强以及枝叶繁茂等优点,曾荣获“2008年莫斯科国际花展特别大奖”。
大花海棠是理想的室内外观花盆栽,一般用于园林花带、花镜、花坛以及室内花盆或花篮种植,美化室内外环境,同时也是花园及绿地大面积群植的优良品种,具有较高的观赏和经济价值,开发前景广阔[7]。目前,大花海棠仅在景观应用、栽培管理技术[8]以及扦插繁殖[9]等方面有报道,关于其组织培养快速繁殖方面尚无报道。大花海棠仍采用传统的有性繁殖,杂交F1代具有较高的杂种优势,田间生长性状良好,如果自留种,其F2代发生性状分离,且种子发芽率低,不能保持亲本的优良特性,所以一般不用F2代种子播种。市场调查发现,国内种植的大花海棠主要依赖进口,一粒种子价格高达0.7~0.8 元,大大增加了花卉企业的成本。鉴于此,本研究采用不同植物激素配比,筛选适合大花海棠组织培养快繁的培养基,建立大花海棠组织培养再生体系,旨在为大花海棠离体快速繁殖提供技术参考。
1 材料与方法
1.1 植物材料选择与外植体消毒
试验于2021 年8 月—2022 年10 月在安徽农业大学生命科学学院植物细胞工程实验室进行。选取大花海棠品种‘比哥’系列的绿叶红花型为试验材料,种植于合肥华绿种苗有限公司智能化温室,当植株长到40~50 cm高后,选择园艺性状表现好的植株作为母本。采集刚展开的叶片,并将其用自来水流水冲洗30 min,置于超净工作台,首先用70%酒精消毒10 s,再用蒸馏水冲洗2 次,接着用0.1%的升汞消毒8 min,最后用蒸馏水冲洗5 次,沿着主叶脉方向切成1 cm×1 cm 大小的叶片组织,接种到不定芽分化培养基上[10-12]。
1.2 主要仪器
试验使用的主要仪器包括FST-IV-20 普利菲尔超纯水仪(上海富诗特仪器设备有限公司)、YP3002电子天平(上海佑科仪器仪表有限公司)、HVE-50 高压灭菌锅(平山加工株式会社日本)、SW-CJ-1FD超净工作台(苏净集团苏州安泰空气技术有限公司)、PHS-3E型号PH 计(上海仪电科学仪器股份有限公司)、金尼克超声波清洗器(合肥金尼克机械制造有限公司)、接种器械灭菌器(济南格艾特仪器设备有限公司)。
1.3 培养基配制
1.3.1 不定芽分化培养基诱导不定芽分化的基础培养基为MS 培养基,附加不同浓度的6-BA、2.4-D 和NAA,一共设计9 种(B1~B9)培养基配方(表1)。每种培养基接种60片叶片,每3片叶片接种在同一瓶培养基内,共计20瓶,接种8周后观察不定芽分化情况,分别统计愈伤诱导率和不定芽诱导率,如式(1)~(2)[13],其中,发生不定芽的外植体数包括同时发生不定芽和愈伤组织的外植体。
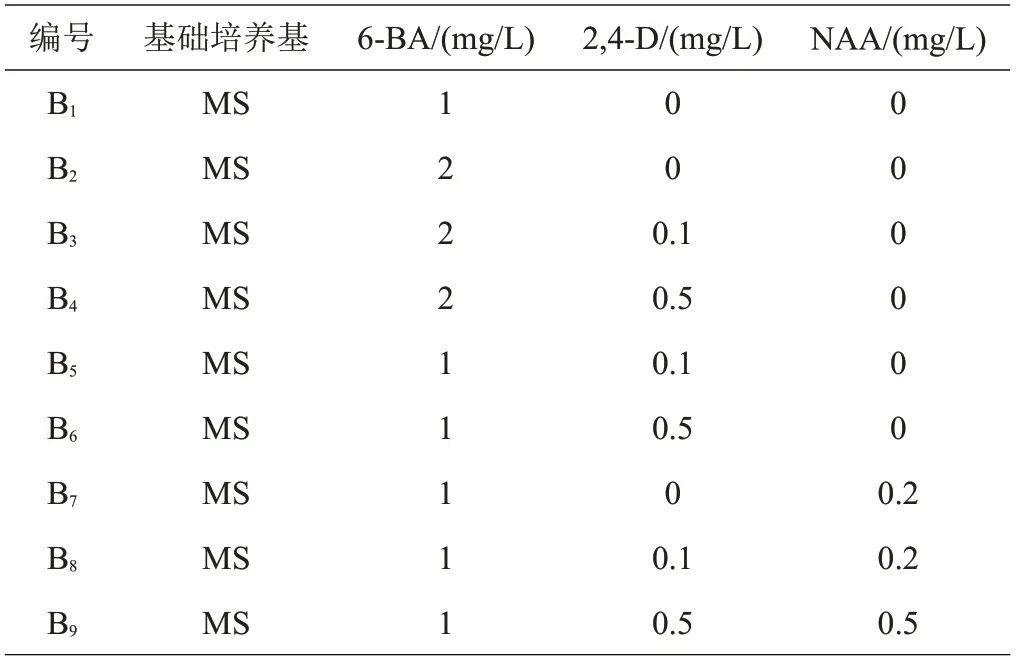
表1 诱导不定芽分化的培养基配方
1.3.2 不定芽增殖培养基将分化培养基中已分化的不定芽切割下来,接种到继代增殖培养基中,继代增殖基本培养基为MS附加不同浓度的6-BA和NAA,共设计9种(P1~P9)培养基配方(表2)。每种培养基接种120团芽,每6团芽接种在一瓶培养基内,共计20瓶,4周继代1次,观察不定芽增殖情况,并统计增殖系数,如式(3)。
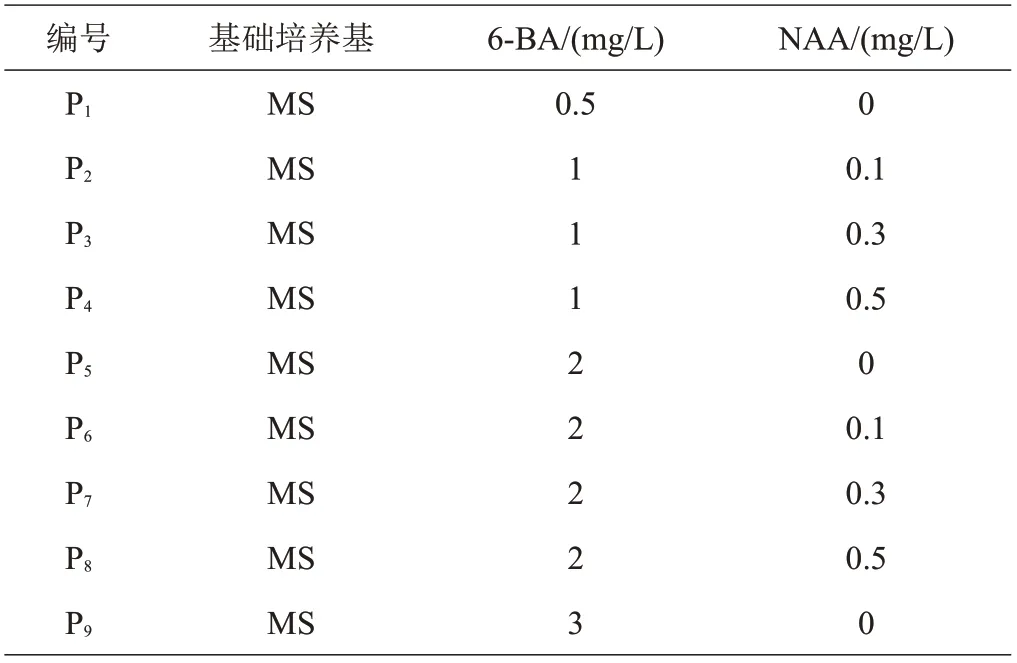
表2 不定芽增殖培养基配方
1.3.3 组培苗生根培养基将高度大于2.5 cm 单株组培苗切下,接种到生根培养基中,生根基本培养基为1/2MS 和MS,附加不同浓度的IBA 和NAA,共设计8种(R1~R8)培养基配方(表3)。每种培养基接种100 株苗,每5株组培苗接种在同一瓶培养基内,共计20瓶,4周后观察其生根情况,统计生根数,如式(4)。
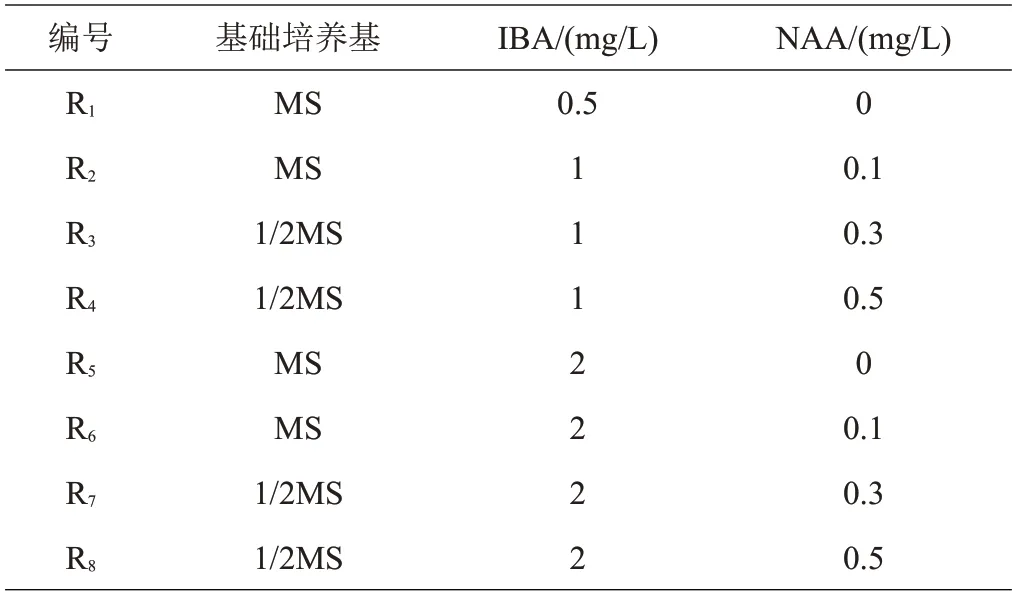
表3 生根培养基配方
1.4 培养条件
研究采用的培养基中含有25 g/L 蔗糖和7 g/L 琼脂,pH 5.8,培养室温度(26±2)℃,光照2000~3000 lx,每天光照12 h、黑暗12 h,培养室相对空气湿度70%。
1.5 数据分析
数据由Microsoft Excel 2010 整理后采用DPS 软件进行方差分析,显著水平为0.05。
2 结果与分析
2.1 大花海棠愈伤组织诱导和不定芽分化
如表4所示,外植体在大部分培养基上培养7~10 d均长出愈伤,但是单独使用6-BA无法获得愈伤,只是原组织无效膨大,随着6-BA浓度的升高,外植体死亡速度加快(图1A~B)。当6-BA 和2.4-D 同时使用,诱导出愈伤并完成分化,且2 种激素比值在10:1 时,愈伤组织诱导率和芽分化率较高,分别为100%和85%以上(图1E、H),比值偏低或偏高都影响愈伤组织诱导和芽分化,甚至导致死亡(图1C~D)。当6-BA、2.4-D和NAA 3 种激素同时使用(B8组合),愈伤诱导速度最快,芽分化速度最快,效果最好,愈伤组织诱导率、芽分化率分别为100%、92.4%(图1H)。因此最佳不定芽分化的培养基为MS+1 mg/L 6-BA+ 0.1 mg/L 2.4-D+0.2 mg/L NAA。

图1 不同培养基对愈伤组织诱导和不定芽分化的影响
2.2 大花海棠不定芽增殖
如表5 所示,随着6-BA 浓度的升高,不定芽分化速度和增殖倍数提高,当6-BA浓度达到1 mg/L时,芽生长势快,而且植株强壮(图2B~D),当6-BA 浓度达到3 mg/L时,分化芽最多,但是芽长势减弱,并出现玻璃化(图2I)。提高NAA浓度易生成根,根生成后不定芽增殖速度减慢,但是不定芽也变强壮。当植物激素6-BA和NAA同时使用,不定芽增殖系数为4.5~7.5,虽然P2组合不定芽增殖系数不是最高,但是不定芽长势表现最佳(图2B),最佳不定芽增殖的培养基为MS+1 mg/L 6-BA+0.1 mg/L NAA。
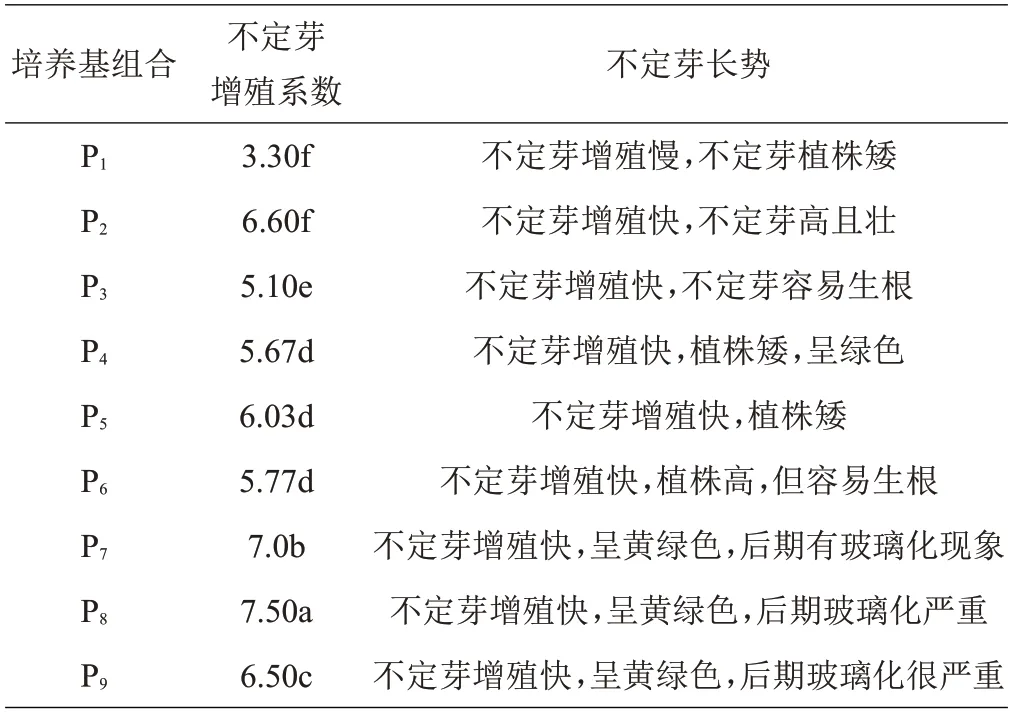
表5 不同激素配比对不定芽继代增殖的影响
2.3 大花海棠组培苗生根
大花海棠组培苗培养4 周后组培苗长势如表6 所示。当基本培养基为1/2MS、激素为IBA时,IBA浓度的升高对大花海棠生根有促进作用,但是也对根系有毒害作用,后期抑制其发育。当基本培养基为1/2MS、激素为NAA 时,NAA 浓度的升高促进了大花海棠生根,根系多且质量好,R8组合根数量最多,每株达10条以上(图3)。综上所述,最佳生根培养基配方为1/2 MS+1.0 mg/L NAA。
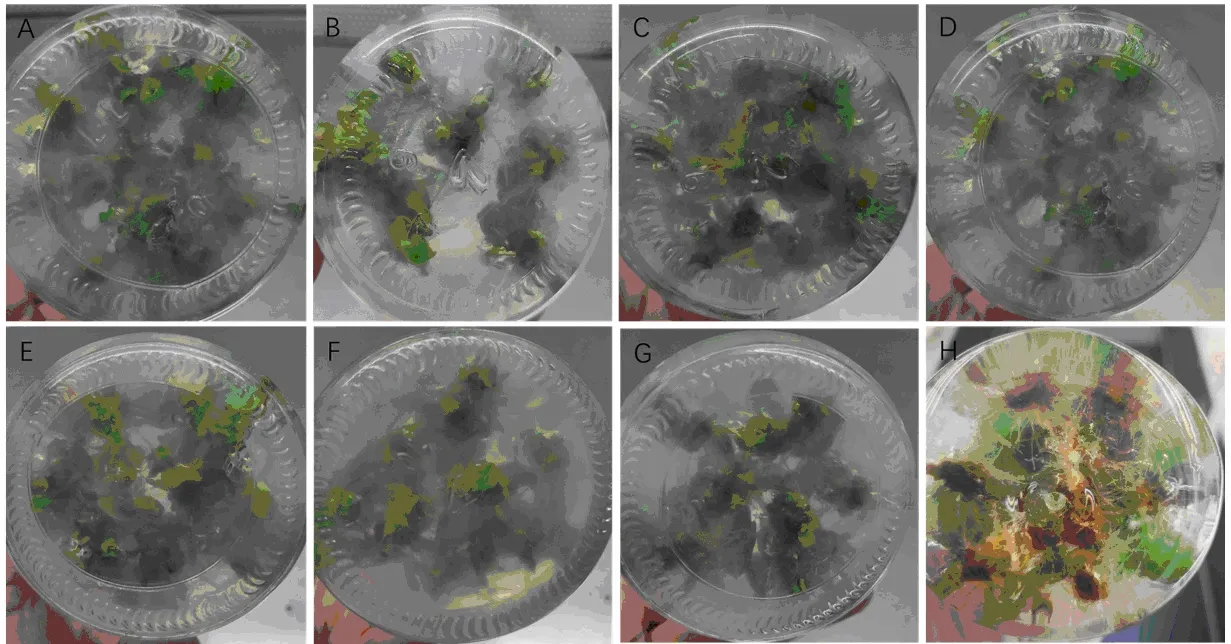
图3 不同培养基对组培苗生根的影响
3 结论
本研究总结了一套大花海棠快繁再生体系的完整方案。以叶片为外植体,大花海棠组织培养再生体系最佳的不定芽分化培养基为MS+1 mg/L 6-BA+0.1 mg/L 2.4-D+ 0.2 mg/L NAA,培养6 周后分化率高达92.4%。6周后再将不定芽按团块方向性切割下来,继代到增殖培养基上,最佳的不定芽继代增殖培养基为MS+1 mg/L 6-BA+ 0.1 mg/L NAA,增殖系数为6.6。根据生产需要进行增殖,每4周继代1次,丛生芽多,而且芽粗壮,无玻璃化。将植株高度达2.5 cm 以上的单株芽接种到生根培养基上,最佳的生根培养基配方为1/2MS+1.0 mg/L NAA,其根系数量可达10 条以上,而且根质量好,当组培生根苗根长达到1.5 cm 以上时可移栽驯化。研究结果可为大花海棠的大规模培养、繁殖及转基因遗传转化提供理论依据。
4 讨论
理论上植物体细胞具有全能性,经体外培养后,在激素作用下进行重编程,通过细胞脱分化和再分化发育成为一个独立的植株[14]。但实际应用上,植物的品种和器官分化能力不同,选择合适的外植体是产生优质再生植株的前提。张悦圆等[15]研究表明,双腺藤快繁再生选择带腋芽的茎段作为外植体优于顶芽;李丹等[16]研究蟆叶秋海棠发现叶片的愈伤组织诱导效果优于叶柄;郑志勇[17]则选择茎段诱导中华秋海棠不定芽。本研究选择叶片作为外植体,其分化能力强,且材料来源充足,采集时不伤害母本,故对于大规模工厂化组培生产种苗,叶片是理想的外植体材料。
增殖系数被认为是衡量组培苗继代培养的重要指标,其受到诸多因素的影响,如培养基、光照、湿度、植物生长调节剂等,植物生长调节剂是影响增殖系数最关键的因素。一般来说,生长素和细胞分裂素比值高利于根形成,反之利于茎芽的发生。针对组培不同阶段植物生长的需求,对激素种类和浓度进行筛选,是组培工作的重点和难点[18-19]。国内对于秋海棠科秋海棠属植物研究植物生长调节剂对组培苗增殖系数的影响早已有相关报道,丽格海棠继代增殖培养最佳植物激素配比为6-BA 2 mg/L+NAA 0~0.1 mg/L,增殖系数可达5.8[20];李丹等[16]认为蟆叶秋海棠芽增殖激素浓度为6-BA 0.1 mg/L+NAA 0.1 mg/L,增殖系数可达6.8。但本研究发现大花海棠芽增殖时植物生长调节剂配比为6-BA 2 mg/L+NAA 0.5 mg/L,增殖系数高达7.5。
合适浓度的糖和氮源有利于植物组培苗生根诱导。研究表明,低糖、低氨盐培养基有利于多数植物试管苗生根[21-22]。蔗糖浓度不适合会引起异养无根苗的饥饿,或渗透压低于或超出最适水平从而不利于生根,低盐培养基可能是因为培养基中的氮源降低到了一个有利于试管苗生根的水平[23]。本研究发现,低盐培养基1/2MS 比高盐培养基MS 更适合生根培养,而R8培养基的生根效果更好,可能是因为R8培养基的成分更适合大花海棠组培苗不定根的生长。生长素IAA、IBA和NAA常用于诱导生根,研究证明IAA在启动不定根形成时起关键作用[24],而IBA促进IAA的形成、运输,间接促进生根[25]。NAA促进组培苗储存的淀粉水解成为还原糖,有利于不定根的形成[26]。生长素的作用机理不同,因此对不同品种生根作用不同,本研究发现IBA和NAA对于生根的影响在一定浓度范围内,高浓度促进生根,而NAA更适合大花海棠生根。
大花海棠组培再生体系的建立是一个复杂的过程,从愈伤组织诱导、不定芽分化、不定芽继代增殖、最后到组培苗生根都是环环相扣,前一个阶段生长长势间接影响下一阶段生长。从试验结果看出,对于双子叶植物大花海棠而言,单一的生长素不利于诱导愈伤,需要添加细胞分裂素,合适的细胞分裂素和生长素比例浓度促进脱分化及再分化[27]。从大花海棠组培苗继代增殖可看出,此过程对激素较敏感,较低浓度的细胞分裂素6-BA 和NAA 便可满足其生长需求,浓度过高无效芽增多,而且后期玻璃化严重。高浓度的IBA 对大花海棠组培苗生根前期形成有促进作用,但是后期抑制其发育,而NAA 为1.0 mg/L 时促进植株生长,根系发达。因此,组培再生是一个复杂的动态过程,在组培生产中应根据组培苗的长势而调节培养基配方。

