氧化应激损伤在砷暴露与糖尿病之间的中介作用研究*
杨 微,魏翠英,王 丽,张琪瑶,王雨洁
(1.内蒙古科技大学包头医学院第一附属医院老年科,内蒙古 包头 014010;2.内蒙古科技大学包头医学院公共卫生学院)
砷是一种天然存在的类金属,主要以硫化物的形式存在于地质环境中,在自然环境中分布普遍,可以通过自然变化和人为活动存在于水、空气、土壤、食物和其他环境媒介中[1-2]。在自然与人为环境中接触砷是砷暴露的主要途径。砷的主要自然来源是地质构造,包括沉积在沉积岩、火山岩和土壤中的砷。地壳中的砷水平起伏不定,但平均水平估计在1.5~5 mg/kg之间。砷的主要人为来源是煤的燃烧、化学试剂的排放等。砷污染是一种常见的环境污染,对全球公众健康构成威胁。饮用水砷中毒已成为世界性的公共卫生问题,其也被认为是全球环境健康和全人类生命安全的严重威胁[3]。长期砷中毒可导致心血管疾病、糖尿病以及神经毒性、肾毒性、肝毒性疾病[4]。墨西哥的调查发现,无机砷可能会增加糖尿病患病概率[5]。2003-2004年国家健康与营养检查(NHANES)的结果显示,暴露在低浓度的砷也可能会增加患2型糖尿病的风险[6]。
糖尿病(diabetes mellitus, DM)是一种代谢性疾病,以持续性的高血糖与血管并发症为特点。是胰岛素分泌或功能紊乱或两者兼而有之的疾病。目前,许多国家正处于全球DM“流行病”的边缘,DM正在全球迅速蔓延。根据WHO的分类(1999,经修订),DM分为四种类型,其中两种类型:1型DM(type 1 diabetes mellitus, T1DM),由胰腺破坏β细胞引起绝对胰岛素不足;2型DM(type 2 diabetes mellitus, T2DM),主要是与胰岛素分泌及其相对不足以及可能伴随的胰岛素抵抗有关。内蒙古自治区不仅成为全国乃至全球最大的饮水型砷污染地区,而且巴彦淖尔市被确定为地方性砷中毒发病率最高的区域之一[7]。目前还没有有效的治疗方法来完全缓解生物系统中的砷毒性,但学者普遍认为氧化应激是当前被广泛认可和研究的一种砷毒性反应机制[8]。氧化应激损伤是一种负面影响,主要由过量产生的活性氧(reactive oxygen species, ROS)所造成,这种损伤表现为体内氧化和抗氧化失调、细胞构型破坏和功能障碍[9]。氧化应激通常可以通过超氧化物歧化酶(superoxide Dismutase, SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase, GSH-Px)和丙二醛(malondialdehyde, MDA)的含量来衡量疾病发生和发展过程中机体氧化损伤的程度,此外,有学者指出糖尿病的发病机制和并发症进展程度可能取决于机体氧化应激的程度[10],但较少研究探讨砷中毒、氧化应激和糖尿病三者之间关系。鉴于上述背景,本研究拟采用抽样调查方法和病例对照研究方法来揭示砷中毒、氧化应激和糖尿病之间的内在联系,以探究砷中毒相关的发病机制,对制定砷暴露人群糖尿病防治策略有一定的临床参考价值。
1 对象与方法
1.1研究对象 (1)抽样调查法:以巴彦淖尔市杭锦后旗的218例居民均长期居住在受饮水砷污染地区但无明确接触史的居民作为研究对象。纳入标准:在当地居住超过20年、无明确砷职业接触史、年龄20~70岁居民者。排除标准:外出工作者,患有明显的心脏病、肝病、呼吸系统疾病、严重内分泌系统疾病和遗传病的自述者。按照居民尿砷含量分为低砷组(<13.55 μg/g Cr)(n=73),中砷组(13.56~36.24 μg/g Cr)(n=73),高砷组(>36.25 μg/g Cr)(n=72)。(2)病例对照法:参照糖尿病诊断标准[11],将25例糖尿病患者纳入病例组(n=25);采用倾向评分匹配法(PSM)按1∶5的比例匹配对照组病例数,最终随机选取125例居民纳入对照组。本研究已通过包头医学院医学伦理委员会的伦理审查,参与者均已签署知情同意书。
1.2研究方法 以问卷调查和医生开展体格检查的方式获取患者基本资料,并采集研究对象的尿液和血液,通过原子荧光法测定尿砷含量,通过检测试剂盒测定每组人血清中的氧化应激指标(包括SOD、GSH-Px和MDA)。
1.2.1血样、尿样的采集与预处理 (1)在聚乙烯离心管中经硝酸浸泡处理后,取10 mL血液样本放入促凝管内,记号笔标记,放置4 ℃冰箱中冷藏,当天运回实验室后进行血清血浆的分离,然后将离心后的血清、血浆储存在-80 ℃下备用。(2)采集研究对象尿样30 mL,将其置于硝酸浸泡24 h的尿杯中,标签贴完后,将样品每10 mL装入离心管,并存放于-20 ℃的冰箱中,用于尿砷和尿肌酐检测。在锥形瓶内依次加入5 mL尿样和5 mL硝酸∶高氯酸=4∶1的混合液。摇匀,放在电热板上加热至透明清亮,后蒸干变成白色结晶,冷却,避光放置,再加入5 %盐酸约7 mL,然后转移至25 mL的比色皿中,加5 %硫脲5 mL、5 %抗坏血酸5 mL、20 %盐酸6.25 mL,最后用5 %盐酸定容至25 mL,混合均匀,于4.0 ℃保存,另外准备空白试剂。实验过程所需所有器皿均经硝酸浸泡24 h并清洗干净。
1.2.2主要试剂和仪器设备 砷标准储备液(1 mg/mL)(国家标准物质研究中心),肌酐检测试剂盒、SOD检测试剂盒、GSH-Px 检测试剂盒、MDA检测试剂盒(南京建成生物科技有限公司);PF6-2非色散原子荧光光度计(北京普析通用仪器有限责任公司),HPX-9082 MBE数显电热培养箱(上海博迅实业有限公司医疗设备厂),砷特种空心阴极灯(上海电光器件有限公司),离心机(上海安亭科学仪器厂),BS-180VET全自动生化分析仪(深圳迈瑞生物医疗电子股份有限公司)。
1.2.3尿肌酐含量测定 本研究测定尿液样本中的肌酐含量采用苦味酸肌酐试剂盒,稀释比例为1∶200。将10 mL蒸馏水滴入50 μL尿样中稀释后,在510 nm处测量吸光度值,基于吸光度值计算尿肌酐。
1.2.4尿砷含量测定 在测试前,设置完成高性能砷空心阴极灯的主阴极灯电流为50 mA、辅阴极灯电流为50 mA、原子化器温度200 ℃、负电压240 V、载气流量300~500 mL/min、屏蔽气流量600~1 000 mL/min、集成时间10 s、进样量1 mL及自动进样分析等工作条件。在设定仪器工作条件后,测量砷标准系列溶液、样品空白、样品试样的荧光强度,并基于此创建出砷标准曲线,计算样品空白、样品溶液中的砷含量。最终,总砷含量值以校正后 Cr 值为准,单位为μg/g。
1.2.5氧化应激指标检测 在聚乙烯离心管中经硝酸浸泡处理后,从研究对象静脉采集10 mL血液,并放入促凝管内,记号笔标记,放置4 ℃冰箱中冷藏,当天运回实验室后进行血清血浆的分离,然后将离心后的血清、血浆储存在-80 ℃下备用。测定SOD含量采用黄嘌呤氧化酶法,测定GSH-Px含量采用二硫双硝基苯甲酸还原法,测定MDA含量采用硫代巴比妥酸法,测定均按试剂盒的说明书进行。
1.3质量控制 现场调查前,对调查人员进行统一培训,内容包括模拟现场,统一问卷填写方式,问卷调查人员要能够向居民解释好统计问题的要求和意义,避免引导被调查者回答问题,要让被调查者根据自己的主观意识回答,调查员严格质控,尽量避免漏项。现场调查时,生物样品的采集时所用的采血针、采血管、尿杯、离心管等均应保存在洁净的环境中,防止污染。采血管、尿杯等清楚标号。血液采集后放入冰盒中保存,回到实验室立即进行血清和血浆的分离并储存在-80 ℃。尿液运回实验室进行分装,于-20 ℃冰箱中保存。因尿砷受饮食影响因素较大,因此,采集尿样前3天告知居民避免食用海产品或中草药。为减少实验误差,本研究在生物样品进行实验检测前均应对检测仪器进行校对;如果实验数据有较大偏差,应重新进行检测,在测定样品时也应每10个样品进行平行双样测定。
2 结果
2.1抽样调查研究结果
2.1.1研究对象的基本情况 选择巴彦淖尔市杭锦后旗饮水砷暴露地区为调查点,选择当地居民为研究对象。经χ2检验结果显示,低砷组、中砷组和高砷组的糖尿病、吸烟分布情况比较,具有统计学差异(χ2=13.6,P=0.001;χ2=6.6,P=0.037),低砷组、中砷组和高砷组之间的年龄、性别、最高文化程度、职业、吸烟、饮酒、高血压、冠心病、脑卒中、血脂异常、骨及关节病间差异无统计学意义(P>0.05)。见表1。

表1 一般人口学指标在不同尿砷组别之间的分布情况比较[n(%)]
2.1.2不同砷暴露水平居民氧化应激指标的结果 (1)各组间氧化应激指标结果表明,低砷组、中砷组和高砷组的SOD、MDA水平比较,差异具有统计学意义(P<0.05);组间两两比较结果显示,高砷组的SOD水平低于低砷组,MDA水平高于低砷组,差异具有统计学意义(P<0.05);中砷组的MDA水平高于低砷组,差异具有统计学意义(P<0.05)。低砷组、中砷组和高砷组的GSH-Px活力水平比较,差异无统计学意义(P>0.05)。(2) 氧化应激指标与尿砷含量相关性分析结果表明,GSH-Px活力、SOD与尿砷含量呈负相关性(均P<0.05),相关系数分别为-0.194和-0.137;MDA与尿砷含量呈正相关性(P<0.001),相关系数分别为0.264。见表2、表3、表4。

表2 不同砷暴露水平人群氧化应激指标测定结果比较[M(P25,P75),n=218]

表3 氧化应激指标与尿砷含量的相关性分析的相关性系数(rs值)

表4 氧化应激指标与尿砷的关联性分析(P值)
2.2病例对照研究结果
2.2.1病例组与对照组的基本情况 糖尿病病例组和对照组的基本资料比较结果显示,两组患者的高血压和血脂异常分布比较,差异具有统计学意义(χ2=5.4,P=0.020;χ2=7.5,P=0.006);其余两组患者的一般人口学因素比较,差异无统计学意义(P>0.05)。见表5。

表5 病例组与对照组一般人口学指标的比较[n(%)]
2.2.2氧化应激指标对糖尿病患病率的影响 糖尿病病例组和对照组的氧化应激指标比较结果显示,GSH-Px活力、SOD、MDA水平在两组间表达差异具有统计学意义(P<0.001),病例组患者的GSH-Px活力、SOD值低于对照组患者的GSH-Px活力、SOD值,MDA值高于对照组患者的MDA值。见表6。

表6 病例组和对照组氧化应激指标测定结果比较
2.2.3糖尿病患病率的影响因素 以糖尿病患病情况(赋值:否=0,是=1)为因变量,以单因素分析中有统计学意义的变量[GSH-Px活力(赋值:实测值)、SOD值(赋值:实测值)、MDA值(赋值:实测值)、高血压(赋值:否=0,是=1)、血脂异常(赋值:否=0,是=1)]为自变量,进行多因素Logistic回归分析。多因素Logistic回归模型分析结果显示,GSH-Px活力、SOD值是糖尿病发生的独立保护因素,GSH-Px活力和SOD升高会降低糖尿病的发生概率,MDA是糖尿病发生的独立危险因素,MDA升高会导致糖尿病患病概率提高。见表7。

表7 砷暴露居民糖尿病患病率影响因素的Logistic回归分析
2.3不同砷暴露水平与糖尿病患病率的关系
2.3.1不同砷暴露水平对糖尿病患病率的影响 通过对尿砷组别(分类变量)与糖尿病发生概率进行趋势性检验来观察尿砷水平(连续变量)与糖尿病患病率之间的关系。趋势性检验结果显示,高砷组糖尿病患病率(20.83 %)高于中砷组糖尿病患病率(12.33 %)和低砷组糖尿病患病率(1.37 %),中砷组糖尿病患病率高于低砷组糖尿病患病率,差异具有统计学意义(P<0.05);尿砷浓度与糖尿病发生风险呈正相关性,尿砷水平越高,糖尿病发生风险越高(P趋势=0.024,OR=11.25)。见表8。

表8 不同砷暴露水平人群对糖尿病患病率的比较
2.3.2氧化应激指标在不同砷暴露水平与糖尿病患病之间的中介作用 本研究通过构建中介效应模型探究介导尿砷水平与糖尿病发生之间的间接效应因子。结果显示GSH-Px活力、SOD和MDA在尿砷水平与糖尿病患病中起中介作用(P<0.05)。本研究推测砷可能通过影响患者体内氧化应激机制从而导致了糖尿病的发生。见表9。
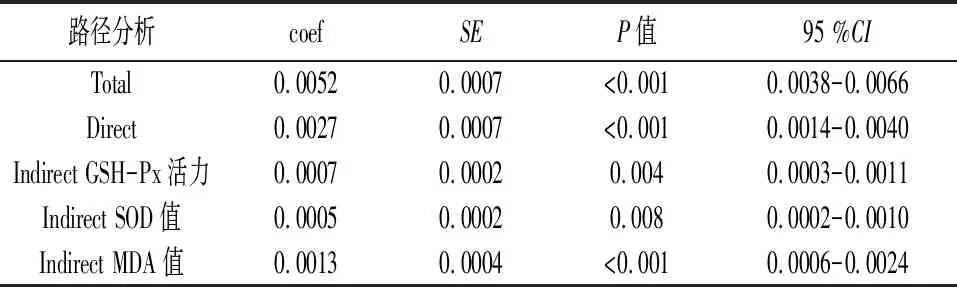
表9 不同砷暴露水平与糖尿病患病之间的中介效应分析
3 讨论
砷是一种自然存在的元素,在地壳、海水和人体中的比例排名分别为第20位、第14位和第12位,而亚砷酸盐在饮用水中的浓度介于0.01~3.7 mg/L之间。由于火山和工业活动,砷被排放到环境中,但普通民众接触砷的主要途径是通过摄入受污染的饮用水和受污染的食物。由于不同个体的污染源、饮食习惯和砷甲基化过程有很大差异,有研究指出,长期接触砷可能会导致多个器官的损伤和功能异常,包括肺、心脏、肝脏、肾脏和皮肤等,最严重的后果是可能会引发癌症[12]。因此必须在普通人群中研究日常食物摄入量与砷生物标志物的关系。最新数据显示,2019年世界人口中约有4.63亿糖尿病患者[13],有学者指出,饮水砷暴露地区糖尿病发病率显著升高,这提示砷暴露与糖尿病存在相关性[14-16]。因此,探讨砷暴露与糖尿病患病之间的作用机制,对预防砷暴露人群罹患糖尿病有重要意义。
目前公认的砷中毒的分子机制包括遗传、表观遗传的变化、氧化应激作用、促进细胞增殖、调节基因表达,其中氧化应激是研究砷中毒机制的重要理论之一,当人体无法及时清除砷产生的过量ROS产生的自由基时,自由基水平的增加就会导致细胞突变,最终引起氧化应激[17],最新研究也显示,砷引起的氧化应激与男性和女性生殖障碍有关[18]。与癌症和神经退行性等疾病相似,氧化应激与糖尿病的发病率有着广泛的联系,氧化应激是糖尿病及其相关并发症发生发展的重要原因,而抗氧化酶则有多种,包括超氧化物歧化酶、磷脂酰肌醇氧化酶、谷胱甘肽过氧化物酶和过氧化氢酶等。
SOD是细胞中的抗氧化酶,其主要包括铜/锌超氧化物歧化酶、锰超氧化物歧化酶和细胞外超氧化物歧化酶(extracellular superoxide dismutase, EcSOD),其能够去除氧自由基,发挥重要作用[19];SOD还作为一种金属酶,能够有效清除超氧物阴离子自由基,在体内氧化和抗氧化过程中起着重要作用[20],研究表明,砷对SOD活性有抑制作用,砷的肝脏毒性作用可能通过主要抗氧化物酶SOD失活来实现的[21]。GSH-Px是一种重要的硫醇抗氧化酶,可以通过以GSH为底物催化过氧化氢的分解,发挥抗氧化作用。而谷胱甘肽过氧化物酶-1(glutathione peroxidase 1,GPX-1)是一种细胞抗氧化酶,可以将过氧化氢还原为水,以减少其对细胞的有害作用[22],此外,GSH-Px在维持细胞氧化还原状态方面具有非常重要的作用。已有文献报道,砷对GSH-Px活性的影响主要表现为抑制作用,砷对巯基(-SH)有很高的亲和力,-SH是GSH-Px的有效活性组分,它的活性可能受到砷与-SH结合的影响,从而导致活性降低。这可能是因为进入体内的砷可以改变GSH-Px分子的构象,影响其生物合成和代谢过程,从而降低其活性[23]。MDA可用于评估人体血浆中脂质过氧化反应的不同生理和病理情况,因氧自由基攻击生物膜而产生的过氧化物产物,使其成为一种有价值的生物标志物[24]。当脂质过氧化(lipid peroxide, LP)反应引发时,MDA水平会上升,而SOD与GSH-Px的抗氧化能力则会下降。最近的一项研究表明,亚砷酸钠暴露下显著增加了MDA含量,降低了GSH含量、SOD和GSH-Px的活性,无机砷通过激活Nrf2通路导致肺组织氧化抗氧化平衡紊乱[25];Strom等[26]发现,1型和2型糖尿病的患者其SOD3、GSH浓度均低于对照组;人群对照研究结果也表明,2型糖尿病患者的氧化应激风险增加,表现为血浆MDA和血小板MDA增加以及辅酶Q10减少,并且这种氧化应激随着血糖控制不佳而增加[27]。
本次研究结果显示,GSH-Px活力、SOD是糖尿病发生的独立保护因素,GSH-Px活力、SOD升高会降低糖尿病的发生概率,MDA是糖尿病发生的独立危险因素,MDA升高糖尿病患病概率提高,这与上述观点相符合。我们猜测砷暴露可能通过影响居民机体氧化应激机制从而导致了糖尿病的发生,GSH-Px活力、SOD和MDA在尿砷水平与糖尿病患病中起中介作用。但目前的研究存在一些局限性。首先,严格的纳入和排除标准也决定了我们无法评估更加广泛的糖尿病患者群体。此外,由于临床干预中的伦理考虑和确保实验数据的准确性,严格地控制了样例的筛选,样例的减少也是可能引起结果偏倚的重要原因。这也意味着我们无法从整个糖尿病患者群体中获得我们需要的充分数据。尽管观察到砷暴露、氧化应激指标、糖尿病之间存在一定的相关性,但是,要准确地评估这种关系,未来需要更大规模的研究来收集更多的样本加以验证。本研究作为一种探索性的创新,我们希望在日后研究中能增加研究的数据量,从而得出更为科学、有效和更有说服力的结果,期望于能进一步为流行病学研究中的遗传环境交互作用研究提供重要的基础性线索,以便于进一步深入地揭示其中的特征、规律以及其作用机制。

