多花黄精种子萌发前后基因表达特征分析
刘保财, 陈菁瑛*, 张武君, 刘剑超, 黄颖桢, 赵云青, 刘红跃
( 1. 福建省农业科学院农业生物资源研究所, 福州 350003; 2. 福建省农业科学院药用植物研究中心, 福州 350003; 3. 福建省南平市邵武市农业农村局, 福建 邵武 354000; 4. 福建省南平市邵武市林业局, 福建 邵武 354000 )
多花黄精(Polygonatumcyrtonema)属于黄精属多年生草本植物(Chen et al., 2000),为习用的药食两用物种(Li et al., 2022; Wu et al., 2022),具有补气养阴、健脾、润肺、益肾的功效,用于治疗脾胃气虚、体倦乏力、胃阴不足、口干食少、肺虚燥咳等疾病(国家药典委员会, 2020)。现代药理研究表明,多花黄精含有多糖、生物碱、黄酮等生化成分,具有降血糖、抗疲劳、抗炎、抗菌和调节免疫等作用(Li et al., 2018, 2020; Gan et al., 2022)。随着人们对多花黄精的认知加深,其倍受青睐,栽培面积逐步扩大(黄申等, 2020)。多花黄精等药用植物的种子存在后熟的生理现象,收获后需要沙藏贮存,常规晒干后迅速降低种子的发芽率(刘保财等, 2015; 安瑞朋等, 2020),而多花黄精种子苗的繁育对多花黄精的生产及其产业健康发展具有重要意义(刘保财等, 2017)。
转录组测序技术已成为种子萌发( Chen et al., 2022)、生物合成( Liu et al., 2022; Song et al., 2022)等关键基因发现的有效手段。基于转录组方法,对重楼种子休眠解除过程中差异基因的表达情况及相关代谢通路进行研究,明确重楼种子的休眠与脱落酸、赤霉素、生长素、油菜甾醇、细胞分裂素、乙烯、茉莉酸和水杨酸相关(Song et al., 2022);粗茎秦艽种子萌发前、萌发中及萌发后3个阶段的转录组分析结果表明,光照条件和激素水平为粗茎秦艽种子萌发过程的重要调控因子(杨晓等, 2021);鸡骨草种子具有极低的发芽率,通过赤霉素处理,编码CYP78A5、Bg7s、GA-20-ox、rd22、MYB4、LEA、CHS等蛋白的基因发生了上调(Shimizu et al., 2022);同属黄精种子的转录组学研究揭示了变温可打破种子上胚轴的休眠机制,明确植物激素、染色体修饰、DNA甲基化、mRNA降解、胚乳弱化和细胞壁结构相关的基因协同控制着黄精种子萌发、上胚轴休眠和幼苗形成(Liao et al., 2021)。在黄精种子发育与休眠解除过程中,与种胚形态建成、多糖分解及蛋白质合成等相关的差异基因表达上调且涉及多个代谢途径的相互作用,构成复杂的休眠解除调控网络(罗丽娜和向增旭, 2021; Zhang et al., 2022)。然而,当前关于多花黄精种子的萌发过程的基因研究报道较少,尤其是对种子萌发具有关键作用的特征性表达通路与基因尚不清楚,阻碍了多花黄精种子育苗、种子生理及其综合开发利用。本研究利用转录组学方法,对多花黄精种子萌发过程中的4个阶段开展了测序,拟探讨:(1)多花黄精种子萌发后,哪些通路为关键通路;(2)这些关键通路上哪些基因进行了显著变化。为打破多花黄精种子休眠、促进种子萌发及其生理生化等方面研究奠定基础。
1 材料与方法
1.1 材料和试剂
试验材料采集于福建省泰宁县,经福建省农业科学院农业生物资源研究所陈菁瑛研究员鉴定为多花黄精(Polygonatumcyrtonema),种植于邵武市和平镇和平村林下。2019年11月采集10株果皮发黑的成熟的果实,经8 d堆置发酵后,用手捏碎变软的果实,漂去果皮等杂质并用水清洗,干净的种子作为试验材料备用。
DP441-RNAprep Pure多糖多酚植物总RNA提取试剂盒,购自天根生化科技(北京)有限公司;NEBNext®UltraTM RNA Library Prep Kit,购自Illumina, Inc.; TransScript®All-in-One First-Strand cDNA Synthesis SuperMix for qPCR(One-Step gDNA Removal)(AT341),PerfectStart®Green qPCR SuperMix (DyeⅡ),购自北京全式金生物技术有限公司;无水乙醇,购自西陇科学股份有限公司。
1.2 仪器和设备
NanoPhotometer(德国Implen公司);Agilent 2100 Bioanalyzer (安捷伦科技有限公司);5424R高速低温离心机(德国Eppendorf 公司);2100凝胶成像仪(上海勤翔科学仪器有限公司);水平电泳装置(北京市六一仪器厂);海尔MI-2270M (N)微波炉(青岛海尔微波制品有限公司);微量紫外-可见光分光光度计(NanoDrop One)[赛默飞世尔科技(中国)有限公司];AE124/JY10002型电子分析天平(上海舜宇恒平科学仪器有限公司);ABI QuantStudio 3荧光定量PCR仪[赛默飞世尔科技(中国)有限公司]。
1.3 材料处理
将洗干净的种子用无菌水冲洗10遍,立即取约3 g种子,放入液氮中冻存10 min,然后移入-80 ℃冰箱中保存,直到RNA提取(图1: A)。剩下的种子用于沙藏,沙藏所需的河沙需经过121 ℃灭菌30 min,并用少量的无菌水保持河沙湿润,沙藏期间每周定期检查并用无菌水补充水分。沙藏150 d后,挑选胚刚突破种皮的种子(图1: B)和初步形成的第一个微根状茎的种子(图1: C),种植20 d后,挑选变绿的微根状茎的种子(图1: D),以上萌发阶段各取样约3 g,用清水冲洗干净,吸干表面的水分,立即放入液氮中冻存10 min,再移入-80 ℃冰箱中保存,用于RNA提取。上述取样均3次生物学重复。
1.4 建库测序
取上述沙藏前(A)、萌发后(B)、微根状茎(C)、绿色微根状茎(D)4个萌发阶段的种子各约0.5 g,采用DP441-RNAprep Pure多糖多酚植物总RNA提取试剂盒[天根生化科技(北京)有限公司]分别提取各萌发阶段的总RNA,3次生物学重复。NanoPhotometer:检测RNA纯度(OD 260/280及OD 260/230比值)和Agilent 2100 Bioanalyzer:检测RNA完整性。进一步使用试剂盒Illumina 的 NEBNext®UltraTM RNA Library Prep Kit,参照说明书构建文库。构建文库后,先使用Qubit 2.0 Fluorometer初步定量,再使用Agilent 2100 Bioanalyzer检测文库的insert size,符合预期后,用qRT-PCR对文库有效浓度进行准确定量。库检合格后,由北京诺禾致源科技股份有限公司应用Illumina HiSeq 2500完成序列的测定。
1.5 数据分析
1.5.1 数据组装及注释 将获得的 Raw reads 去除带接头、含N和低质量 reads,获得Clean data,并进行 Q20、Q30和GC含量计算。当前多花黄精尚无参考基因组序列,因此本研究采用denovo组装方法,使用Trinity软件对Clean data进行拼接、组装,进一步通过Corset(Davidson &Oshlack, 2014)软件,对转录本聚类去冗余,最终每个cluster被定义为“Unigene”,用BUSCO (Benchmarking Universal Single-Copy Orthologs) 对拼接得到的Trinity. fasta,unigene. fasta和cluster. fasta 进行拼接质量评估,作为后续分析的参考序列。使用NCBI blast对Unigene进行Nt注释,Diamond对Unigene进行Nr、KOG/COG、Swiss-Prot注释, HMMER对Unigene进行Pfam注释,KAAS对Unigene进行KEGG注释,Blast2 GO进行GO注释。
1.5.2 基因表达水平分析 采用RSEM软件(Li &Dewey, 2011),调用Bowtie2对比并对结果进行统计,以Trinity拼接得到的转录组作为参考序列(Ref),将每个样品的clean reads往Ref上做匹配,获得单个样品的匹配率,统计每个样品中某基因比对到的reads数目,然后进行FPKM (expected number of Fragments Per Kilobase of transcript sequence per Mil-lions base pairs sequenced) 转换,进而得到单个样品中基因和转录本的表达水平。
1.5.3 差异基因表达分析 使用基于负二项分布的模型确定数字基因表达数据中的差异表达的DESeq R包(1.10.1)进行两个条件/组的差异表达分析,使用Benjamini和Hochberg的方法校正得到P值以控制错误发现率,Padj<0.05的基因认定为差异表达。基于 GOseq( Young et al., 2010)所述方法对筛选到的DEGs进行GO富集分析。基于KEGG注释结果,使用 KOBAS,进行 KEGG Pathway富集分析(Mao et al., 2005)。
1.5.4 qRT-PCR验证 经过差异表达基因分析后,在植物信号转导通路中,随机选取6个差异基因,设计引物(表1),以沙藏前后的RNA 为模板,按照 TransScript®All-in-One First-Strand cDNA Synthesis SuperMix for qPCR(One-Step gDNA Removal)(AT341)试剂盒进行反转录合成cDNA。参照 PerfectStart®Green qPCR SuperMix(+DyeⅡ)试剂盒说明书,以cDNA为模板,在ABI QuantStudio 3仪上完成 qRT-PCR。用2-ΔΔCt方法计算每个基因在不同样品中的相对表达量(Livak &Schmittgen, 2001)。Actin为内参基因。
2 结果与分析
2.1 转录组测序和 de novo组装
测序后,获得的具体数据见表2,各样本获得了42 589 470以上的Raw reads,过滤后得到6.03 Gb以上的测序量,Q30≥93.04%,GC含量为46.98%~49.47%。由于尚无多花黄精的全基因组作为参考,因此采用denovo方法对序列进行组装,分别获得了388 231 Transcripts (361 956 157 bp)和178 319 Unigenes (146 022 913 bp),Transcripts和Unigenes的最大长度、N50长度分别为15 875、15 875、1 294、1 059 bp。获得的178 319个Unigenes在Nt、Nr、KOG/COG、Swiss-Prot、Pfam、KEGG、GO全部100%注释,各数据注释个数及比例见表3,7个数据库共注释了178 319个Unigenes。
2.2 萌发前后基因表达水平
以组装后的序列为模板,将沙藏前A1、A2、A3和萌发后B1、B2、B3各样本的Clean reads与之比对,各样本的匹配reads数目和匹配率见表4,沙藏前的匹配率为75.19%~75.67%,萌发后的匹配率为71.63%~74.23%。对各样品表达的Unigenes数目进行统计并转换为FPKM,然后根据FPKM大小划分区间,各区间的表达量及所占比例见表5,萌发后的B1、B2和B3 FPKM>15的Unigenes数量均高于沙藏前的A1、A2和A3,说明经沙藏萌发后,高表达的基因数目得到了增加。
2.3 萌发前后基因表达差异分析
比较萌发前后的各样品基因(图2: A),共有显著性差异的Unigenes 11 817个,其中表达上调的有6 405个,表达下调的有5 412个。进一步将上调或下调差异基因在GO数据库中富集(图2: B),无论是上调还是下调的差异基因,均主要富集在生物过程(biological process,BP)和分子功能(molecular function,MF)中,相对而言,细胞组成(cellular component,CC)富集的转录本较少。而在BP中差异表达基因主要参与代谢过程、单生物代谢过程等,如参与代谢过程的显著差异表达基因中上调的有2 251个,下调的有1 516个,包括Cluster-40845.0、Cluster-11099.0等上调的基因和Cluster-68615.79372、Cluster-68615.87349等下调的基因。在MF中差异表达基因主要参与催化活性、氧化还原酶活性等, 如参与催化活性的显著差异表达基因中上调的有1 815个,下调的有1 327个,包括Cluster-68615.88556、Cluster-68615.88402等上调的基因和Cluster-68615.29401、Cluster-68615.62361等下调的基因。在CC中差异表达基因主要参与核糖体、核糖核蛋白复合物生成等,如参与核糖体的显著差异表达基因中上调的有222个,下调的有95个。值得关注的是,在富集的这些GO Terms中,几乎所有的上调差异基因数目都高于下调差异基因数目。
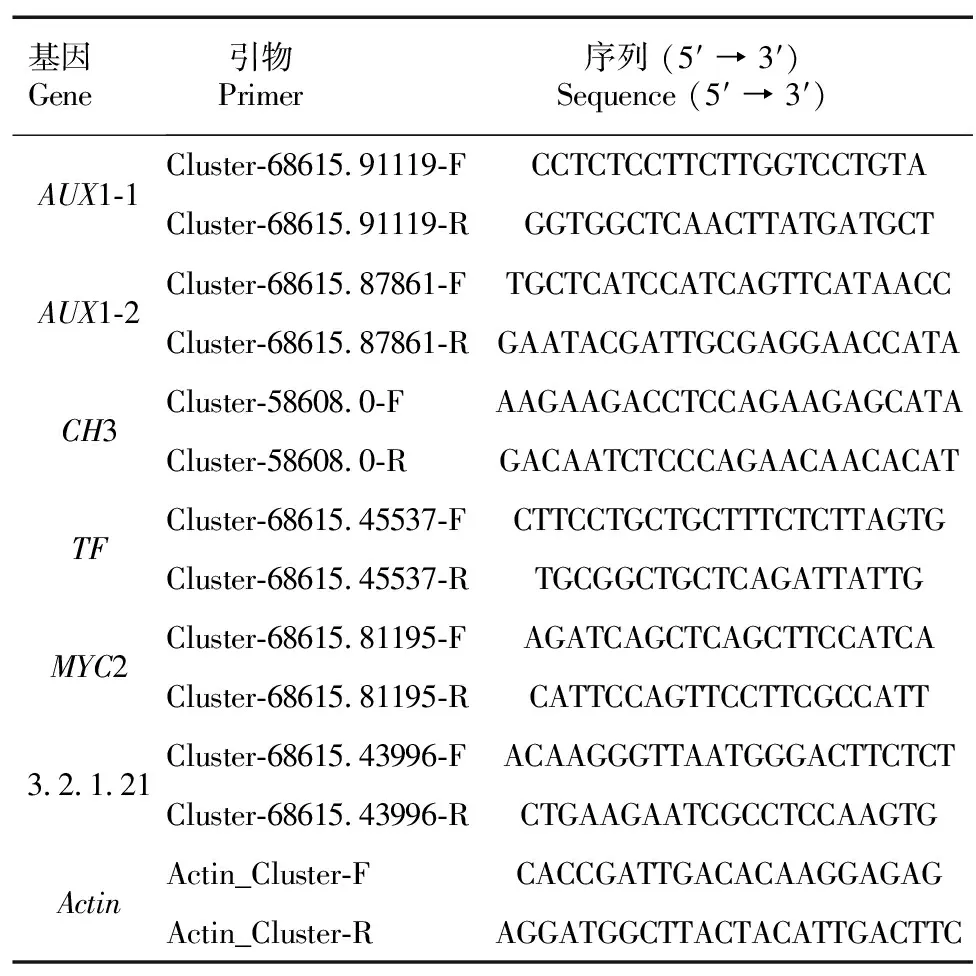
表 1 qRT-PCR引物序列Table 1 Primer sequences used in qRT-PCR
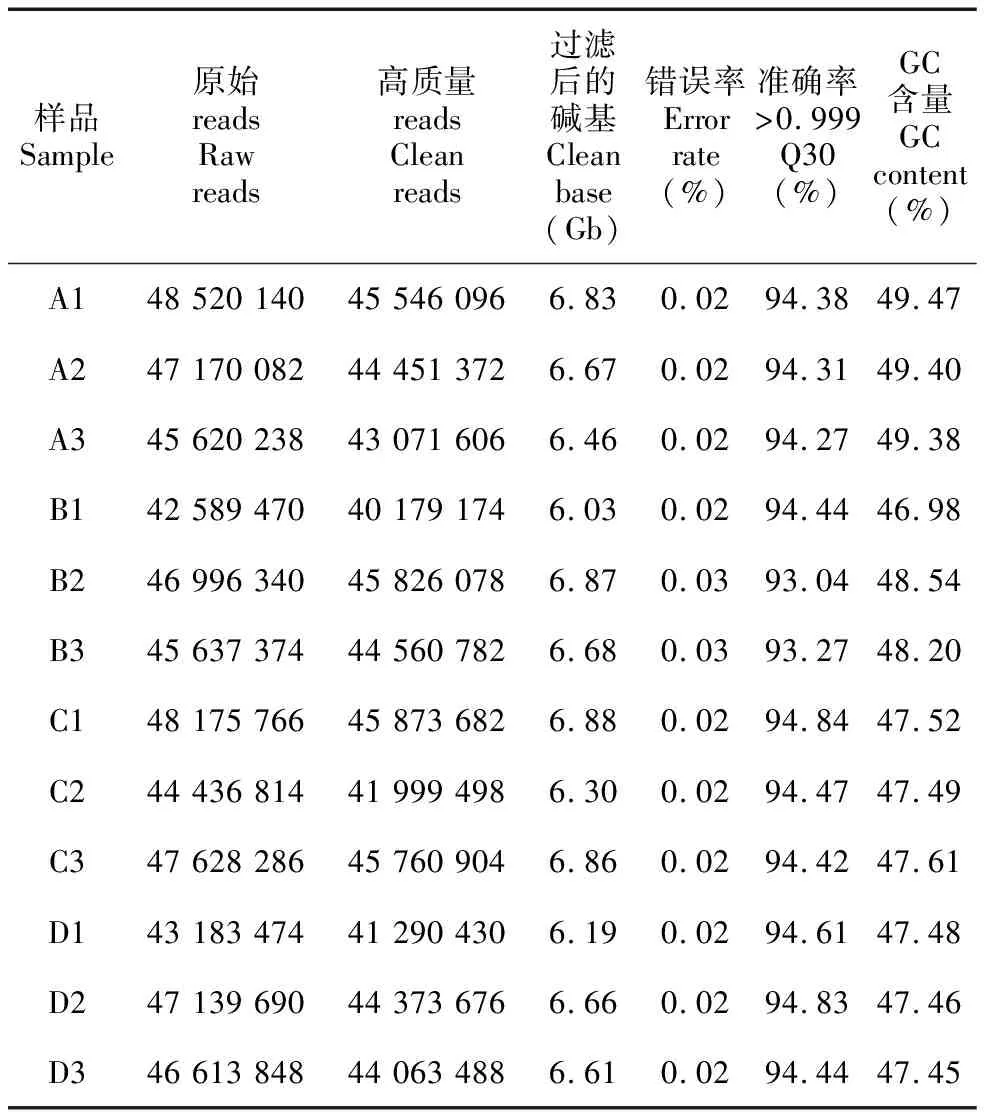
表 2 测序reads质量统计Table 2 Quality statistics of sequencing reads
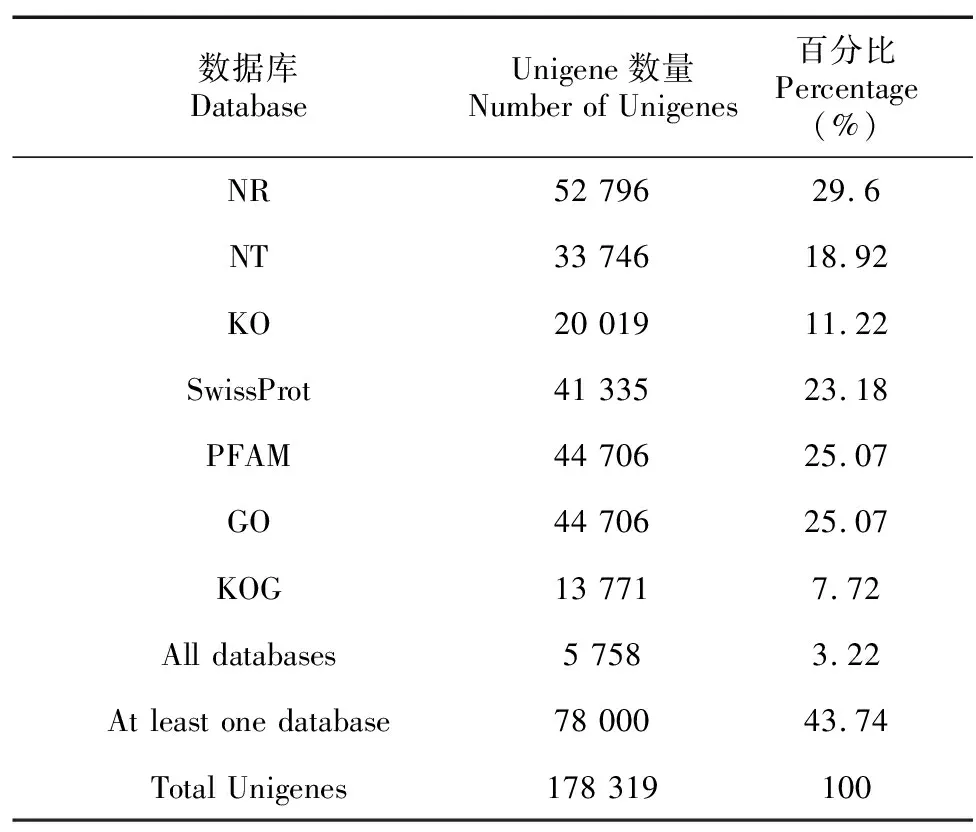
表 3 Unigenes注释率Table 3 Unigenes annotation rate
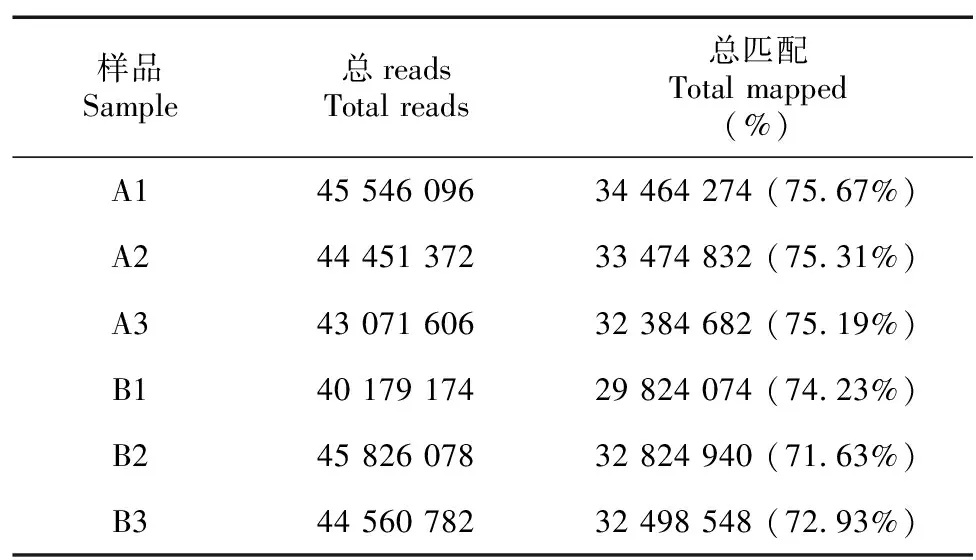
表 4 各样品reads 与组装转录本比对Table 4 Mapped results of sample reads and assembly transcripts
为了明确差异表达基因相互协调及其生物学功能, 通过KEGG pathway显著性富集确定差异表达基因参与的最主要生化代谢和信号转导途径,挑选富集最显著的20个pathway进行展示(图3)。差异表达基因主要富集于核糖体、植物激素信号转导、淀粉和蔗糖代谢、苯丙烷生物合成、脂肪酸生物合成和延伸、类黄酮生物合成、黄酮和黄酮醇的生物合成、花青素生物合成等通路中,显著性差异表达的基因分别富集到核糖体通路中307个、淀粉和蔗糖代谢通路中124个、植物激素信号转导通路中104个、类黄酮生物合成种37个、脂肪酸生物合成34个和延长34个,以及花青素生物合成中8个、黄酮和黄酮醇生物合成中5个。这些通路与种子萌发前后的生理变化和形态结构的形成有着紧密的关系。
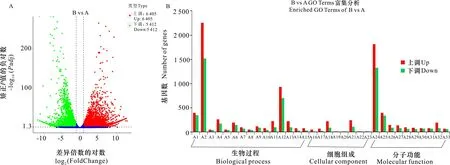
A1. 氧化还原过程; A2. 代谢过程; A3. 脂肪酸生物合成过程; A4. 碳水化合物代谢过程; A5. 脂肪酸代谢过程; A6. 脂质代谢过程; A7. 细胞碳水化合物代谢过程; A8. 一元羧酸生物合成过程; A9. 脂质生物合成过程; A10. 细胞多糖代谢过程; A11. 核糖体生成; A12. 单生物代谢过程; A13. 核糖核蛋白复合物生成; A14. 细胞葡聚糖代谢过程; A15. 葡聚糖代谢过程; A16. 细胞壁; A17. 外部封装结构; A18. 核糖体; A19. 质外体; A20. 脂肪酸合成酶复合物; A21. 核糖核蛋白复合物; A22. 脂质颗粒; A23. 单层包围的脂质储存体; A24. 催化活性; A25. 氧化还原酶活性; A26. 水解酶活性,作用于糖基键; A27. 水解酶活性,水解O-糖基化合物; A28. 四吡咯结合; A29. 血红素结合; A30. 铁离子结合; A31. 氧化还原酶活性,作用于配对供体,结合或减少分子氧; A32. 核糖体的结构成分; A33. 转移酶活性,转移除氨基酰基以外的酰基。A1. Oxidation-reduction process; A2. Metabolic process; A3. Fatty acid biosynthetic process; A4. Carbohydrate metabolic process; A5. Fatty acid metabolic process; A6. Lipid metabolic process; A7. Cellular carbohydrate metabolic process; A8. Monocarboxylic acid biosynthetic process; A9. Lipid biosynthetic process; A10. Cellular polysaccharide metabolic process; A11. Ribosome biogenesis; A12. Single-organism metabolic process; A13. Ribonucleoprotein complex biogenesis; A14. Cellular glucan metabolic process; A15. Glucan metabolic process; A16. Cell wall; A17. External encapsulating structure; A18. Ribosome; A19. Apoplast; A20. Fatty acid synthase complex; A21. Ribonucleoprotein complex; A22. Lipid particle; A23. Monolayer-surrounded lipid storage body; A24. Catalytic activity; A25. Oxidoreductase activity; A26. Hydrolase activity, acting on glycosyl bonds; A27. Hydrolase activity,hydrolyzing O-glycosyl compounds; A28. Tetrapyrrole binding; A29. Heme binding; A30. Iron ion binding; A31. Oxidoreductase activity, acting on paired donors,with incorporation or reduction of molecular oxygen; A32. Structuralconstituent of ribosome; A33. Transferase activity, transferring acyl groups other than amino-acyl groups.图 2 萌发前(A)与萌发后(B)的基因表达差异Fig. 2 Different expression genes before (A) and after (B) germination
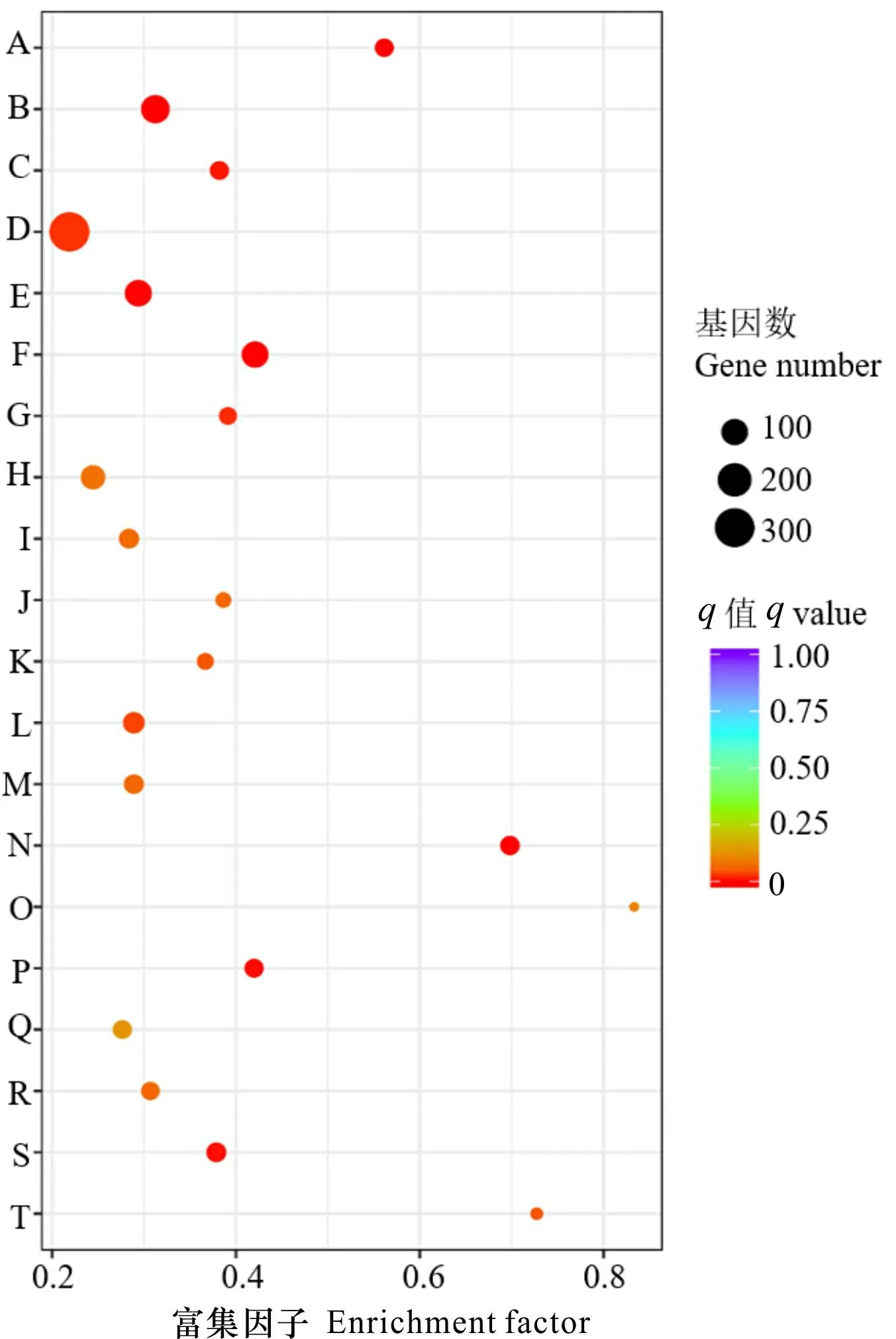
A. 芪类、二芳基庚烷和姜醇生物合成; B. 淀粉与蔗糖的代谢; C. 鞘脂代谢; D. 核糖体; E. 植物激素信号转导; F. 苯丙烷类生物合成; G. 苯丙氨酸代谢; H. 吞噬体; I. 戊糖和葡萄醛酸相互转化; J. 亚油酸代谢; K. 柠檬烯和蒎烯降解; L. 谷胱甘肽代谢; M. 半乳糖代谢; N. 类黄酮生物合成; O. 黄酮和黄酮醇的生物合成; P. 脂肪酸延长; Q. 脂肪酸合成; R. 氰基氨基酸代谢; S. 昼夜节律-植物; T. 花色素苷生物合成。A. Stilbenoid, diarylheptanoid and gingerol biosynthesis; B. Starch and sucrose metabolism; C. Sphingolipid metabolism; D. Ribosome; E. Plant hormone signal transduction; F. Phenylpropanoid biosynthesis; G. Phenylalanine metabolism; H. Phagosome; I. Pentose and glucuronate interconversions; J. Linoleic acid metabolism; K. Limonene and pinene degradation; L. Glutathione metabolism; M. Galactose metabolism; N. Flavonoid biosynthesis; O. Flavone and flavonol biosynthesis; P. Fatty acid elongation; Q. Fatty acid biosynthesis; R. Cyanoamino acid metabolism; S. Circadian rhythm-plant; T. Anthocyanin biosynthesis.图 3 差异基因KEGG通路富集Fig. 3 KEGG pathway enrichment of differential genes
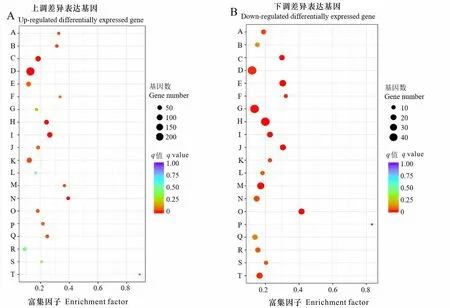
图A: A. 芪类、二芳基庚烷和姜醇生物合成; B. 甾体生物合成; C. 淀粉与蔗糖的代谢; D. 核糖体; E. 植物激素信号转导; F. 光合作用-天线蛋白; G. 光合作用; H. 苯丙烷类生物合成; I. 吞噬体; J. 戊糖和葡萄醛酸相互转化; K. 氧化磷酸化; L. 柠檬烯和蒎烯降解; M. 类黄酮生物合成; N. 脂肪酸延长; O. DNA复制; P. 氰基氨基酸代谢; Q. 昼夜节律-植物; R. 光合生物中的碳固定; S. 生物素代谢; T. 花色素苷生物合成。图B: A. 泛醌和其他萜类-醌的生物合成; B. 酪氨酸代谢; C. 芪类、二芳基庚烷和姜醇生物合成; D. 淀粉与蔗糖的代谢; E. 鞘脂代谢; F. 倍半萜和三萜生物合成; G. 植物激素信号转导; H. 苯丙烷类生物合成; I. 苯丙氨酸、酪氨酸和色氨酸生物合成; J. 苯丙氨酸代谢; K. 亚油酸代谢; L. 柠檬烯和蒎烯降解; M. 谷胱甘肽代谢; N. 半乳糖代谢; O. 类黄酮生物合成; P. 黄酮和黄酮醇的生物合成; Q. 脂肪酸合成; R. 昼夜节律-植物; S. 类胡萝卜素合成; T. α-亚油酸代谢。Fig. A: A. Stilbenoid, diarylheptanoid and gingerol biosynthesis; B. Steroid biosynthesis; C. Starch and sucrose metabolism; D. Ribosome; E. Plant hormone signal transduction; F. Photosynthesis-antenna proteins; G. Photosynthesis; H. Phenylpropanoid biosynthesis; I. Phagosome; J. Pentose and glucuronate interconversions; K. Oxidative phosphorylation; L. Limonene and pinene degradation; M. Flavonoid biosynthesis; N. Fatty acid elongation; O. DNA replication; P. Cyanoamino acid metabolism; Q. Circadian rhythm plant; R. Carbon fixation in photosynthetic organisms; S. Biotin metabolism; T. Anthocyanin biosynthesis. Fig. B: A. Ubiquinone and other terpenoid quinone biosynthesis; B. Tyrosine metabolism; C. Stilbenoid, diarylheptanoid and gingerol biosynthesis; D. Starch and sucrose metabolism; E. Sphingolipid metabolism; F. Sesquiterpenoid and triterpenoid biosynthesis; G. Plant hormone signal transduction; H. Phenylpropanoid biosynthesis; I. Phenylalanine, tyrosine and tryptophan biosynthesis; J. Phenylalanine metabolism; K. Linoleic acid metabolism; L. Limonene and pinene degradation; M. Glutathione metabolism; N. Galactose metabolism; O. Flavonoid biosynthesis; P. Flavone and flavonol biosynthesis; Q. Fatty acid biosynthesis; R. Circadian rhythm plant; S. Carotenoid biosynthesis; T. Alpha Linolenic acid metabolism.图 4 前20条差异基因KEGG通路富集Fig. 4 TOP 20 KEGG pathway enrichment of differential genes
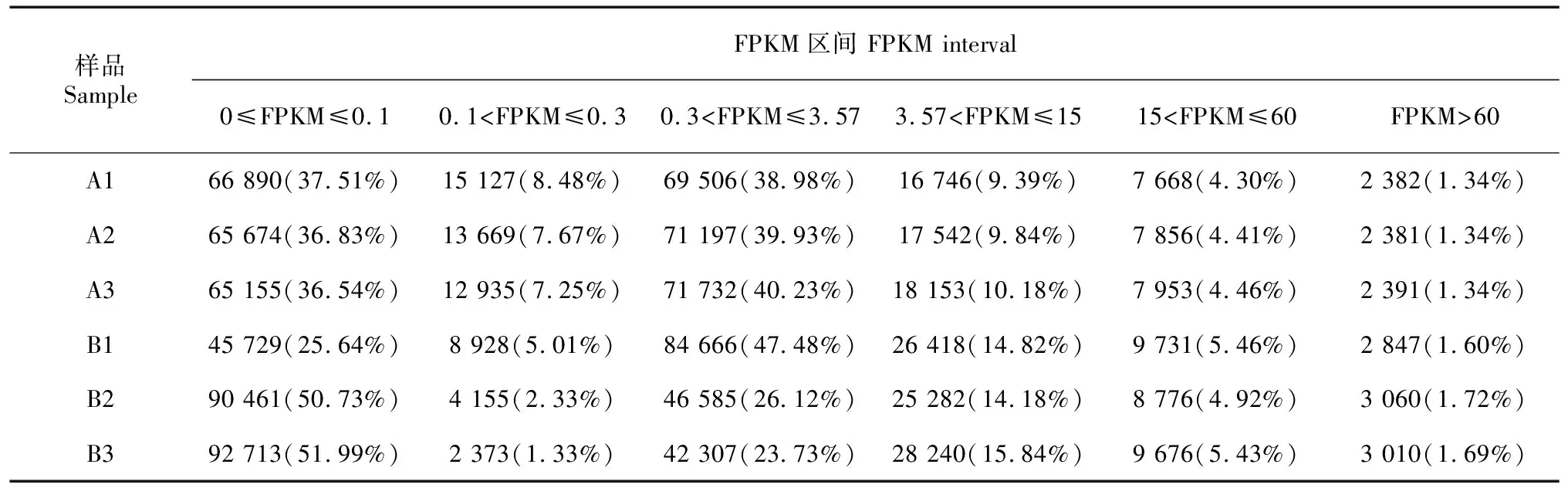
表 5 各样品表达水平FPKM区间数量统计Table 5 FPKM interval quantity statistics of sample expression levels
为了进一步解析差异基因参与的通路变化,将上调和下调的差异基因分别进行KEGG pathway富集,分别展示挑选富集的前20条通路(上调图4: A;下调图4: B)。在上调的显著性差异表达基因中,主要富集于核糖体(ribosome,231个)、吞噬体(phagosome,74个)、淀粉和蔗糖代谢(starch and sucrose metabolism,76个)、植物激素信号转导(plant hormone signal transduction,56个)、脂肪酸延伸(fatty acid elongation,24个)等通路中,其中富集到核糖体、淀粉和蔗糖代谢、脂肪酸伸长等通路中的差异表达基因数显著富集;而下调的差异表达基因主要富集在苯丙烷类生物合成(phenylpropanoid biosynthesis,48个)、植物激素信号转导(plant hormone signal transduction,48个)、淀粉和蔗糖代谢(starch and sucrose metabolism,48个)、类黄酮生物合成(flavonoid biosynthesis,22个)等通路中,并且植物激素信号转导、淀粉和蔗糖代谢等通路的差异表达基因显著富集。可见,参与植物激素信号转导、淀粉和蔗糖代谢等通路中的差异表达基因,无论是上调还是下调,均有较多的差异表达基因富集,这些基因可能与植物休眠、萌发等有着紧密的关系。
2.4 萌发前后激素信号转导通路差异表达基因
基于上述分析,参与植物激素和信号转导的基因在种子休眠与萌发过程中起着关键作用,为此将萌发前后显著的差异基因进一步匹配到植物激素信号通路中,差异富集及表达量见图5,结果表明富集于生长素通路中关键酶的Unigenes共有40个(27个上调,3个下调),主要编码的酶:生长素内向转运载体(auxin influx carrier,AUX1)、运输抑制响应蛋白1(transport inhibitor response 1,TIR1)、生长素响应蛋白/吲哚-3-乙酸(auxin-responsive protein /indole-3-acetic acid,AUX/IAA)、生长素响应因子(auxin response factor,ARF)、生长素响应酰胺合成酶(gretchen hagen 3,GH3)基因家族(auxin responsive GH3 gene family)、SAUR(small auxin up RNA)家族蛋白(SAUR family protein), 并且除SAUR之外,与萌发前相比,萌发后多数为上调,即萌发后表达量得到提高。而在油菜素内酯生物合成过程中,参与编码关键酶的Unigenes仅有6个,除编码油菜素内酯信号激酶(brassinosteroids-signaling kinase,BSK)的Unigenes外,编码其他关键基因油菜素内酯激酶受体抑制因子1(BRI1 kinase inhibitor 1,BRI1)、抗油菜素内酯1/2(brassinosteroid resistant 1/2, BZR1/2)、木葡聚糖[木葡糖基转移酶活性(Xyloglucan:xyloglucosyl transferase TCH4, TCH4)]、细胞周期素D3 (Cyclin D3, CYCD3) 的Unigenes均上调,即萌发后表达量得到提高。

图 5 萌发前后参与编码植物激素信号转导关键酶Unigenes表达水平Fig. 5 Expression levels of Unigenes encoding enzymes involved in plant hormone signal transduction before and after germination

图 6 萌发前后参与编码淀粉和糖代谢关键酶Unigenes表达水平Fig. 6 Expression levels of Unigenes encoding enzymes involved in starch and sucrose metabolism before and after germination
2.5 萌发前后淀粉和糖代谢通路差异表达基因
前述结果表明,淀粉和糖代谢在萌发前后发生急剧的变化,将萌发后较萌发前的所有显著差异基因匹配到淀粉和糖代谢(ko00500)通路中,获得差异基因编码的关键蛋白。由图6可知,蔗糖磷酸合酶(EC 2.4.1.14: sucrose-phosphate synthase)、海藻糖6-磷酸合酶(EC 2.4.1.15: trehalose 6-phosphate synthase)、1,4-α-葡聚糖分支酶(EC 2.4.1.18: 1,4-alpha-glucan branching enzyme)、海藻糖 6-磷酸酶(EC 3.1.3.12: trehalose 6-phosphate phosphatase)、β-淀粉酶(EC 3.2.1.2: beta-amylase)、果糖激酶(EC 2.7.1.4: fructokinase)、葡萄糖-6-磷酸异构酶(EC: 5.3.1.9: glucose-6-phosphate isomerase)等关键酶的Unigenes均下调,相反地,糖原磷酸化酶(EC 2.4.1.1: glycogen phosphorylase)、4-α-葡聚糖转移酶(EC 2.4.1.25: 4-alpha-glucanotransferase)、葡萄糖-1-磷酸腺苷酸转移酶(EC 2.7.7.27: glucose-1-phosphate adenylyltransferase)、内切葡聚糖酶(EC 3.2.1.4: endoglucanase)、胞外核苷酸焦磷酸酶/磷酸二酯酶家族成员(EC 3.1.4.1: ectonucleotide pyrophosphatase/phosphodiesterase family member)等关键酶的Unigenes均上调,而麦芽糖酶-葡糖淀粉酶(EC 3.2.1.20: maltase-glucoamylase)、β-葡萄糖苷酶(EC 3.2.1.21: beta-glucosidase)等酶的Unigenes既有上调也有下调。编码这些关键酶的Unigenes中上调的Unigenes与淀粉降解和种子萌发有关,而下调的Unigenes则与种子的休眠、物质的贮藏有关。
2.6 差异基因qRT-PCR分析
为了验证转录组获得的数据,于植物信号转导通路中,随机选择具有显著差异表达的6个基因,采用qRT-PCR进行分析,由图7可知,各样本的表达量与转录组表达的趋势基本一致。
3 讨论与结论
植物的种子萌发受自身激素和生理(He et al., 2022),以及环境中水分(Alquraan et al., 2022)、温度(Yang et al., 2022)等因素影响。黄精种子因果实的成熟度、着生部位不同,种子的含水率、可溶性糖、可溶性蛋白、淀粉种类、粗脂肪、超氧化物歧化酶等生理生化成分存在差异,从而导致种子的发芽率与发芽势不同(常晖等, 2022)。沙藏是打破种子休眠的常用方法之一,多花黄精种子经过约150 d沙藏后,种子的发芽率、发芽势得到显著提高(刘保财等, 2015)。
本研究对多花黄精种子经沙藏萌发前后差异表达基因进行GO富集分析,结果发现显著性差异基因主要参与代谢过程、催化活性、单生物代谢过程、氧化还原酶活性、核糖体等。Li等(2022)对多花黄精不同生长年限根茎进行转录组测序分析,差异基因的GO富集分析也主要参与催化活性、代谢过程等,这与本研究结果基本一致,也与罗丽娜和向增旭(2021)报道的黄精种子休眠解除的差异基因GO富集结果基本一致。
KEGG pathway显著性富集分析表明萌发后较萌发前的差异表达基因主要富集于核糖体、植物激素信号转导、淀粉和蔗糖代谢等通路中,上调的差异基因主要富集在核糖体(231个)、吞噬体(74个)、淀粉和蔗糖代谢(76个)、植物激素信号转导(56个)等通路中;下调的差异基因主要富集在苯丙烷生物合成(48个)、植物激素信号转导(48个)、淀粉和蔗糖代谢(48个)等通路中,而富集到淀粉和蔗糖代谢、植物激素信号转导等通路中的差异基因,无论是上调还是下调,均有较多的差异表达基因参与,与前人报道结果基本一致(张红瑞等, 2021)。因此,这两条通路可作为种子萌发前后的特征性通路。KEGG pathway富集到植物激素通路的基因有354个,萌发前后有显著差异表达的基因有104个,其中上调的有56个和下调的48个,尤其是富集于生长素通路中关键酶的基因有40个(27个上调,3个下调),这与报道多花黄精种子萌发过程中IAA、ABA、GA3和TZR含量存在变化结果一致(陈怡等, 2020; 张武君等,2022),即种子沙藏过程中,许多基因参与了植物激素的代谢与转导,特别是编码生长素类通路上关键酶的基因。值得引起关注的是油菜素内酯在种子萌发过程中作用,虽然参与编码关键酶的Unigenes仅有6个,但萌发后,基本上都是表达上调。富集到淀粉和蔗糖的代谢通路的基因有397个,萌发前后有显著差异表达的基因有124个,其中上调的有76个,下调的有48个,编码蔗糖磷酸合酶、海藻糖6-磷酸合酶等基因表达量下调,而编码磷酸化酶、4-α-葡聚糖转移酶等基因的表达量上调,这与报道的多花黄精种子中含有淀粉、直链淀粉、支链淀粉、可溶性糖等结果一致(王晶晶等, 2022),即种子在沙藏过程中,淀粉的种类、糖的形态逐步由萌发前的贮藏形式变为水解形式,增加这些物质的水溶性,以满足种子萌发的生理需要。可见,编码植物激素信号转导、淀粉和蔗糖代谢植物激素通路上的基因,可作为种子萌发前后的主要特征性基因。此外,有部分差异基因参与了脂肪酸延伸、脂肪酸生物合成途径,这与报道的多花黄精种子内分布脂肪油一致(祝明珠等, 2020)。而本研究中与光合相关通路的差异基因均出现下调,与报道的光照对多花黄精种子萌发未有显著影响结果基本一致(周新华等, 2016)。有8个差异显著表达的基因参与了花青素通路,是否与多花黄精植株茎秆颜色有绿色和紫色有关(姜武等, 2021),有待进一步研究。
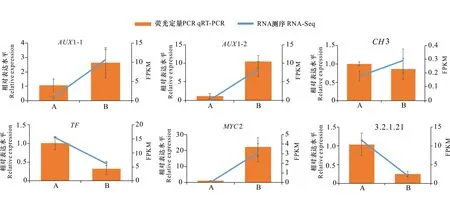
A. 萌发前; B. 萌发后。A. Before germination; B. After germination.图 7 萌发前后6个差异基因的qRT-PCR验证Fig. 7 Verification of six selected differentially expressed genes by qRT-PCR before and after germination
综上所述,多花黄精种子经沙藏萌发后发生了系列的生理与形态结构变化,本研究初步分析了种子萌发前后关键基因的变化,明确了植物激素信号转导与淀粉和蔗糖代谢在多花黄精种子萌发前后起着关键作用,进一步阐明了植物激素信号转导与淀粉和蔗糖代谢通路的关键基因,可作为多花黄精种子的萌发特征,为多花黄精种子的生理、育苗等深入研究提供参考。

