UPLC-MS法测定磷酸西格列汀中的2种磷酸酯杂质的含量
朱红茹,王广祁,2*,王健,3,王芳,姜斌
(1.通化东宝药业股份有限公司,吉林 通化 134123;2.沈阳药科大学 生命科学与生物制药学院,辽宁 沈阳 110016;3.沈阳药科大学 制药工程学院,辽宁 沈阳 110016;4.山东汇智药物研究有限公司,山东 济南 250101)
药品在生产的过程中,由于工艺条件、环境温度、生产设备的多种影响,往往可能产生杂质,杂质的存在对患者更是“有害无益”。其中具有潜在致癌性的杂质,又被称为“基因毒性杂质”,由于其对患者本身的安全的重大影响,目前日益成为药学质量研究与控制的重点。
磷酸西格列汀是一种新型的降血糖药物,其原研为美国默沙东公司。该产品自2006年于美国上市以来,由于其疗效显著、不良反应少等诸多优点,迅速替代了原有的口服降糖药,根据2020年默沙东公司财报显示,该产品全球销售额已达33.06亿美元,是目前全球销量最高的口服降糖药。
在磷酸西格列汀原料药生产过程中常常会用到有机溶剂甲醇及异丙醇,磷酸在加热条件下可能与上述两种醇发生酯化反应得到磷酸三甲酯(TMP)和磷酸三异丙基酯(TIP),而上述两种物质均存在典型的遗传毒性致癌性物质的警示结构[1]:烷基或苯基磷酸酯化学基团。磷酸西格列汀需患者长期服药,且每天的推荐剂量为100 mg,因此,若TMP和TIP存在于磷酸西格列汀中,必将对产品质量及患者的身体安全造成极大的影响。
目前,国内外的药典及科研文献对于上述两种基因毒性杂质均缺乏相关的报道,本研究拟开发一种全新的UPLC-MS法(超高效液相色谱法串联质谱法),用于对磷酸西格列汀中的TMP和TIP进行检测,对其进行了方法开发及方法学验证。
1 仪器与材料
超高效液相色谱仪,配有自动进样器和柱温箱,美国Waters;QDa质谱检测器[电喷雾离子源(ESI),美国 Waters;QUINTIX125D-1CN型电子天平,德国Sartorius;KQ600DE型超声波清洗机,昆山舒美超声仪器有限公司。
磷酸三甲酯(TMP),相对分子质量140.07,批号K1915060,CAS 512-56-1,纯度为99.317%,上海阿拉丁生化科技股份有限公司;磷酸三异丙基酯(TIP),相对分子质量224.23,批号BCCB9469,CAS 513-02-0,纯度为96.1%,西格玛奥德里奇(上海)贸易有限公司;磷酸西格列汀,批号160501,通化东宝药业股份有限公司;乙腈,色谱纯,美国ASTOON;甲酸,色谱纯,天津市科密欧化学试剂有限公司;纯净水,杭州娃哈哈股份有限公司。
2 方法与结果
2.1 仪器条件
色谱检测条件:Waters Acquity UPLC BEH C18色谱柱,流动相A为0.01%甲酸水溶液,流动相B为乙腈,梯度洗脱见表1。流速为0.4 mL·min-1,进样量为5 μL。
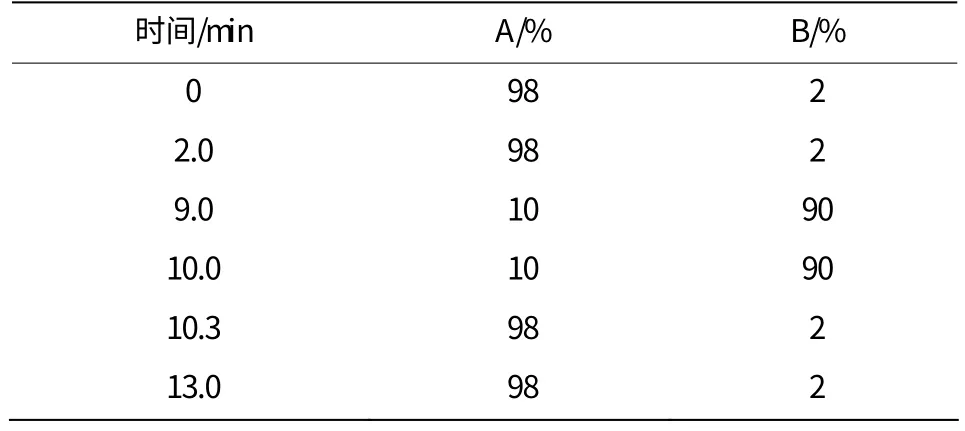
表1 梯度洗脱程序
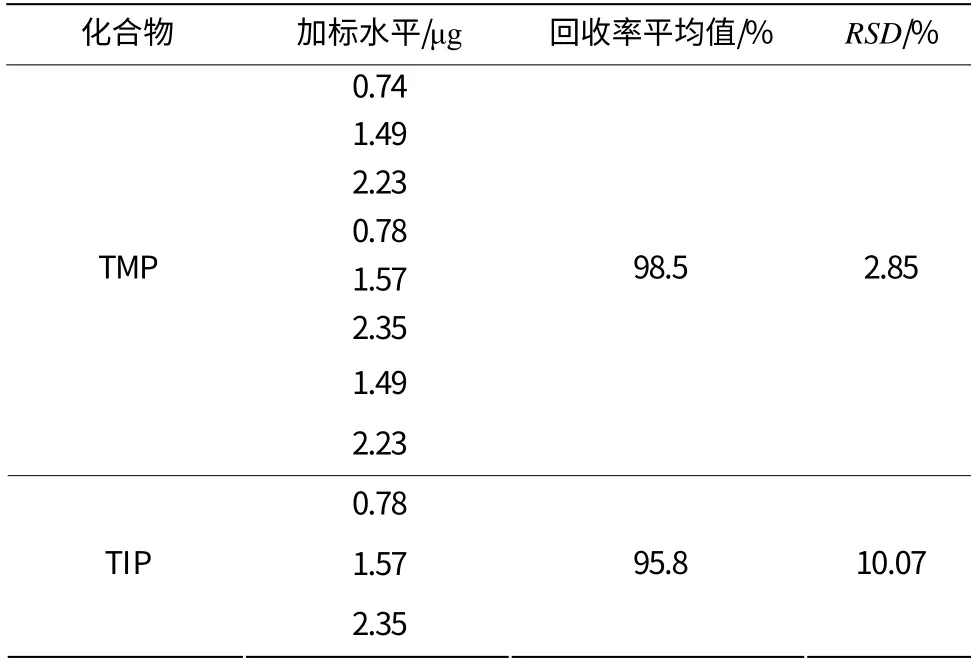
表2 回收率试验结果
质谱检测条件:电喷雾离子源正离子(ESI+),锥孔电压23 V。TMP和TIP采用SIR模式检测,TMP质荷比为m/z=141.07,TIP质荷比为m/z=225.23,保留时间分别为2.104 min 和6.490 min。
2.2 对照品溶液的配制
精密称取TMP和TIP对照品各适量,用乙腈溶解并稀释制成0.15 mg·mL-1的TMP贮备液和TIP贮备液;再精密移取TMP、TIP贮备液各适量,用0.01%甲酸-乙腈(98∶2)稀释制成0.15 μg·mL-1的混合对照品溶液。
2.3 供试品溶液的配制
精密称取磷酸西格列汀(批号160501)适量,用0.01%甲酸-乙腈(98∶2)溶解并稀释至制成10 mg·mL-1的溶液,摇匀,即得供试品溶液。
2.4 专属性
TMP系统适应性色谱图如图1所示,TIP系统适应性色谱图如图2所示。空白溶剂及样品均对TMP和TIP检测无干扰。

图1 TMP系统适应性色谱图
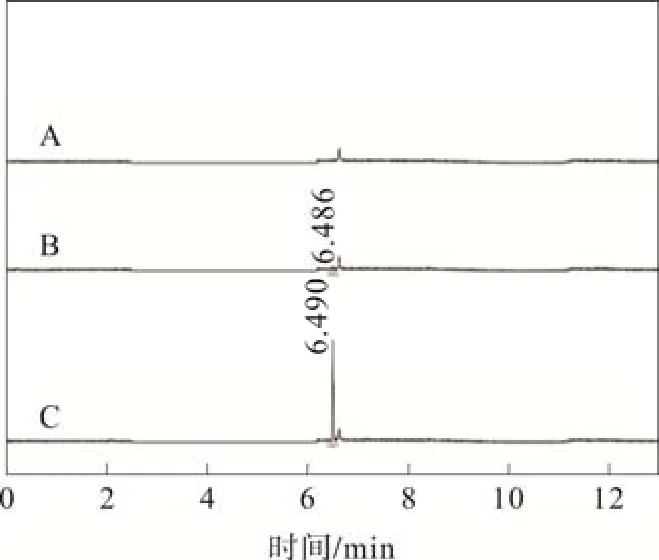
图2 TIP系统适应性色谱图
2.5 线性
本研究采用外标法,分别配制质量浓度在0.030~0.300 μg·mL-1之间的两种磷酸酯混合标准溶液,以质量浓度为横坐标,峰面积为纵坐标,按最小二乘法进行线性回归,计算得到回归方程。
TMP线性方程为y=8 810 489.24x-3 025.62,相关系数r为0.999;TIP线性方程为y=931 789.107 0x+509.33,相关系数r为0.997。结果表明TMP和TIP均在0.030~0.300 μg·mL-1范围内呈现良好的线性关系。
2.6 仪器精密度
取“2.2”项下混合对照品溶液,重复进样6针,计算结果。TMP和TIP保留时间RSD均小于1.0%,峰面积RSD值分别为2.84%、2.53%,证明采用液相质谱法进行检测,其仪器精密度良好。
2.7 定量限及检测限
取混合对照品溶液稀释至相应的质量浓度,根据信噪比10∶1为定量限,信噪比3∶1为检测限,TMP定量限为0.015 μg·mL-1,TIP定量限为0.031 μg·mL-1,均未大于限度质量浓度的五分之一;TMP检测限为0.007 4 μg·mL-1,TIP检测限为0.007 8 μg·mL-1,均小于限度质量浓度的十分之一,保证了样品在微量检测的定量与定性灵敏度。
2.8 回收率
精密称取TMP和TIP配制成高中低3个质量浓度的回收率溶液,每个质量浓度平行配制3份,按外标法计算TMP和TIP的平均回收率及相对标准偏差(RSD),结果详见表3。TMP的回收率为98.5%,RSD值为2.85%;TIP的回收率为95.8%,RSD值为10.07%。本方法具有良好的准确性。
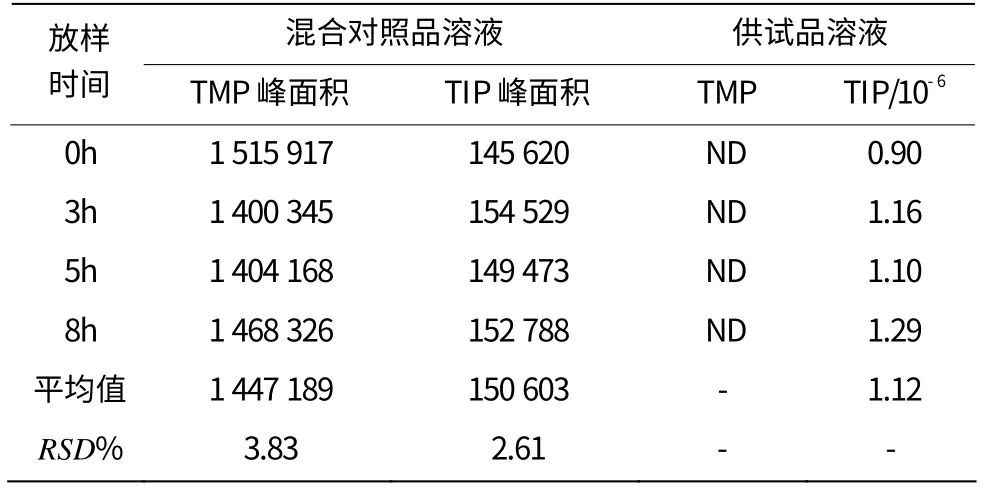
表3 稳定性试验结果
2.9 稳定性
取混合对照品溶液以及供试品溶液,分别于0、3、5、8 h进样,计算结果详见表3。室温放置8 h,混合对照品溶液中TMP和TIP峰面积RSD值均小于5.0%,供试品溶液中均未检出TMP,检出TIP数量微小且基本保持一致,溶液在8 h内稳定。
2.10 重复性
取同一批次磷酸西格列汀(批号160501),重复配制6份供试品溶液,进样测定,结果详见表4。
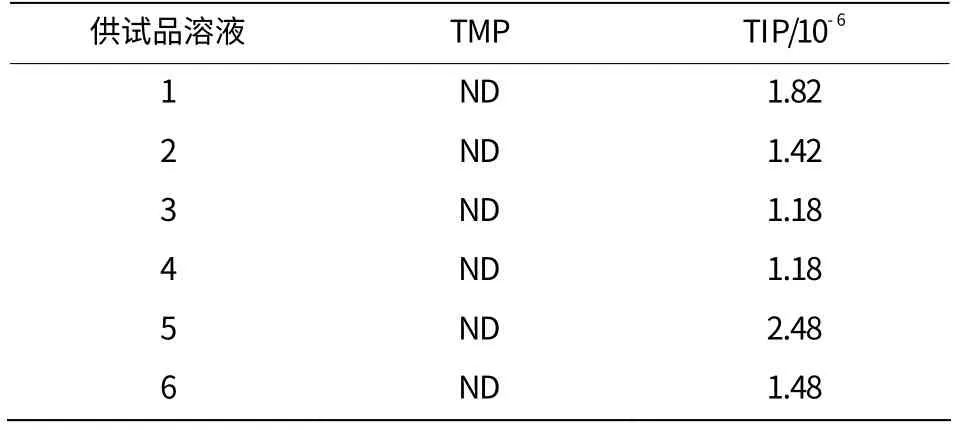
表4 重复性试验结果
由表4可以看出,6份供试品溶液均未检出TMP,检出微量TIP,含量基本一致,重复性良好。
3 讨论
3.1 基因毒性杂质的限度
根据国际人用药品注册技术协调会(ICH)颁布的指导原则《ICH guideline M7》所述,应根据毒理学关注阈值(TTC)确定基因毒性杂质的限度[2],本研究拟采用指导原则中所规定的最低杂质限度,即每天1.5 μg进行控制,折算出磷酸西格列汀中TMP和TIP的控制限度应为0.001 5%,此时患者一生(70岁)的致癌风险约增加十万分之一,被认为是患癌风险的微小增加,在统计学上可被接受。
3.2 方法的制定
目前对于有机磷酸酯的杂质检测方法有一些报道,其中包括气相色谱法[3-4]、气相色谱-质谱法[5-6]、以及液相色谱-质谱联用法[7-8]。但上述方法存在响应值低、抗干扰弱[9]、运行时间较长等问题。在实际的方法开发过程中,也针对两者的沸点(TMP沸点为197 ℃,TIP沸点为224 ℃)用气相色谱法进行了预实验,但此方法有杂质峰干扰、响应值较低的缺点,很难满足微量检测的要求。而UPLC作为新一代的色谱技术,较一般的HPLC有着运行时间短、操作简单、绿色环保等优点,MS较之其他检测器有着抗干扰能力强、灵敏度高等优点,将上述两种方法串联,作为磷酸西格列汀中测定磷酸酯杂质的方法,也为药品中基因毒性杂质的研究提供了一个新思路。
3.3 超高效液相色谱条件的优化
通常,对于[M+H]+正离子在酸性条件下响应值可提高,本实验采用ESI+模式[10],分别用甲醇-0.2%甲酸水溶液、甲醇-0.01%甲酸水溶液、乙腈-0.01%甲酸水溶液作为流动相,对TMP和TIP的分离效果及检测情况进行比较。结果表明,高浓度的甲酸对目标物的响应值并未有明显提高,且甲醇-0.01%甲酸水溶液作为流动相时目标峰TIP的质谱响应虽更好,但受到空白溶剂峰的干扰,因此,选择乙腈-0.01%甲酸水溶液作为流动相。
3.4 质谱条件的优化
TMP、TIP相对分子质量分别为140.07、224.23。采用Scan模式,对TMP、TIP进行m/z=50~600扫描。在线监测图谱,初步确定TMP质荷比为158.22(加NH4+);TIP质荷比为247.17(加Na+);采用SIR模式,TMP在m/z=158.22无法确定出峰位置,TIP在m/z=247.17受空白溶剂干扰。
在SIR模式下,调整质荷比为m/z=141.07(加H+)、m/z=225.23(加H+),TMP、TIP保留时间分别为2.104 min和6.490 min,峰形良好且不受空白溶剂干扰。确定质荷比后在30 V锥孔电压条件下,进行回收率考察,由于此条件下TIP响应较小,回收率RSD值偏大,调整锥孔电压提高TIP响应值,最终确定锥孔电压为23 V。
由UPLC色谱图确定主峰保留时间为5.6 min,为避免主峰浓度过大污染质谱仪,采用转化阀切断2.5~6.2 min信号。
3.5 耐用性
当柱温为38~42℃,流速为0.38~0.42 mL·min-1,TMP和TIP峰形均无明显变化。磷酸西格列汀样品中均为检出TMP,检出TIP含量与正常条件含量检测结果差异不大,说明此方法耐用性良好。
4 结 论
本文建立的UPLC-MS法对磷酸西格列汀中2种磷酸酯杂质的含量检测方法严格按照国内方法学验证法规要求进行,该方法具有良好的专属性、准确性、耐用性等,可用于磷酸西格列汀中TMP和TIP的定量分析,为磷酸西格列汀的质量研究提供了重要的研究基础。

