荧光偏振适配体传感器检测粮食小分子危害物的进展研究
李殿昊 朱 萍 王梦媛 关桦楠 叶 华
(江苏科技大学粮食学院,江苏镇江 212100)
粮食质量安全一直是社会关注的热点,其中小分子危害物引发的粮食安全问题不容小觑,近年来食品安全监测发现的问题都离不开小分子危害物。如:2021 年12 月,深圳市市场监督管理局抽样发现“盐津铺子”黑糖话梅中铅含量超标、陈克明家用小麦粉中脱氧雪腐镰刀菌烯醇含量超标;2022 年4月,陕西省市场监督管理局通告称杨凌居江大润商贸有限公司销售的白花生米中黄曲霉毒素B1 含量超标;等等。小分子危害物含量超标给粮食安全和群众健康带来了巨大威胁,加强粮食及其加工产品中小分子危害物快速检测意义重大。
一些传统的检测方法如薄层层析法(thin layer chromatography,TLC)[1]、高效液相色谱法(high performance liquid chromatography,HPLC)[2]、高效液相色谱-质谱法等仪器法及酶联免疫吸附法(enzyme-linked immunosorbent assay,ELISA)[3-5]已广泛应用于粮食小分子危害物检测。这些检测方法灵敏度高,但设备昂贵、技术要求高、操作繁琐、检测耗时长,难以实现快速检测[6,7]。小分子危害物由于分子量小,结构简单,通常只有免疫反应而没有免疫原性,所以并不是每种小分子都能制备抗体[8]。因此,开发新型识别分子探针,可弥补抗体检测方面的不足。
核酸适配体(aptamer)是利用指数富集配体系统进化技术(systematic evolution of ligands by exponential enrichment)筛选获得的一段单链DNA或RNA 功能核酸序列,其具有制备周期短、无需动物实验、亲和力高、特异性强等优点,能特异性识别各种靶标[9,10]。作为一种新型分子识别探针在小分子检测方面得到了广泛的应用,先后建立了基于适配体技术的比色法[11]、荧光法[12]、荧光偏振法[13]、电化学法[14]等多种检测方法。其中荧光偏振法是一种操作简单且无需分离、灵敏度高的均相检测方法,和仪器法、免疫分析法相比具有明显的优势,起初主要应用于分子量大的靶标检测,而小分子物质由于分子量小,难以引起明显的荧光偏振信号变化,而且检测限也比较低[15]。为此,人们研究各种策略来弥补这种方法的不足,已成功将荧光偏振技术应用于小分子目标物的检测。文中介绍了荧光偏振技术原理,从直接检测法和信号放大竞争检测法两个方面总结了其在粮食小分子危害物检测应用进展情况,并对未来发展方向进行了展望。
1 荧光偏振技术原理
光波可以在光的任一平面上发生均匀地振动,当光通过某一平面时,光的振动平面就发生了改变,导致某个方向的振动强于或弱于其他平面,这样产生的光即偏振光。荧光偏振是由荧光分子与偏振光相结合的一种技术,由Perrin 在20 世纪20 年代首次提出。他研究时发现,当溶液中的荧光分子受到偏振光激发时,荧光分子可产生相应的偏振荧光。如果激发时,荧光分子处于静止状态,则该荧光分子仍保持原有激发光的偏振性质;如果荧光分子处于运动状态,即分子不断发生翻转或旋转,这时候产生的偏振荧光与原有激发光可能不在同一个偏振平面,就产生了不同的偏振性质[16]。因此,可以通过测量不同方向上的偏振荧光强度来表达荧光偏振的大小[17]。在实际检测中,荧光偏振强度可用式(1)进行定义。
式中IV和IH式分别表示荧光分子被偏振光激发后,在垂直和水平方向上的偏振强度。一般来说,荧光偏振强度与分子大小、分子旋转或翻转速度、温度、溶液黏度等因素有关。荧光偏振强度与各因素之间的关系可用式(2)表示[18]。
式中P 表示荧光偏振强度,P0表示极限荧光偏振强度,和气体常数R 一样通常是一个常数,T 是绝对温度,V 是摩尔分子体积,t 代表荧光寿命,h 是溶液黏度。
从式(2)可以看出,当溶液体系一定时,即溶液黏度不变,在一定温度下,荧光偏振强度主要取决于荧光分子的体积,分子体积越大,旋转速率越慢,荧光偏振强度P 值越大;反之,荧光偏振强度越小。因此,可以利用这一原理对目标物进行定量分析。由于荧光偏振强度是是一个比值,不受样品颜色等因素影响[19,20],且无需分离步骤,操作简单,可实现均相快速检测,大大提高了检测效率,已广泛应用于生物医药、食品安全检测等领域[21]。
2 荧光偏振适配体生物传感器在粮食小分子危害物检测方面的应用
2.1 直接检测法
直接检测法是利用标记荧光分子的适配体与小分子待测危害物结合后引起构象改变,从而产生一定的荧光偏振信号变化,这种检测方法无须引入其他信号放大因子。如ZHAO 等[22]研究发现,四甲基罗丹明(TMR)荧光基团标记在适配体不同位置会引起不同的荧光偏振信号变化,推测这可能是由于靶结合诱导适配体构象发生改变以及TMR 与碱基之间的分子内相互作用导致的。因此利用TMR 标记的适配体开发了赭曲霉毒素A(Ochratoxin A,OTA)小分子危害物的荧光偏振直接检测法。SUN 等[23]则通过标记位点优化最终确定了TMR 标记在第26 个碱基T 位置上时,检测时荧光偏振信号响应明显。他们基于此现象构建了T26 标记TMR 荧光基团成功实现了黄曲霉毒素B1(Aflatoxin B1,AFB1)的荧光偏振直接检测法,结果显示,其最低检测限可达2 nM(约0.6 ng/mL)。YU 等[24]利用同样的原理成功构建了Cd2+的荧光偏振直接检测方法,其最低检测限可达6.1 nM。这种直接检测法需要优化设计荧光基团标记位置,前期成本相对较高,尽管优化位点后能产生一定的信号变化,但是检测限不高,且该方法受靶标和适配体结合构象变化的影响,并不一定能适应于所有待检测靶标,因此在实际应用中具有一定的局限性。
2.2 信号放大竞争检测法
实际上,基于适配体识别的荧光偏振技术检测真菌毒素多采用信号放大竞争策略,即引入纳米材料[25]、蛋白质[26]、酶[27]、核酸[28]等作为质量放大因子进行荧光信号放大,从而实现小分子目标物的快速检测。
2.2.1 纳米材料信号放大技术
在荧光偏振适配体传感器中,纳米材料如纳米金(AuNPs)、纳米银(AgNPs)、氧化石墨烯纳米片(Graphene oxide nanosheets,GOs)等常作为质量放大因子提高荧光偏振信号强度[29]。 如SAMOKHVALOV 等[30]引入纳米金作为载体和质量放大因子,将其修饰链霉亲和素后与生物素标记的赭曲霉毒素A(OTA)适配体通过共价键相结合,利用荧光标记的OTA 分子构建了一种竞争型的荧光偏振适配体生物传感器,并应用于白酒中的OTA 检测,其检测限低至2.3 mg/kg,是没有引入AuNPs 作为信号放大因子时的25 倍,且检测时间仅需15 min,其检测原理如图1(A)所示;JIANG 等[31]则利用纳米银(AgNPs)作为质量放大因子,构建了Hg2+的荧光偏振适配体生物传感器,研究结果表明,该信号放大型生物传感器在10 nM~0.4 mM 浓度范围内具有良好的线性关系,检测限低至6.6 nM。
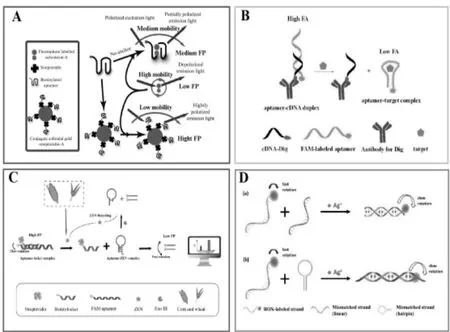
图1 基于不同策略放大信号实现荧光偏振检测小分子靶标原理图
除纳米金、纳米银外,氧化石墨烯纳米片由于具有吸附单链和质量放大双重作用,也常作为纳米材料增强荧光偏振信号。YE 等[32]引入氧化石墨烯作为质量放大因子构建了一种基于适配体的荧光偏振方法快速检测AFB1。他们利用GO 吸附荧光标记的AFB1适配体形成大分子的GO/aptamer 复合物,从而分子旋转速度变慢,产生较大的荧光偏振信号,但目标物AFB1出现时,由于适配体的高亲和性和特异性,将适配体从GO 表面解离下来形成AFB1/aptamer 复合物,分子质量变小,分子旋转速度变快,从而使得荧光偏振值降低。根据荧光偏振信号前后变化实现了大米中AFB1检测。实验优化结果表明,其在0.05~5 nM 浓度范围内具有良好的线性关系,其检测限达0.05 nM。近年来,纳米材料被广泛应用于分析检测之中,其分子质量远大于适配体或真菌毒素,同时由于具有较大的比表面积、热稳定性等特点和优势,是质量放大策略的首选放大因子。
2.2.2 蛋白质辅助信号放大技术
蛋白质的分子量或体积相对于适配体较大,也可以起到荧光偏振信号放大作用。链霉亲和素是一种四聚体蛋白,分子量约为66 KDa,常被用来做荧光偏振辅助放大因子[34,35]。如SAMOKHVALO 等[36]基于链霉亲和素和生物素标记的IgG 单克隆抗体作为荧光偏振信号放大因子,开发了一种基于适配体识别的荧光偏振方法检测OTA。研究结果表明,在链霉亲和素和IgG 的双重增强作用下,可以在15 min内实现葡萄酒中OTA 纳米级的检测,检测限可达3.6 nM。
链霉亲和素本身不仅可以作为分子质量放大作用,还可以利用生物素亲和素共价作用连接更大的分子进行质量放大作用实现荧光偏振信号的变化[37]。LI 等[38]则利用抗体偶联适配体互补链作为质量放大因子构建了AFB1的荧光偏振检测方法。当连接有抗体的互补链与适配体结合后,形成的复合物分子量增大,分子转动速度变慢,导致荧光偏振强度增大。但AFB1出现后与适配体竞争结合形成适配体/靶标复合物,分子量降低,分子转动速度加快,荧光偏振信号降低,检测其最低检测限可达25 pM,其原理图见图1(B)。
尽管蛋白质质量放大策略可以提高荧光偏振检测的灵敏度,但与纳米材料相比,蛋白质对热不稳定,在荧光偏振测定中具有可变性,并且需要在与生物分子的性质和稳定性相匹配的实验条件下才能实现检测。
2.2.3 酶辅助信号放大技术
基于酶辅助的荧光偏振信号放大技术在小分子目标物检测中也具有较好的应用[39,40]。核酸外切酶(Exo III)是一种能沿3'→5'方向催化DNA 外切而产生5'-磷酸单核苷酸的酶[27]。MA 等[41]利用Exo III这一特点,在链霉亲和素作为荧光偏振信号放大因子的基础上,在19 bp 长荧光标记的玉米赤霉烯酮(Zearalenone,ZEN)适配体3'端设计了生物素标记的locker 序列,构建了酶辅助荧光偏振信号放大技术实现了ZEN 的快速、灵敏检测。结果表明在0.01~100 ng/mL 范围内具有良好的线性关系,检测限低至0.004 ng/mL,图1(C)是其检测原理图。在这项研究中,Exo III 被用于催化降解探针分子进行不断循环,从而显著提高荧光偏振变化强度。虽然酶可以实现荧光偏振信号的放大,但由于酶受温度和pH 影响较大,容易变性,在复杂的生物样品检测中难以控制操作[42],限制了该方法的扩大应用。
2.2.4 核酸辅助信号放大技术
而核酸尤其是DNA 性质相对较稳定,近年来常被应用开发荧光偏振信号放大检测技术,常见的有核酸杂交互补链以及PCR 扩增等技术等[43]。如HONG 等[44]在荧光标记的单链DNA 上设计了线性和发夹型两种互补杂交链,形成C-Ag+-C 结构,从而产生荧光偏振信号的明显变化,基于此原理可以实现Ag+的检测(图1(D))。MA 等[45]以适配体为模板,设计了荧光标记的正向引物和生物素修饰的反向引物,利用PCR 扩增以及生物素-链霉亲和素共价作用系统增加适配体模板的分子量,通过双重信号放大作用增强荧光偏振信号,建立了一种新型的荧光偏振适配体生物传感器,实现了氯霉素的高灵敏检测。研究结果表明,在0.001~200 nM 浓度范围内具有良好的线性关系,其检测限可低至皮摩尔级,达到0.5 pM。蜂蜜样品加标回收实验结果也显示了该方法具有较好的回收率和实际样品检测能力。
3 结论与展望
基于适配体的荧光偏振检测技术利用了适配体和荧光偏振两个方面的优势。利用荧光偏振技术检测粮食小分子危害物也是一项挑战,学者们通过设计荧光基团在适配体不同位置上标记产生荧光偏振信号响应进行直接检测,以及通过质量放大作用进行竞争检测,均取得了一定的成果。
在粮食小分子危害物的荧光偏振检测方法,今后可在以下方面加强。
(1)设计性能更好的适配体识别分子,提高适配体与靶标的亲和性和特异性。
(2)基于蛋白质、酶等不稳定特点,纳米材料可能是质量放大策略首选考虑因素,因此需要开发更多的、性能更稳定、操作更方便的纳米材料,从而提高荧光偏振信号的变化强度,以适应不同体系的粮食小分子危害物检测。
(3)利用荧光偏振无需分离、快速检测的特点,开发便携式荧光偏振生物传感设备或系统,以适应于现场检查需要,提升粮食中小分子危害物快速检测水平。

