压差预冷对西兰花贮藏品质的影响
王佳捷,孙颖,刘雅慈,黄春莲,吴焰,郭宏鑫,陈存坤,曾凯芳,3,姚世响,3*
1(西南大学 食品科学学院,重庆,400715)2(天津市农业科学院农产品保鲜与加工技术研究所,农业农村部农产品贮藏保鲜重点实验室,天津市农产品采后生理与贮藏保鲜重点实验室,天津,300384)3(川渝共建特色食品重庆市重点实验室,重庆,400715)
采后快速预冷是果蔬物流保鲜的关键环节,受国家战略高度重视。近年中央一号文件强调生鲜农产品冷链物流工程建设,从“最先一公里”产地到“最后一公里”餐桌,构建完善的冷链物流体系,覆盖农产品的采收、加工、包装、贮藏、运输、销售等各个环节,以降低农产品贮运损失,保障农产品质量安全,促进现代农业高质量发展[1]。从冷链流通环节来看,预冷是第一步,也是最关键的工序。预冷可以通过快速去除采后果蔬附带的田间热,降低果蔬的呼吸速率、抑制微生物的繁殖、延缓果蔬采后的衰老,从而达到保持果蔬采后品质的目的。
近30年来,我国高山蔬菜种植规模不断扩大,种植面积约280万hm2,年产量达9 002万t[2],是南方山地农业重点发展的产业。但同时,高山蔬菜产业存在的“重采前、轻采后”的现象,严重制约了高山蔬菜产业的高质量发展。西兰花(BrassicaoleraceaL.var.italica),别名绿花菜,十字花科芸薹属甘蓝变种,是我国高山蔬菜主栽种类之一。目前,我国西兰花总种植面积约10万hm2,年产量约150万t[3]。预冷是果蔬(西兰花)采后重要保鲜方式,主要包括真空预冷、水预冷和压差预冷等[4]。真空预冷和水预冷对西兰花保鲜效果已得到众多学者的研究:真空预冷可以通过维持西兰花贮藏期间的可溶性蛋白质、维生素C以及糖类等营养成分的含量来维持西兰花的品质[5];而水预冷则可以有效抑制西兰花的黄化,维持西兰花良好的感官品质[6],压差预冷作为一种快速经济的预冷方式,其对于西兰花保鲜的研究目前还比较匮乏。除此之外,由于我国预冷技术的起步较晚、压差预冷设备研发成本较高、国内压差冷库设施建设不完善,因此压差预冷目前在各种果蔬保鲜中的应用并没有被完全普及[7]。
本研究针对西兰花压差预冷条件及压差预冷对西兰花贮藏品质的影响,分别通过测定花柄温度、西兰花贮藏品质及抗氧化能力的相关指标等,开展压差预冷条件探索及压差预冷对西兰花品质具体影响的实验。
1 材料与方法
1.1 材料与试剂
西兰花,采摘于高山蔬菜基地后立刻运送回实验室。从中选取采收及时、成熟度及大小基本一致、花球紧实、无机械伤、无病虫害的新鲜西兰花作为本试验材料。塑料箱,490 mm×350 mm×275 mm,重庆北碚天生农贸市场;PE保鲜膜,厚0.03 mm,658 mm×598 mm,国家农产品保鲜工程技术研究中心(天津)赠送。
本实验化学试剂均为分析纯,国产。
1.2 仪器与设备
果蔬压差预冷设备,本课题组自主研发[8];ZDR-U2 W-T2温度记录仪,杭州泽大仪器有限公司;HLD-30002电子天平,杭州友恒称重设备有限公司;TG16.5高速离心机,上海卢湘仪离心机仪器有限公司;JT-1数字手持折光仪,日本ATAGO公司;GS-15果蔬质地分析仪,北京阳光亿事达科技有限公司;CR-400色差仪,日本KONICA MINOLTA公司;DDS-307A电导率仪,上海仪电科学仪器股份有限公司;Synergy H1微孔板酶标仪,美国伯腾仪器有限公司;UV2355紫外可见分光光度计,尤尼柯(上海)仪器有限公司。
1.3 实验方法
1.3.1 压差预冷处理方法
移动式果蔬压差预冷设备有2种送风速度与2种送风温度,使用温度记录仪监测分别以高风速7.4 m/s预冷和低风速3.7 m/s(风温均为0 ℃)预冷过程中西兰花花柄温度的变化情况,每5 min测定1次,计算平均值和标准差,分别绘制预冷曲线;使用温度记录仪监测以0 ℃风温预冷和以4 ℃风温预冷(风速均为7.4 m/s)过程中西兰花花柄温度的变化情况,每5 min测定1次,计算平均值和标准差,分别绘制预冷曲线。
将需要压差预冷处理的西兰花随机分组,每组60棵,进行压差预冷时,为保证西兰花受冷均匀,将西兰花进行装箱并堆放整齐。将西兰花装入规格为490 mm×350 mm×275 mm的塑料箱内,每箱8~10棵。塑料箱两侧开孔,纵向排列,中央留出回风通道,顶端盖上塑料布,不进行内包装,使冷空气能够直接接触西兰花。在西兰花柄心位置处插入感温探头,将初始花柄温度为25 ℃的西兰花置于不同预冷条件下进行预冷,当西兰花花柄温度降至4 ℃时结束预冷。
通过绘制预冷过程中西兰花的温度曲线,探究不同压差预冷条件对西兰花降温时间和冷却均匀性的影响。其中,冷却均匀性以标准差作为衡量依据,标准差越小,表明西兰花花柄温度离散程度越小,即冷却均匀性越好。
1.3.2 压差预冷处理对西兰花采后品质及活性氧代谢的影响
将西兰花分为4组,分别为:第1组:预冷+低温组;第2组:不预冷+低温组;第3组:预冷+常温组;第4组:不预冷+常温组。每组西兰花个数为60棵。预冷处理结束后,分别将4组西兰花放置在4 ℃的低温冷库与25 ℃的常温库中进行贮藏,每天进行观察,并将其中腐烂的西兰花挑出以防发生更大规模的腐烂,连续5 d取样以进行失重率、腐烂率、色差值、叶绿素含量、硬度、可溶性固形物、相对电导率、丙二醛含量、过氧化物酶活性、抗坏血酸过氧化物酶活性与超氧化物歧化酶活性等反映西兰花贮藏品质与活性氧代谢的相关指标测定。
1.3.3 失重率的测定
采用称重法[9],称质量前擦干西兰花表面水分。失重率计算如公式(1)所示:

(1)
式中:m贮藏前,西兰花放入冷库/常温库前的质量;m贮藏后,西兰花放入冷库/常温库后的质量。
1.3.4 腐烂率的测定
采用统计法[10],以单个西兰花作为一个计数单位。腐烂率计算如公式(2)所示:

(2)
1.3.5 色差值的测定
采用色差仪进行测定[9]。取西兰花花球的十字顶点和中心点进行测定,结果取平均值。a*值的正负分别表示红绿,b*值的正负分别表示黄蓝,以-a/b值反映花球的绿度。
1.3.6 叶绿素含量的测定
参考国崇文等[9]的方法并稍作修改。约称取混匀切碎的西兰花样品2.0 g,加入无水乙醇研磨浸提后定容至25 mL,在波长652 nm下测定吸光度。总叶绿素含量计算如公式(3)所示:
ρ/(mg/L)=A652×1 000/34.5
叶绿素含量/(mg/g)=ρ×V/(m×1 000)
(3)
式中:V,提取液总体积,mL;m,样品质量,g。
1.3.7 硬度的测定
参考国崇文等[9]的方法并稍作修改。将西兰花花球下1~5 cm处的花茎切成厚度为1 cm的待测样品。采用果蔬质地分析仪进行测定,探头直径5 mm,测试速度10 mm/s,测试距离1.0 mm,使探头触碰位置在样品中心,结果以kg表示。
1.3.8 可溶性固形物含量的测定
参考李丹等[11]的方法并稍作修改。取适量西兰花研磨匀浆,用手持数字折光仪测定其百分含量,结果以%表示。
1.3.9 相对电导率的测定
参考曹建康等[12]的方法并稍作修改。使用打孔器在西兰花花茎横截面处截取圆片,在烧杯中约称取1.0 g西兰花样品圆片,加入100 mL超纯水浸泡1 h后测定电导率c1;然后覆盖保鲜膜进行沸水浴15 min,冷却至室温后测定电导率c0,相对电导率计算如公式(4)所示:
相对电导率cε/%=c1/c0×100
(4)
1.3.10 丙二醛(malondialdehyde, MDA)含量的测定
参考曹建康等[12]的方法并稍作修改。约称取混匀切碎的西兰花样品1.0 g,加入5 mL三氯乙酸溶液在冰浴下研磨,离心后取2 mL上清液加入2 mL硫代巴比妥酸溶液混合,沸水浴20 min,冷却至室温后分别在波长450、532、600 nm下测定吸光度。MDA含量计算如公式(5)所示:
C/(μmol/L)=6.45×(OD532-OD600)-0.56×OD450
丙二醛含量/(μmol/g)=C×V/(Vs×m×1 000)
(5)
式中:V,提取液总体积,mL;Vs,测定时所取提取液体积,mL;m,样品质量,g。
1.3.11 超氧化物歧化酶(superoxide dismutase, SOD)活性的测定
参考曹建康等[12]的方法并稍作修改。约称取1.0 g西兰花样品,在液氮中研磨匀浆后,加入3 mL 0.1 mol/L pH 7.8的磷酸缓冲液(含5 mmol/L二硫苏糖醇和50 g/L聚乙烯吡咯烷酮)后在4 ℃离心后,上清液即为粗酶提取液。在试管中分别加入1.7 mL 50 mmol/L pH 7.8的磷酸缓冲液,0.3 mL 0.13 mol/L的L-蛋氨酸溶液,0.3 mL 750 μmol/L的氮蓝四唑溶液,0.3 mL 100 μmol/L的乙二胺四乙酸二钠溶液,0.1 mL粗酶提取液,最后加入0.3 mL 20 μmol/L的核黄素溶液,在日光灯下启动反应,对照管以蒸馏水为参比,一支放在暗处,一支放在日光灯下,反应15 min后,置于黑暗处终止反应,于560 nm处测定溶液吸光值。将每分钟每克西兰花样品体系对氮蓝四唑光化还原的抑制为50%定义为1个超氧化物歧化酶活性单位(U)。
1.3.12 抗坏血酸过氧化酶(ascorbate peroxidase, APX)活性的测定
参考曹建康等[12]的方法并稍作修改。称取约1.0 g西兰花样品,在液氮中研磨匀浆后,加入3 mL 0.1 mol/L pH 7.5的磷酸钾缓冲液(含1 mmol/L 抗坏血酸和0.1 mmol/L 乙二胺四乙酸和20 g/L交联聚乙烯吡咯烷酮)后在4 ℃离心后,上清液即为粗酶提取液。在试管中分别加入2.6 mL 50 mmol/L pH 7.5的磷酸钾缓冲液(含0.1 mmol/L 乙二胺四乙酸和0.5 mmol/L 抗坏血酸),0.1 mL粗酶提取液,最后加入0.3 mL 2 mmol/L H2O2溶液启动反应,以蒸馏水为参比,每隔30 s在290 nm处测定溶液的吸光值,连续测定至少6次。将单位质量西兰花样品在每分钟内的吸光值变化定义为1个酶活力单位,表示为ΔOD290/(min·g)。
1.3.13 过氧化物酶(peroxidase, PRX)活性的测定
参考ZHOU等[13]的方法并稍作修改。约称取1.0 g西兰花样品,液氮研磨匀浆后,加入3 mL 0.1 mol/L pH 5.5的乙酸-乙酸钠缓冲液(含1 mmol/L 聚乙二醇6000,40 g/L交联聚乙烯吡咯烷酮和10 g/L曲拉通)后4 ℃离心,上清液即为粗酶提取液。在试管中加入3.0 mL 25 mmol/L愈创木酚溶液、0.5 mL粗酶提取液,最后加入0.2 mL 0.5 mol/L H2O2溶液启动反应,以蒸馏水为参比,每隔15 s在470 nm处测定溶液吸光值,连续测定至少3 min。将单位质量西兰花样品在每分钟内的吸光值变化定义为1个酶活力单位,表示为ΔOD470/(min·g)。
1.4 数据分析及处理
所有实验数据均使用Graphpad Prism 9.0进行处理并作图,结果用平均值±标准方差表示,每个实验至少进行3次重复;其中P<0.05为存在显著性差异。
2 结果与分析
2.1 不同压差预冷处理对西兰花预冷效果的影响
2.1.1 不同送风速度对西兰花预冷效果的影响
如图1所示,不同送风速度预冷过程中,2组西兰花花柄温度均逐渐降低,降温速度均先加快后减慢,温度均匀性均先减弱后增强,结果表明,低风速组预冷用时较长,在105 min达到预冷终点(耗电3.40 kW·h);高风速组预冷用时较短,在80 min时达到预冷终点(耗电3.15 kW·h),比低风速组用时缩短23.8%左右,同时低风速预冷组温度均匀性较差。
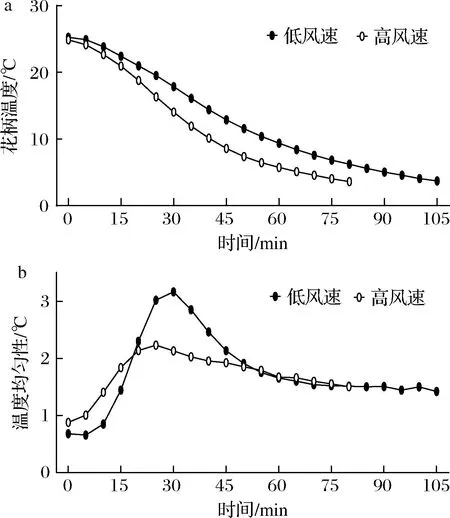
a-花柄温度;b-温度均匀性
2.1.2 不同送风温度对西兰花预冷效果的影响
如图2所示,不同送风温度预冷过程中,2组西兰花花柄温度均逐渐降低,且在预冷处理35 min前,2组西兰花花柄温度基本相同,在35 min后,4 ℃风温处理组降温速度明显变慢,在145 min达到预冷终点(耗电3.55 kW·h),而0 ℃风温处理组仅用80 min即达到预冷终点(耗电3.15 kW·h),但4 ℃风温处理组预冷均匀性好于0 ℃风温处理组。
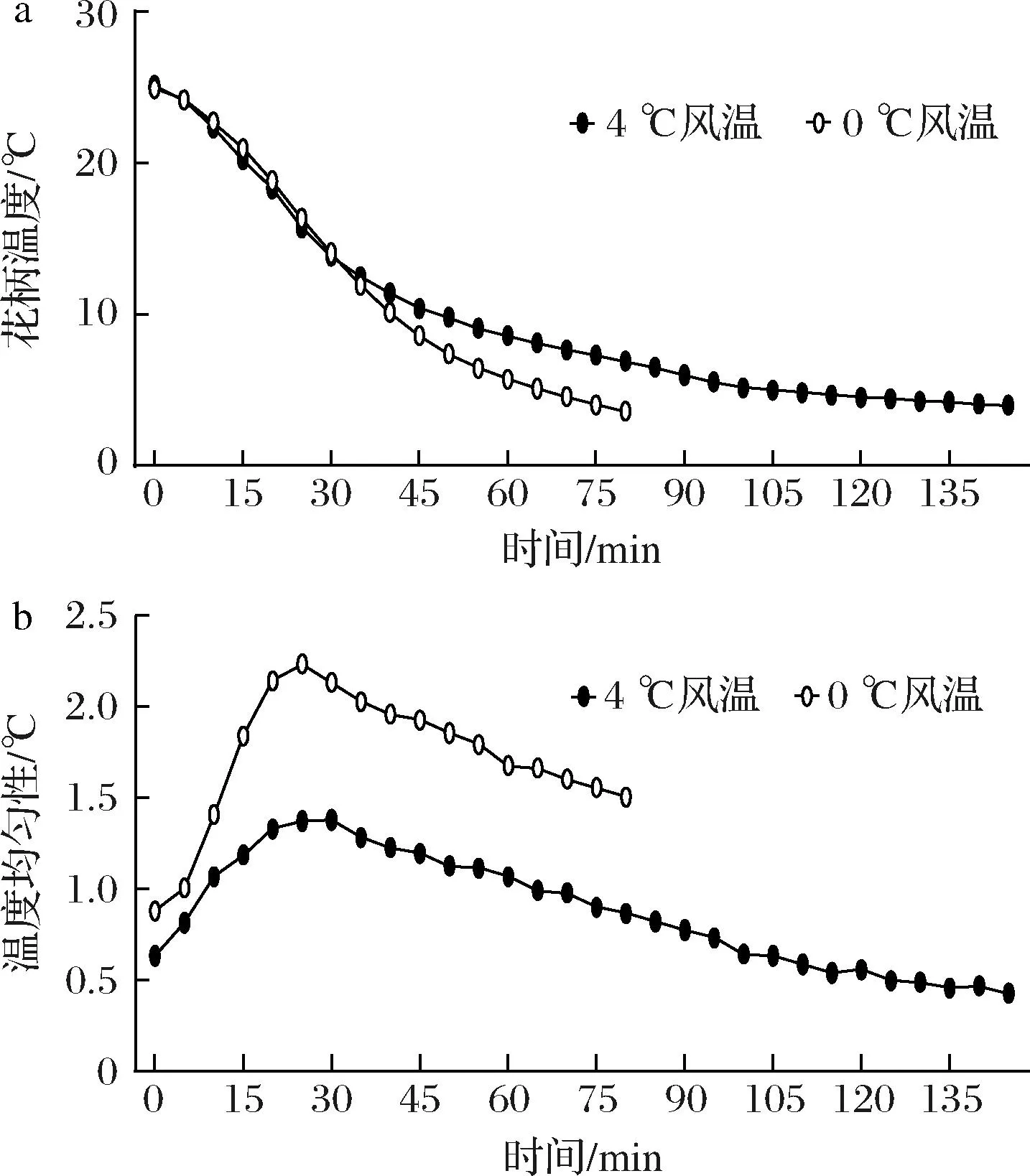
a-花柄温度;b-温度均匀性
综上,高风速与低风温预冷处理可以在缩短预冷时间的同时,一定程度上节约电能。
2.2 压差预冷对西兰花贮藏品质的影响
2.2.1 压差预冷对西兰花贮藏期间表型的影响
如图3所示,预冷+低温组在第5天仍可以保持西兰花花球紧实,颜色呈绿色;不预冷+低温组则在第3、4天出现了黄化,在第5天花球明显松散,且有部分发生褐变;预冷+常温组则在第3天出现了黄化,在第5天花球几乎全部黄化,且有比较严重的褐变;不预冷+常温组在第1天就出现了黄化与花球的松散,在第5天时花球发生大面积的褐变。实验表明,在不同温度贮藏条件下,预冷可以维持西兰花贮藏期间的表型,延缓褐变的发生。

图3 压差预冷处理对西兰花贮藏期间表型的影响
2.2.2 压差预冷对西兰花贮藏期间失重率与腐烂率的影响
失重率和腐烂率可以反映西兰花品质劣变的程度。西兰花失重的主要原因有水分流失、花球掉粒、有机物的消耗等;而西兰花腐烂的主要病理表现有花球长霉、花茎软腐等,在腐烂发生后,西兰花的商品价值会迅速丧失,导致出现恶臭气味,不堪食用。
如图4所示,在西兰花贮藏期间,各组西兰花的失重率和腐烂率均随贮藏时间的延长而上升。贮藏第5天时,不预冷+低温组失重率为2.71%,预冷+低温组失重率仅为1.96%;而不预冷+常温组失重率为6.04%,预冷+常温组失重率仅为4.73%。同时,在不同温度贮藏条件下,低温贮藏与常温贮藏的2个不预冷组的腐烂率分别为6.67%与78.3%,而低温贮藏与常温贮藏的2个压差预冷组的腐烂率为3.33%与56.7%。实验结果表明,在不同温度贮藏条件下,压差预冷均能够有效减少西兰花的质量损失,抑制西兰花腐烂的发生。

a-失重率;b-腐烂率
2.2.3 压差预冷对西兰花贮藏期间色差值与叶绿素含量的影响
色差值和叶绿素含量的变化可以反映西兰花颜色转变的程度,而叶绿素含量的下降则是西兰花褪绿转黄的主要原因。正常的西兰花花球为深绿色,-a/b值应为正值,腐烂后西兰花会发生黄化,导致-a/b变为负值。
如图5所示,在西兰花贮藏期间,-a/b值与叶绿素含量的变化趋势大致相同,均随贮藏时间延长,-a/b值与叶绿素含量降低。其中,预冷+低温组的-a/b值与叶绿素含量变化不明显;不预冷+常温组-a/b值急剧减小,在贮藏第4天时变为负值,表明在贮藏后期,西兰花发生严重的黄化。同时,在贮藏第5天,预冷+低温组西兰花叶绿素含量最高,为1.66 mg/g,不预冷+常温组西兰花叶绿素含量最低,为0.46 mg/g。通过计算发现,2个压差预冷处理组分别比2个对照组叶绿素含量高0.21和0.20 mg/g。实验结果表明,压差预冷处理能够抑制西兰花叶绿素降解,抑制西兰花在贮藏期间的黄化,而压差预冷协同低温贮藏则表现出更强的护绿效果。
2.2.4 压差预冷对西兰花贮藏期间硬度与可溶性固形物的影响
硬度可以反映西兰花质地结构的变化情况,是反映西兰花新鲜程度的重要指标,西兰花发生腐烂后会导致硬度下降,而木质化、纤维化则会导致硬度上升。如图6所示,在西兰花贮藏期间,各组西兰花的硬度总体呈先下降后上升的趋势。贮藏前2 d,压差预冷组硬度均显著高于不预冷组。贮藏第2天时,预冷+常温组与不预冷+常温组的西兰花硬度均达到最小值,分别为0.383、0.382 kg,之后硬度开始上升。贮藏后第4、5天,不预冷+低温组、预冷+常温组与不预冷+常温组硬度均有所上升,只有预冷+低温组硬度持续下降。在贮藏第2天到第5天,压差预冷组与不预冷组硬度均不存在显著差异(P>0.05);低温贮藏条件下,贮藏第2天,压差预冷组硬度显著高于不预冷组硬度,说明压差预冷可以显著延缓西兰花的软化(P<0.05),实验结果表明,压差预冷可以延缓西兰花质地的劣变。
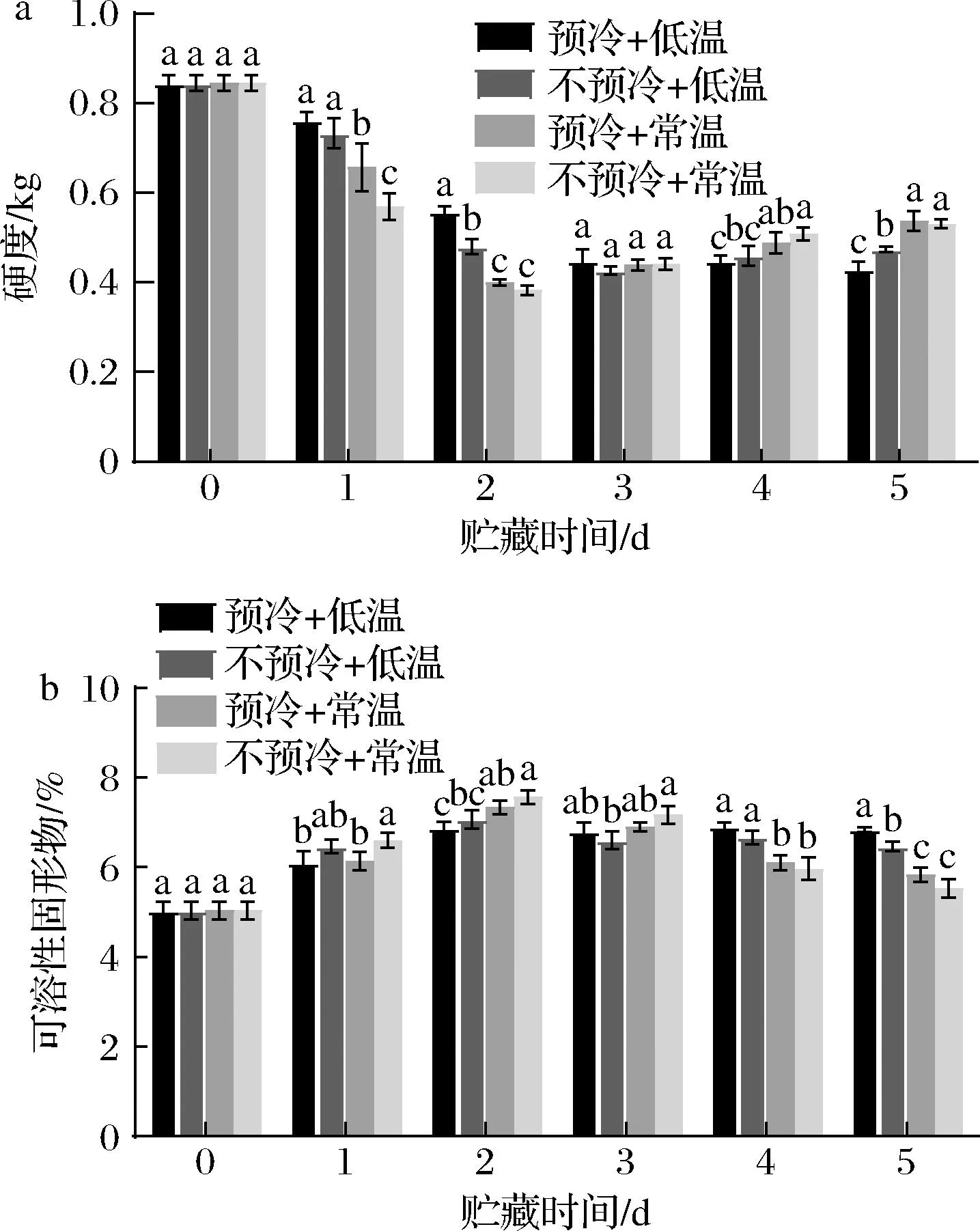
a-硬度;b-可溶性固形物
可溶性固形物是指果汁中能溶于水的糖、酸、维生素、矿物质等,是反映果蔬内营养物质含量的重要指标。如图6所示,贮藏期间,各组西兰花的可溶性固形物含量总体呈先上升后下降的趋势。数据显示,各组可溶性固形物均于贮藏第2天达到最大值。第2天后可溶性固形物含量开始逐渐下降,在贮藏第5天时,不预冷+低温组可溶性固形物含量显著高于不预冷+常温组西兰花(P<0.05),而预冷+低温组西兰花可溶性固形物含量为6.83%,显著高于(P<0.05)不预冷+低温组6.47%。结果表明,压差预冷协同低温贮藏可以显著减少西兰花贮藏期间可溶性固形物含量的下降,减少营养成分的损失。
2.2.5 压差预冷对西兰花贮藏期间氧化损伤的影响
MDA是植物细胞膜质过氧化的产物之一[14],其含量可以反应细胞膜质过氧化的程度。如图7所示,贮藏期间,各组MDA含量均呈现随贮藏时间延长含量上升的趋势,并且在贮藏第1天直到贮藏第5天,预冷+低温组与预冷+常温组MDA含量分别显著低于(P<0.05)不预冷+低温组与不预冷+常温组。除此之外,数据表明,预冷与低温贮藏可以使得西兰花MDA含量在贮藏期间始终保持在较低水平,在贮藏第5天,预冷+低温组MDA含量仅为1.16 μmol/g,显著低于(P<0.05)不预冷+低温组的3.07 μmol/g。实验结果表明,压差预冷可以有效降低贮藏期间MDA的含量,减缓由于膜质过氧化给西兰花组织细胞带来的损伤。

a-相对电导率;b-丙二醛含量
相对电导率的大小可以反映果蔬组织细胞内电解质的渗漏情况,是衡量细胞膜受损程度的指标之一,果蔬组织的细胞膜组织受损后,会导致细胞膜内的电解质出现外渗的现象,导致相对电导率上升。如图7所示,贮藏期间,各组西兰花的相对电导率均呈随贮藏时间延长,相对电导率上升的趋势。贮藏第4天时,预冷+低温组与预冷+常温组的相对电导率分别显著低于(P<0.05)不预冷+低温组与不预冷+常温组,比同期对照组的相对电导率低5.62%和6.50%。贮藏第5天时,预冷+低温组相对电导率仅为39.36%,显著低于预冷+常温组与不预冷+常温组(P<0.05),细胞膜受损程度最低。实验结果表明,压差预冷有效保护了西兰花贮藏期间细胞膜的完整性,降低了西兰花组织相对电导率的上升。
2.2.6 压差预冷对西兰花贮藏期间SOD、APX与PRX酶活性的影响
SOD含有金属辅基[15],可以与PRX等酶协同抵御活性氧对于植物细胞造成的氧化伤害[16],是植物组织活性氧代谢的重要酶之一;APX可以催化H2O2与抗坏血酸发生氧化还原反应,使得H2O2得以分解清除[17],是植物组织抗氧化的重要酶。PRX是果蔬体内一种重要的氧化还原酶,可以催化过氧化氢的氧化,实现对其的分解,在果蔬成熟衰老、抗氧化、抗逆等生物过程发挥着重要的作用[18]。如图8所示,SOD、APX、PRX活性在贮藏期间整体均呈现先上升后下降的趋势。其中,在贮藏第4天,预冷+低温组与预冷+常温组SOD活性均显著高于不预冷+低温组与不预冷+常温组(P<0.05);在贮藏第4天和第5天,预冷+低温组与预冷+常温组APX活性均显著高于(P<0.05)不预冷+低温组与不预冷+常温组;在贮藏第3天和第5天,预冷+低温组与预冷+常温组PRX活性均显著高于不预冷+低温组与不预冷+常温组(P<0.05);实验结果表明,预冷处理可以使得西兰花在贮藏后期保持较高的活性氧代谢相关酶活性,实现对活性氧的分解,减少活性氧对西兰花带来的损伤。

a-SOD活性;b-APX活性;c-PRX活性
3 讨论
预冷技术作为一种便捷有效的采后处理方式,目前已经应用于多种果蔬保鲜,不同预冷方式可以通过维持果蔬可溶性固形物、可滴定酸含量[19],延缓软化、腐烂[20]等不同方面实现保鲜的目的,在果蔬采后品质的维持上发挥着重要的作用。不同的预冷方式也适用于不同的果蔬,在实际应用过程中需要综合考虑产地实际情况、果蔬的特点以及不同预冷方式的优缺点来确定合适的预冷方式。针对冷库的建立与预冷设备的研发及应用同样需要更多的理论支撑,本研究为西兰花采后预冷工艺做出了一定的探索,并对预冷的保鲜机制做了初步的探讨。
压差预冷是目前广泛应用于多种果蔬保鲜的重要预冷技术,在红毛丹[21]、长枣[22]等果蔬保鲜中已经被证实有优秀的保鲜效果,在本研究中,压差预冷提高了西兰花抗氧化酶的活性,提升了西兰花抵御氧化胁迫的能力,维持了西兰花的品质;同时,预冷协同低温贮藏可能还在一定程度上抑制了微生物的生长发育,降低了可溶性固形物的消耗与腐烂率,但压差预冷对不同果蔬维持采后品质的机制可能有所不同,针对不同类型果蔬采后可能出现的影响品质的各种问题,需要选择合适的预冷方式或研发相应的预冷设备满足大规模农业生产的需求,或者将预冷与数学建模、工程设计等结合,以求用更低的成本来获得更好的果蔬预冷效果[23]。
有研究表明,果蔬内MDA与过氧化氢的积累是植物衰老的重要诱因,活性氧代谢紊乱引起的活性氧含量急剧上升使得其体内叶绿素降解、蛋白质的合成受到阻碍、膜结构遭到破坏[24],引起硬度下降及商品价值的丧失。活性氧是植物有氧代谢的重要产物,预冷去除了西兰花采收时的田间热,降低了西兰花的呼吸速率,减少了乙烯的产生与活性氧的积累,维持了采后西兰花组织内蛋白质的功能完整性,延缓了西兰花的衰老。在不预冷组中,西兰花采后呼吸旺盛,加速了西兰花的衰老,活性氧积累量提升,导致西兰花细胞结构遭到破坏,植物中蛋白质遭到损伤,导致相关酶活性降低,对活性氧的清除能力下降,西兰花发生活性氧代谢紊乱,导致其贮藏品质的下降。
4 结论
高风速与0 ℃风温预冷在80 min可以完成对西兰花的预冷,从考虑西兰花较大产量和节能、节时的角度,选择高风速7.4 m/s、0 ℃风温作为西兰花压差预冷的处理条件;压差预冷协同低温贮藏降低了西兰花在贮藏期间的失重率与腐烂率,减缓了叶绿素的分解与硬度的上升,降低了西兰花的相对电导率与MDA含量,同时压差预冷协同低温贮藏提高了西兰花组织内活性氧代谢相关酶(SOD、PRX、APX)的活性,使得西兰花在贮藏期间维持了较高的抗氧化水平,提高了西兰花贮藏期间维持其商品价值与营养品质的能力。