豇豆泡菜中产生物胺菌株的筛选鉴定及其产胺特性研究
黄岩,鲜双,李倩,陈其青,徐飞,陈安均*
1(四川农业大学 食品学院,四川 雅安,625014)2(四川李记酱菜调味品有限公司,四川 眉山,620030)
生物胺是一类广泛存在于发酵食品中的呈碱性的低分子有机含氮有机化合物,人体过量摄入会引发各种不良反应,其中组胺的毒性最强[1]。游离氨基酸的脱羧作用是食品中生物胺的主要生成途径,包括三大要素:存在游离氨基酸;存在能产生相应游离氨基酸脱羧酶的微生物;适宜微生物生长繁殖及发挥酶活性的环境条件[2]。相关研究发现,食品中常见的产胺微生物包括:肠杆菌科、假单胞菌属、乳酸菌、酵母菌等[3-4]。张黎明等[5]从腌鱼中筛选到25株产生物胺菌株,分属于肠杆菌属、不动杆菌属、产气单胞菌属、摩根氏菌属、肥杆菌属、希瓦氏菌属、普罗威登斯菌属和嗜盐单胞菌属8个种属。泡菜作为我国代表性的传统发酵制品之一,在其制作过程中,往往会由于部分微生物的作用而产生生物胺。唐垚等[6]从四川泡菜中筛选出11株产生物胺的细菌,包括解鸟氨酸拉乌尔菌、弗氏柠檬酸杆菌、特基拉芽孢杆菌和阿耶波多氏芽孢杆菌。食品中产胺微生物的种类及数量与生物胺含量密切相关,明确泡菜中产胺微生物种类,通过控制其生长及产酶活性,对泡菜中生物胺的防控意义重大。
环境因子(pH、盐度、温度等)对食品中的微生物生长以及各种酶活都有明显的影响[7]。乔娜[8]研究发现通过添加乳酸显著降低pH值进而抑制鲤鱼冷藏过程中生物胺的形成,延长鱼的货架期。XIE等[9]研究了不同盐浓度的大豆酱在自然发酵过程中生物胺的变化,发现生物胺含量与盐度呈负相关。赵庆志等[10]研究了鲐鱼在不同贮藏温度下生物胺变化情况,发现低温可以有效地控制生物胺的积累。
基于以上研究,本研究以传统豇豆泡菜为对象,对产生物胺菌株进行分离筛选及鉴定,探究菌株在不同生长环境条件下的产胺特性,进而控制生物胺的形成,提高泡菜的食用安全性,为泡菜发酵过程中生物胺的防控提供一定理论参考。
1 材料与方法
1.1 材料与试剂
1.1.1 试验原料
新鲜豇豆及香辛料,雅安市雨城区苍坪路农贸市场;泡菜卤水,实验室自制多轮循环使用的老坛。
1.1.2 主要试剂
NaCl、NaOH、NaHCO3、MgSO4·7H2O、MnSO4·4H2O、FeSO4·7H2O、CaCO3、盐酸、氨水、葡萄糖、溴甲酚紫、吐温-80、乙腈(色谱级)、甲醇(色谱级),成都科隆化学品有限公司;氨基酸(色氨酸、组氨酸、酪氨酸、赖氨酸、鸟氨酸、精氨酸),上海生工生物工程股份有限公司;生物胺(色胺、腐胺、尸胺、组胺、酪胺、亚精胺),美国西格玛试剂公司;色谱级丹磺酰氯,上海麦克林生化科技有限公司;5′-磷酸吡哆醛,上海凛恩科技发展有限公司。
1.1.3 培养基
胰蛋白胨、酵母浸粉、结晶紫中性红胆盐琼脂培养基(violet red bile agar,VRBA)、MRS培养基、酵母膏胨葡萄糖琼脂培养基(yeast extract peptone dextrose medium,YPD)、LB肉汤培养基、MRS肉汤培养基、YPD肉汤培养基,青岛海博生物技术有限公司。
1.2 仪器与设备
PHS-3C雷磁pH计,上海仪电科学仪器股份有限公司;HC-2062高速离心机,安徽中科中佳科学仪器有限公司;DNP-9162电热恒温培养箱,上海精宏实验设备有限公司;电热恒温水浴锅,北京市永光明医疗仪器有限公司;DSX-30L手提式高压蒸汽灭菌器,上海申安医疗器械厂;HR40-IIA2生物安全柜,青岛海尔特种电器有限公司;Ultimate 3000高效液相色谱仪,赛默飞世尔科技公司。
1.3 试验方法
1.3.1 泡菜制作方法
将洗净后的新鲜豇豆晾干至表面无水气,将纯净水煮沸后添加食盐(60 g/L)和白糖(20 g/L)搅拌至完全溶解,冷却至常温。香辛料添加量以豇豆质量为基准,红辣椒20 g/kg、生姜10 g/kg、大蒜10 g/kg、花椒2 g/kg。称取500 g豇豆,按照料液质量比1∶4装坛,最后加入体积分数1%的白酒,盐水水封后进行发酵。
1.3.2 微生物分离纯化
分别从不同发酵时期无菌操作均匀吸取25 mL泡菜发酵液,转移至225 mL无菌生理盐水中,制得10倍稀释液,振荡均匀,依次梯度稀释得到10-7样品稀释液,选取适宜梯度的样液,分别涂布于VRBA、MRS、YPD平板上,在28 ℃或37 ℃培养48 h后,根据菌落形态特征差异,每个平板随机挑选3~7个单菌落进行分离纯化,连续平板划线2~3次,确保得到纯的单菌落。对单个菌株进行编号,将纯化后的菌株接种于相应的液体培养基中分别培养24 h,最后保存在25%(体积分数)甘油中冻藏于-20 ℃冰箱备用。
1.3.3 产生物胺菌株的筛选
参考蒙菊[11]的方法,氨基酸肉汤培养基(1 L):5 g胰蛋白胨、5 g酵母浸粉、氨基酸各5 g(色氨酸、组氨酸、酪氨酸、赖氨酸、鸟氨酸、精氨酸),5 g NaCl、0.06 g溴甲酚紫、1 g葡萄糖、0.2 g MgSO4·7H2O、0.05 g MnSO4·4H2O、0.04 g FeSO4·7H2O、0.1 g CaCO3、0.5 mL吐温-80、0.05 g磷酸吡哆醛,最后用1 mol/L HCl溶液将pH调至5.3左右。
将分离纯化得到的菌株活化后,分别接种于氨基酸肉汤培养基中,同时设立空白对照,在37 ℃温度下培养48 h,观察培养基颜色变化。空白对照培养基颜色呈棕色,若培养基呈紫色或酪氨酸沉淀消失,表示待测菌株为产胺阳性菌,若培养基呈黄色,表示待测菌株为产胺阴性菌。
1.3.4 产生物胺菌株的鉴定
将产生物胺阳性菌株分别接种于LB肉汤培养基中,于37 ℃活化培养24 h,10 000 r/min离心10 min获取菌体,后送至擎科生物科技有限公司进行提取、纯化、扩增与测序。选择通用引物27F:5′-AGAGTTTGATCCTGGCTCAG-3′;1492R:5′-CTACGGCTACCTTGTTACGA-3′进行PCR扩增,将测序结果与NCBI数据库序列进行BLAST同源性检索,利用MEGA11进行比对分析后构建系统发育树,以确定菌株种属。
1.3.5 产生物胺菌株的产胺能力分析
将产生物胺阳性菌株按相同体积分数接种于氨基酸肉汤培养基中,37 ℃培养48 h,将培养液离心(10 000 r/min,15 min)后取上清液进行稀释,取1 mL稀释液利用高效液相色谱仪进行生物胺含量测定。生物胺测定方法参考GB 5009.208—2016《食品安全国家标准 食品中生物胺的测定》及翟凤梅等[12]的方法,并稍作修改。
1.3.5.1 标准曲线的制作
首先分别将6种生物胺标准品(色胺、腐胺、尸胺、组胺、酪胺、亚精胺)用0.1 moL/L HCl溶液配制成1 mg/mL的标准储备溶液,再将标准储备溶液混合配制为100 mg/L的标准混合使用液。将标准混合使用液分别稀释为2.5、5、10、15、25、50 mg/L的生物胺混标使用液,对生物胺混标使用液进行衍生化后上机测定,制得生物胺标准曲线。
1.3.5.2 样品衍生化
取1 mL待测样品稀释液,依次加入200 μL 2 mol/L NaOH、300 μL饱和NaHCO3溶液、2.0 mL丹磺酰氯溶液(10 mg/mL),在40 ℃水浴条件下暗反应45 min,然后加入100 μL的氨水终止衍生化反应,最后用乙腈定容至5 mL,过孔径为0.22 μm的有机系滤膜于进样瓶中,利用高效液相色谱仪进行分析检测。
1.3.5.3 色谱条件
色谱柱:Sepax HP C18;流动相A超纯水;流动相B乙腈;流速0.8 mL/min;紫外检测波长254 nm;柱温35 ℃;进样量20 μL;采用梯度洗脱,洗脱程序共35 min,包括5个阶段,在0~15 min,A流动相体积分数由30%降为25%,B流动相体积分数则由70%上升到75%;在15~20 min,A流动相体积分数由25%降至20%,B流动相体积分数则由75%上升到80%;在20~25 min,A流动相体积分数由20%降至10%,B流动相体积分数则由80%上升到90%;在25~28 min,A流动相体积分数由10%升至25%,B流动相体积分数则由90%降到75%;在28~35 min,A流动相体积分数由25%升至40%,B流动相体积分数则由75%降到60%。
1.3.6 环境因子对生物胺菌株产胺能力的影响
根据泡菜发酵工艺结合微生物生长条件,设置具有不同梯度pH值(3.5、4.5、5.5和6.5)、盐度(20、40、60和80 g/L)和温度(10、20、28和37 ℃)的氨基酸肉汤培养基,将具有代表性的高产胺菌株活化后,取1 mL菌悬液按照体积分数10%接种至氨基酸肉汤培养基中,37 ℃(温度梯度组除外)静置培养48 h,对培养液进行离心稀释后待测。
1.4 数据处理
采用Excel 2016对试验数据均值和标准差进行计算,利用SPSS 26对试验数据间的显著性进行分析,显著水平为P<0.05,使用Origin 2021进行图表绘制。
2 结果与分析
2.1 泡菜中产生物胺菌株的分离筛选
如图1所示,在泡菜发酵过程中,经分离纯化后得到77株菌株,包括43株乳酸菌、26株肠杆菌和8株酵母菌。将菌株活化后分别接种于氨基酸肉汤培养基中培养48 h,观察培养基颜色变化,呈紫色为产胺阳性菌株。经过初步筛选,发现共26株细菌具有形成生物胺的能力,包括20株肠杆菌和6株乳酸菌。

图1 氨基酸肉汤培养基显色结果
2.2 泡菜中产生物胺菌株的鉴定
利用16S rRNA基因测序技术对初筛得到的26株产生物胺阳性菌进行鉴定,26株菌株分别属于8个不同种属,其中包括10株肠杆菌(Enterobactersp.)、4株克雷伯氏菌(Klebsiellasp.)、2株勒克氏菌(Leclerciasp.)、2株莱略特菌(Lelliottiasp.)、1株假柠檬酸盐杆菌(Pseudocitrobactersp.)、1株泛菌(Pantoeasp.)、5株魏斯氏菌(Weissellasp.)、1株乳杆菌(Lactiplantibacillussp.),选择不同种属的代表菌株进行系统进化树构建,如图2所示。相关研究表明,肠杆菌是四川泡菜中中除乳酸菌株外数量最多的细菌,也是发酵蔬菜中常见的产生物胺菌属[13-14]。
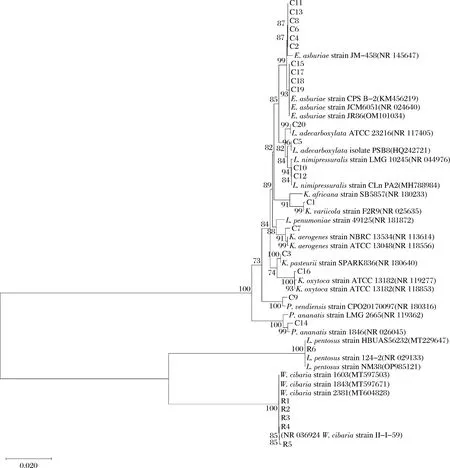
图2 产胺菌株16S rRNA基因系统发育树
2.3 产生物胺菌株产胺能力分析
2.3.1 生物胺标准样品的色谱图及线性回归方程
图3是生物胺混合标品HPLC色谱峰图,可以看出6种生物胺在35 min内可以得到很好的分离,每个峰形都是独立且对称的,基线平稳无拖尾现象,说明样品中的生物胺可在此方法下进行良好的分离检测。

1-色胺;2-腐胺;3-尸胺;4-组胺;5-酪胺;6-亚精胺
以峰面积(y)为纵坐标,生物胺标品浓度(x)为横坐标进行标准曲线的绘制,具体信息如表1所示,6种生物胺在2.5~100 mg/L质量浓度范围内,峰面积与浓度之间具有良好的线性关系,且相关系数都高于0.999 5,表明此方法可以有效地对样品中的6种生物胺进行测定。

表1 生物胺标准曲线回归方程、相关系数及线性范围
2.3.2 产胺菌株产胺含量检测结果
将初筛得到的26株产胺阳性菌株分别接种于5 g/L的氨基酸肉汤培养基于37 ℃下培养48 h,利用高效液相色谱仪对培养液中的生物胺进行检测,具体结果如表2所示。可以发现,筛得的菌株以产腐胺和尸胺为主,具有产生物胺能力的乳酸菌产总胺含量均低于10 mg/L,而20株肠杆菌的生物胺产量均超过了1 000 mg/L,其中C7菌株产胺能力最强,产胺量高达7 400.13 mg/L,且是唯一具有产组胺能力的菌株。这与相关研究结果类似,蒙菊[11]对分离自发酵酸鱼中的肠杆菌、乳酸菌和葡萄球菌的产胺性能进行了研究,发现肠杆菌的产生物胺活性远强于其他菌株。李梅等[15]研究发现,腐胺和尸胺是四川泡菜中的含量最高的2种生物胺。因此,对于生物胺的防控来说,虽然在整个泡菜发酵过程中乳酸菌数量占有绝对优势,但在发酵初期占一定优势的肠杆菌才是对生物胺积累有重要贡献的菌群[16],因此选择5株(C3、C6、C7、C16、C19)具有代表性的高产胺肠杆菌菌株作进一步研究,其中C6株和C19株为肠杆菌属,C3、C7、C16为克雷伯氏菌属。图4为部分菌株生物胺测定色谱峰图。

表2 菌株产生物胺能力的测定结果

a-C3;b-C6;c-C7;d-C16;e-C19
2.4 环境因子对产胺菌株产胺能力的影响
在泡菜发酵过程中,多种因素共同决定了生物胺含量的高低,包括前体游离氨基酸含量、产胺微生物种类与数量、微生物生长与产胺环境条件等。环境条件对产胺微生物生长及产酶活性影响明显,不同环境条件下产胺菌株的产胺能力有很大的差别。为了具体探究泡菜中产胺菌株在不同生长环境下的产胺特性,共挑选了5株高产胺肠杆菌菌株在不同pH、盐度和温度下分别进行培养,对培养液中生物胺含量进行了分析。
2.4.1 pH对产胺菌株产胺能力的影响
pH值高低决定了泡菜发酵过程中微生物菌群的组成结构,根据泡菜发酵过程中pH值变化情况,设置了3.5、4.5、5.5、6.5四个pH梯度,以探究pH值对产生物胺菌株产胺能力的影响。如图5所示,5株菌株在pH 4.5或pH 5.5时产胺量最高,这可能是由于在较低pH环境下,产胺菌株生长受到抑制,诱导其分泌氨基酸脱羧酶对游离氨基酸进行脱羧反应,生成呈碱性的生物胺以抵抗低酸环境对菌株自身生长造成的影响[17]。而较高pH环境会导致对应氨基酸脱羧酶基因表达量降低,过低的pH值会严重影响菌株生长繁殖以及酶活性。

a-腐胺;b-尸胺;c-组胺
除了C7株外,其他4株菌在pH 3.5时几乎没有生物胺产生,说明低pH值对生物胺的形成有很大影响,低pH可强烈抑制菌株形成生物胺。因此,在泡菜发酵过程中可以考虑外源添加有机酸或接种优良发酵剂以快速降低泡菜发酵体系的pH值,减少生物胺的积累[18-19]。
2.4.2 盐度对产胺菌株产胺能力的影响
盐度是泡菜发酵过程中的重要理化指标,不仅可决定泡菜口感和风味,还会影响微生物的生长代谢[20]。由图6可知,腐胺和组胺的含量随盐度的升高而明显减少,盐度对于腐胺和组胺的形成有强烈的抑制作用,当盐度升高至80 g/L时,几乎无腐胺和组胺产生,这一研究结果与吕佳良[21]的结论相似。

a-腐胺;b-尸胺;c-组胺
尸胺的产量受盐度的影响则相对较小,C3菌株在20 g/L和40 g/L盐度下的尸胺产量未表现出较为明显的差异,而C7株、C16株和C19株在盐度提高至60 g/L时,其尸胺产量都未出现明显降低,这可能是由于负责形成尸胺的赖氨酸脱羧酶的分子结构对Na+的耐受性更高而导致的,Na+可以作用于氨基酸脱羧酶的肽键,通过破坏酶分子结构而使其酶活性降低[22]。所以只有将盐浓度控制在80 g/L及以上时,才能整体上最大程度地减少生物胺的积累。
2.4.3 温度对产胺菌株产胺能力的影响
温度是泡菜发酵过程中影响微生物生长和酶活的关键环境因子之一。如图7所示,不同菌株产生物胺含量受温度影响程度不同,同一菌株在产生不同种类生物胺时受温度影响也不同。其中,大部分产胺菌株的鸟氨酸脱羧酶及组氨酸脱羧酶活性受温度影响较为明显,与10 ℃相比,提高发酵温度增加了腐胺和组胺的生成量。而菌株产尸胺能力受温度的影响则较低,在10 ℃时已经具备较强的产胺能力,而C7菌株更是有着比其他温度下更强的产尸胺能力,可能是由于赖氨酸脱羧酶在较低温度下就能够发挥足够的活性。有研究也证明了这一现象,CVETKOVI等[23]发现较高温度可以加快发酵甘蓝中生物胺的积累,且对腐胺和组胺的形成更为显著。

a-腐胺;b-尸胺;c-组胺
3 结论
本试验以传统四川泡菜为原料,利用氨基酸肉汤培养基从泡菜发酵过程中筛选得到26株产胺菌株,利用16S rRNA基因技术,结合NCBI进行同源性搜索比对,鉴定26株来自于肠杆菌属、克雷伯氏菌属、勒克氏菌属、假柠檬酸盐杆菌属、莱略特菌属、泛菌属、魏斯氏菌属和乳杆菌属共8个属。利用高效液相色谱对菌株的产生物胺能力分析,发现肠杆菌具有很强的产胺能力,主要产胺种类为腐胺和尸胺,腐胺、尸胺和组胺最高生成量分别达到了4 829.67、2 987.84和2 212.52 mg/L。对其中高产胺菌株产胺特性研究发现,pH值和盐度可以显著降低生物胺含量,菌株产胺能力受温度影响相对较小,当pH为3.5或盐度为80 g/L时,大部分菌株基本无法产生物胺。相比较而言,鸟氨酸脱羧酶对pH、盐度和温度都比较敏感,组氨酸脱羧酶则对盐度更为敏感,而赖氨酸脱羧酶则对pH更敏感。
以上研究结果为控制四川泡菜中生物胺的积累提供了一定理论参考,但鉴于不同菌株对环境的抗逆性存在差异性,要更好地达到限制泡菜中生物胺的目的,不能只依靠单一的因素对产胺菌株进行限制,还应当考虑添加更多的栅栏因子共同作用,如具有抑菌作用的香辛料、优良发酵剂及胺氧化酶等。