高效离子交换色谱法测定一种13C-尿素呼气试验用药品中13C-尿素的含量
詹传红,魏翠雯,关 东,李国威
(深圳市中核海得威生物科技有限公司,广东深圳 518122)
13C-尿素呼气试验(13C-UBT)是诊断幽门螺杆菌(Hp)感染的准确、简便、卫生的非侵入性试验,受到临床医生和病人的普遍欢迎[1]。13C-UBT 的优点是它没有放射性[2]。目前13C-UBT 在临床上用于检测胃幽门螺杆菌(Helicobacter Pylori,HP)感染,在国际上已被公认为胃部HP 感染诊断的最重要手段之一,并被誉为胃部HP 感染诊断的金标准[3]。13C-尿素是重要的13C 标记基础试剂之一,其最为广泛的应用是临床诊断用13C-尿素呼气试验(13C-UBT)[4-5]。因此需要建立一个准确、可靠的测定13C-尿素含量的方法。
经文献报道现有13C-尿素含量测定方法主要包括凯氏定氮法、显色-紫外分光光度法和液相色谱法。凯氏定氮法专属性不强[6],显色-紫外分光光度法存在重现性差、操作繁琐及不适合批量分析等问题[7]。随着液相色谱技术的发展和先进仪器设备的引入,目前应用较多,较为灵敏、快速、准确的方法为高效液相色谱法。美国药典收载有13C-尿素原料药含量测定的高效液相色谱法,但是该方法以及已有的分析方法不适用于本研究中13C-尿素呼气试验用药品的含量测定,因该药品中添加了大量的辅料甘露醇、柠檬酸等物质,已有检测方法无法将13C-尿素与辅料分开,且主成分13C-尿素保留时间短、基线噪声大,难以对13C-尿素进行准确定量。
1 仪器与试剂
1.1 仪器
赛默飞Vanquish core 高效液相色谱仪,DAD 二极管阵列检测器(美国Thermo)、XPR225DR 型电子分析天平(梅特勒);PURELAB flex2纯水仪(ELGA)。
1.2 试剂
13C-尿素标准品(美国药检所,批号1 706701;纯度99.8%);缩二脲(阿拉丁,批号C2 011021;纯度99.0%);甘露醇(湖南九典制药股份有限公司,批号TF84210301);柠檬酸(成都华邑药用辅料制造有限责任公司,批号20210101);一种呼气试验用药品(国内已上市药品,批号180822)。
2 方法与结果
2.1 色谱条件
色谱柱:CAPCELL PAK SCX UG80S5(4.6 mm×250 mm);流动相:超纯水;流速:0.6 mL/min;检测波长:200 nm;进样量:20 μL。
2.2 溶液制备
(1)空白溶液(稀释剂):流动相;
(2)对照品溶液:取13C-尿素对照品约50 mg,精密称定,置100 mL 量瓶中,加稀释剂使溶解并稀释至刻度,摇匀,即得(每毫升约含13C-尿素0.5 mg)。
(3)供试品溶液:取供试品约2.0 g,精密称定,置100 mL 量瓶中,加稀释剂使溶解并稀释至刻度,摇匀,即得(每毫升约含13C-尿素0.5 mg)。
(4)缩二脲对照品贮备液:取缩二脲对照品约10 mg,精密称定,置100 mL 量瓶中,加稀释剂溶解,并稀释至刻度,摇匀,即得(每毫升约含缩二脲100 µg)。
(5)系统适用性溶液:取13C-尿素对照品约10 mg,精密称定,置20 mL 量瓶中,再精密量取缩二脲对照品贮备液0.1 mL 至同一量瓶中,加稀释剂稀释至刻度,摇匀,即得。
(6)空白辅料溶液:取根据样品配方制备的不含13C-尿素的空白辅料,精密称定,置100 mL 量瓶中,加稀释剂使溶解并稀释至刻度,摇匀,即得。
2.3 方法学考察
2.3.1 专属性
精密吸取“2.2”项下各溶液按“2.1”色谱条件进样分析,结果见图1。结果表明,空白溶剂、空白辅料及样品中的其他成分不干扰13C-尿素的测定,13C-尿素与已知杂质缩二脲的分离度大于1.5,理论板数按13C-尿素峰计算大于5 000,该方法专属性良好。
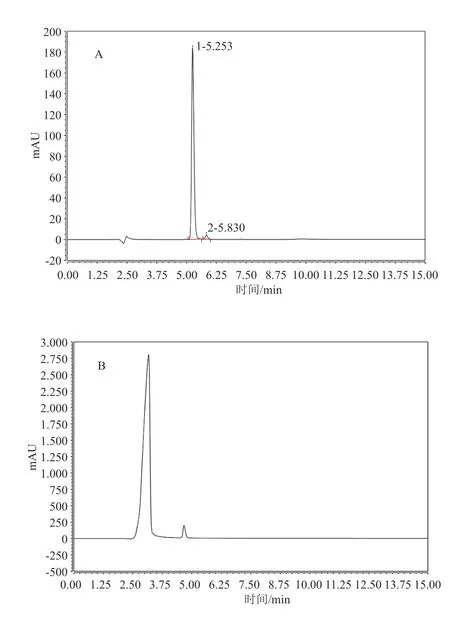
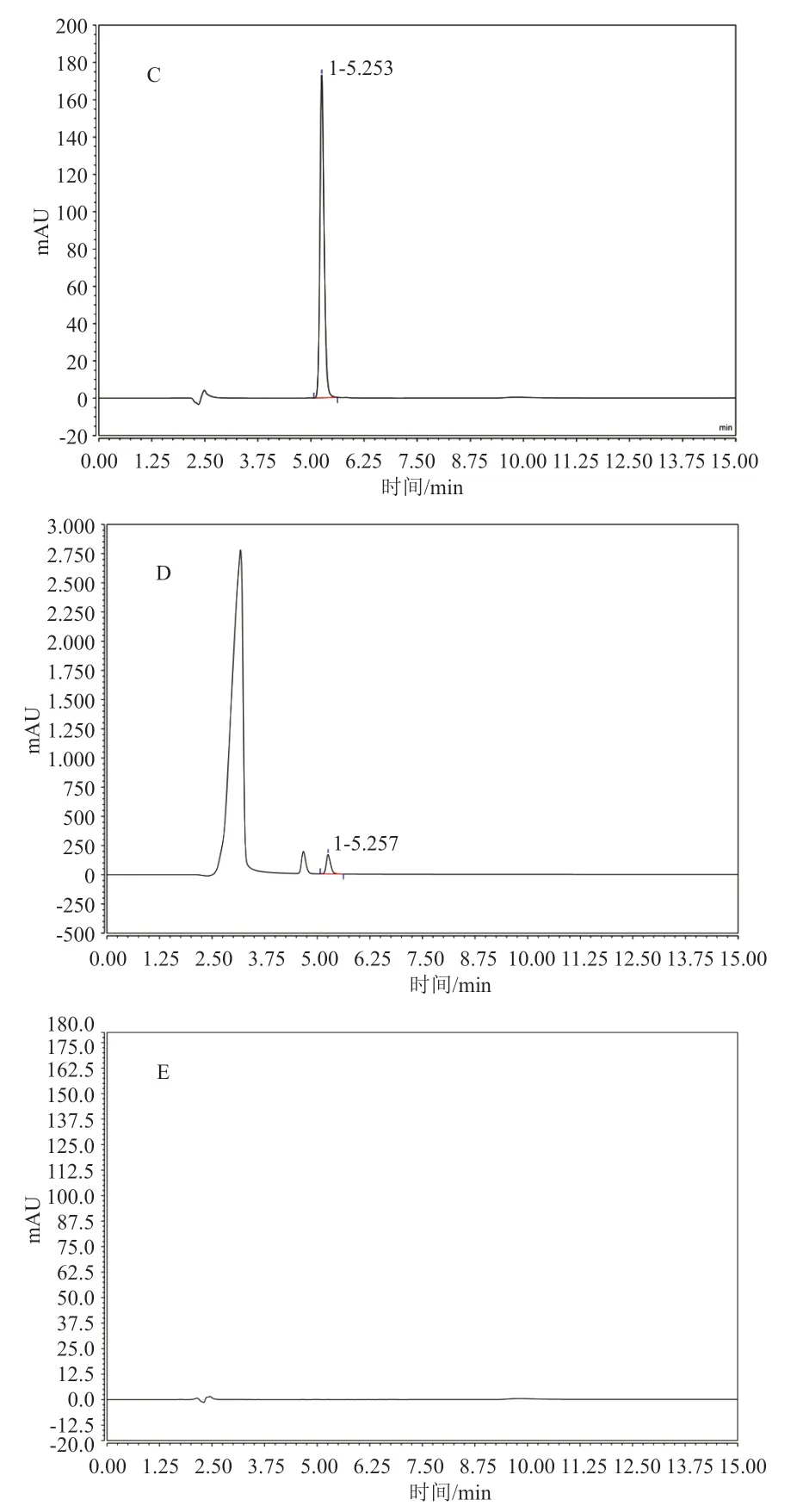
图1 专属性试验高效离子交换色谱图
2.3.2 线性及范围
取13C-尿素对照品约125 mg,精密称定,置25 mL 量瓶中,加稀释剂使溶解并稀释至刻度,制得13C-尿素对照品贮备液(5 mg/mL)。精密量取对照品贮备液置10 mL 量瓶中,加稀释剂分别制成0.25 mg/mL、0.4 mg/mL、0.45 mg/mL、0.5 mg/mL、0.55 mg/mL、0.6 mg/mL 的线性溶液。精密吸取上述各浓度的线性溶液进样分析,记录色谱图。以各个线性溶液中13C-尿素的浓度为横坐标,对应的峰面积为纵坐标,得出线性回归方程,报告线性曲线的斜率和相关系数r。结果表明,13C-尿素的回归方程为y=37.451x+0.9305,相关系数r为0.9996(≥0.999),即13C-尿素在浓度为0.25~0.60 mg/mL(相当于测试浓度50%~120%),浓度与响应值呈显著线性关系。
2.3.3 重复性
空白溶液、对照品溶液、供试品溶液、系统适用性溶液同“2.2溶液制备”的方法配制,供试品溶液平行配制6份,精密吸取各溶液进样分析,记录色谱图,结果表明,6份溶液含量为98.1%~100.4%,RSD 为2%,该方法重复性良好。
2.3.4 准确度
取根据样品配方制备的不含13C-尿素的空白辅料,置100 mL 量瓶中,再分别精密加入40 mg、50 mg、60 mg 的13C-尿素对照品,分别制备得到80%、100%、120%的加标供试品溶液,每个浓度均平行配制3份,精密吸取各溶液进样分析,记录色谱图,计算加标回收率,结果见表1。
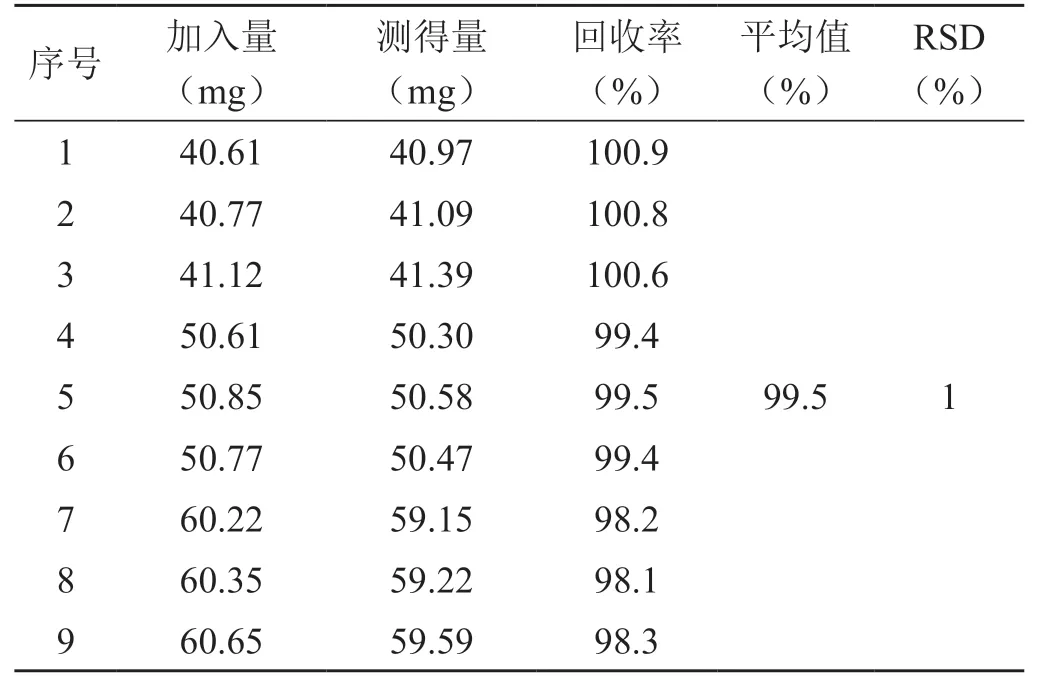
表1 准确度试验结果(n=9)
从表1 看出,9 份准确度溶液中,13C-尿素的回收率为98.1%~100.9%,RSD 值为1%,该方法的准确度良好。
2.3.5 稳定性
取“2.2.2”项下对照品溶液、“2.2.3”项下供试品溶液室温放置分别于不同时间点取样检测,考察对照品溶液、供试品溶液在室温条件下放置的稳定性。结果显示,对照品溶液在室温放置39.0 h 内,各时间点检测结果与0 h 比较,13C-尿素峰面积的比值为99.6%~100.0%;供试品溶液在室温放置29.4 h 内,各时间点测得13C-尿素的含量与0 h 比较含量的变化值为0.2%~0.6%。表明对照品溶液、供试品溶液分别在室温放置39.0 h 内和29.4 h 内稳定。
2.3.6 耐用性试验
分别于不同流速、不同柱温、不同检测波长下对对照品溶液和供试品溶液进行分析,考察系统适用性和供试品溶液中13C-尿素的含量是否符合要求。结果见表2。
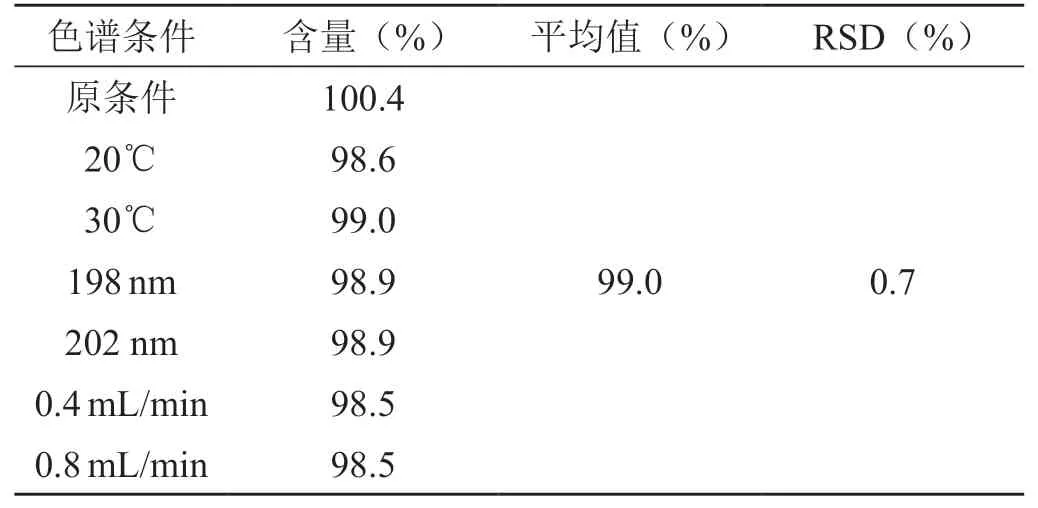
表2 不同色谱条件下的含量测定结果
从表2看出,该方法对柱温、流速、检测波长的微小变动耐用性良好。
3 方法开发过程
3.1 色谱柱的选择
本研究考察了不同类型色谱柱的分离效果,首先采用普通反相色谱柱ZORBAX SB-C8进行分离,结果显示13C-尿素峰较难保留;之后采用亲水模式的HILIC 色谱柱进行分离,该色谱柱下13C-尿素峰峰形差且基线波动较大;而采用氨基柱Shodex Asahipak NH2P-50 4E 进行分离时发现,该色谱条件下空白辅料对供试品溶液中13C-尿素的测定有干扰,专属性无法满足测试要求,同时基线噪声较大。最终选择磺酸基阳离子交换色谱柱CAPCELL PAK SCX UG80S5为本研究中的色谱柱,该条件下基线平稳、峰形对称且主峰与其他峰能够有效分离。
3.2 流动相的选择
以CAPCELL PAK SCX UG80S5(4.6 mm×250 mm)为色谱柱,分别考察了乙腈-水(5 ∶95,V/V)、超纯水、0.2 mol/L 磷酸氢二铵作为流动相的分离效果,结果见表3

表3 3种流动相体系下13C-尿素的分离情况
从表3看出,3种流动相系统均能对供试品溶液中13C-尿素进行有效分离,对比发现,0.2 mol/L 磷酸氢二铵体系下,供试品溶液中13C-尿素与相邻峰的分离度最好,但考虑到0.2 mol/L 磷酸氢二铵浓度较大,会对色谱柱和色谱仪造成一定程度的损伤,因此,在能满足相应检测需求时,优选超纯水作为本研究的流动相。
4 结论
该方法中主成分13C-尿素保留较好,基线平稳、背景噪声小,同时峰形对称,与溶剂峰、辅料峰和已知杂质的分离度良好,且方法所用流动相为超纯水,不含缓冲盐,不会对色谱柱和仪器造成损伤。通过该色谱方法能够对13C-尿素的含量进行准确测定,从而控制13C-尿素呼气试验用药品的质量。

