DCST1-AS1 在非小细胞肺癌中的表达及其生物学作用
郭晓丹,马振禹,王晨静,韩天云,张飞燕
(1. 保定市第二医院病理科,河北 保定 071000;2. 保定市第二医院药剂科,河北保定 071000)
肺癌是当前难以治愈的恶性肿瘤,且85%以上的肺癌患者为非小细胞肺癌[1]。近年来,虽然靶向治疗能提升非小细胞肺癌患者的生存率,但多数患者仍易复发和转移,预后不佳[2]。长链非编码RNA(long noncoding RNA, lncRNA)参与调控细胞增殖和凋亡,在人类多种肿瘤中具有重要作用[3-5]。DCST1-AS1 是一种lncRNA,参与多种肿瘤的发展进程,如DCST1-AS1 在胶质母细胞瘤中表达上调,下调其表达可抑制肿瘤细胞增殖,该过程通过上调miR-29b 表达实现[6]。miR-29b 与肿瘤的发生发展密切相关,研究表明,miR-29b 能抑制细胞增殖、迁移和侵袭,因此可作为非小细胞肺癌的抑制剂[7]。但DCST1-AS1 在非小细胞肺癌中的表达及功能尚未可知。本研究首先观察非小细胞肺癌组织中DCST1-AS1 的表达及其表达水平与患者临床特征的关系,并探究DCST1-AS1 对非小细胞肺癌细胞恶性生物学行为的影响。
1 材料与方法
1.1 临床资料
收集2016年4月至2018年11月本院收治的65例非小细胞肺癌患者的癌组织和癌旁组织(距离病灶5 cm),其中男39 例,女26 例,平均年龄(58.26±5.47)岁。纳入标准:临床资料完整;术前未行放疗或化疗等;未患其他恶性肿瘤。组织分化程度低分化31例,中分化20例,高分化14例;TNM分期Ⅰ期12例,Ⅱ期21 例,Ⅲ期23 例,Ⅳ期9 例;39 例出现淋巴结转移,26 例未出现转移;腺癌42 例,鳞状细胞癌18 例,大细胞癌5例。本研究经我院医学伦理委员会审批通过(2016008),患者及其家属同意参与本研究。
1.2 细胞和主要试剂
正常人支气管上皮细胞16HBE 和非小细胞肺癌细胞系A549、H1299、H1650、HCC827(中国科学院上海细胞库);胎牛血清(fetal bovine serum,FBS;杭州四季青生物工程材料有限公司);DCST1-AS1 小干扰RNA(si-DCST1-AS1)、乱序无意义阴性序列(si-NC)、miR-29b inhibitor(anti-miR-29b)、miR-29b inhibitor 阴性对照(anti-NC)和PCR 引物(上海生工生物工程有限公司);RPMI 1640 培养基、CCK-8 试剂盒和LipofectamineTM2000 试剂盒(北京索莱宝公司);E-钙黏蛋白(E-cadherin)、波形蛋白(Vimentin)、神经型钙黏蛋白(N-cadherin)抗体(美国Santa Cruz公司)。
1.3 细胞培养
将正常人支气管上皮细胞16HBE 和非小细胞肺癌细胞系A549、H1299、H1650、HCC827 接种在RPMI 1640 培养基(含10%FBS)中,于37 ℃、5%CO2培养箱内培养。
1.4 检测DCST1-AS1、miR-29b表达
提取组织和细胞中的总RNA,然后逆转录合成cDNA,以cDNA 为模板进行扩增。引物序列:DCST1-AS1 上游5'-CCAACCAGCCAGCATTCATT-3',下游5'-CCACCTCATCCCCTACTCAC-3';GAPDH 上游5'-GT CCAAGTCCTGAGAGGCC-3',下游5'-CGCGTGTCCGA AACCTCGC-3';miR-29b 上游5'-TAGCACCATTTGAA ATCAGTGTT-3',下游5'-TGGTGTCGTGGAGAGTCG-3';U6 上游5'-CGCAAGGATGACACGCAATTC-3',下游5'-TGGTGTCGTGGAGTCG-3'。 使用2-ΔΔCt法计算DCST1-AS1、miR-29b 的表达水平。U6 作为miR-29b的内参对照,GAPDH作为DCST1-AS1的内参对照。
1.5 细胞转染与分组
将A549 细胞在RPMI 1640 培养基(含10% FBS)中培养,以每孔1.5×105个细胞的密度接种至6 孔板中,并分为si-NC 组、si-DCST1-AS1 组、si-DCST1-AS1+anti-NC 组和si-DCST1-AS1+anti-miR-29b 组。采用LipofectamineTM2000 分别将si-NC、si-DCST1-AS1、anti-NC、anti-miR-29b 转染至A549 细胞,转染6 h 后,更换培养基,再培养24 h,收集细胞备用。设置对照组(正常培养,未进行转染)。RT-qPCR 法检测各组细胞中DCST1-AS1、miR-29b的表达,验证转染效果。
1.6 CCK-8法、克隆形成实验检测细胞增殖
CCK-8 法:取各组A549 细胞以每孔2.5×104个细胞的密度接种至96 孔板中,培养24 h 后,每孔加入CCK-8 试剂(10 μL),继续培养2 h。采用酶标仪测量各孔在450 nm处的光密度(optical density,OD)值。
克隆形成实验:取各组A549 细胞接种至6 孔板中,培养14 d 后,将细胞固定在4%多聚甲醛中,0.5%结晶紫染色后,对细胞克隆进行计数。
1.7 Transwell小室实验评估细胞迁移和侵袭能力
在迁移实验中,将各组A549细胞用无血清培养基重悬(密度为5×104/mL),将100 μL 细胞悬液加到Transwell 上室中,500 μL 培养基(含10% FBS)添加到Transwell下室。培养24 h后,4%多聚甲醛固定迁移到膜下表面的细胞,结晶紫染色后,在光镜下计数迁移细胞数。在侵袭实验中,使用预涂有Matrigel 胶的Transwell上室,其余操作与迁移实验相同。
1.8 Western blot检测E-cadherin、Vimentin、N-cadherin表达
RIPA 裂解液提取细胞总蛋白,10% SDS-PAGE分离等量蛋白质样品并将其转移到PVDF 膜。将膜在室温下用5%脱脂奶粉封闭2 h 后,与E-cadherin(1∶500)、Vimentin(1∶1 000)、N-cadherin(1∶500)和GAPDH(1∶1 000)一抗在4 ℃下孵育过夜。洗膜后,在37 ℃下用山羊抗兔IgG(1∶2 000)二抗孵育1 h。电化学发光试剂显影,Image J 软件分析蛋白条带灰度值,GAPDH为内参。
1.9 统计学分析
采用GraphPad Prism 7.0 软件进行统计分析。呈正态分布的计量资料用均数±标准差(±s)表示,2 组比较用t检验,多组比较用单因素方差分析和SNK-q检验,χ2检验或秩和检验用于分析DCST1-AS1 与患者临床特征的相关性。P<0.05表示差异有统计学意义。
2 结果
2.1 DCST1-AS1、miR-29b的表达情况
与癌旁组织比较,肺癌组织中DCST1-AS1 的表达升高(t=33.030,P<0.05),miR-29b 的表达水平降低(t=28.699,P<0.05),见图1。与16HBE 细胞相比,A549、H1299、H1650 和HCC827 中DCST1-AS1 的表达水平均升高(P<0.05),miR-29b 的表达水平均降低(P<0.05),见表1。其中A549 细胞中DCST1-AS1 的表达水平最高,miR-29b的表达水平最低,因此选择A549细胞进行后续实验。
表1 DCST1-AS1在非小细胞肺癌细胞系中的表达(±s)
*:与16HBE细胞相比,P<0.05;#:与A549细胞相比,P<0.05
细胞16HBE A549 H1299 H1650 HCC827 F P DCST1-AS1 1.02±0.08 3.16±0.25*2.40±0.21*#1.58±0.17*#1.79±0.20*#166.121<0.001 miR-29b 1.00±0.09 0.33±0.05*0.45±0.06*#0.82±0.09*#0.64±0.07*#121.550<0.001
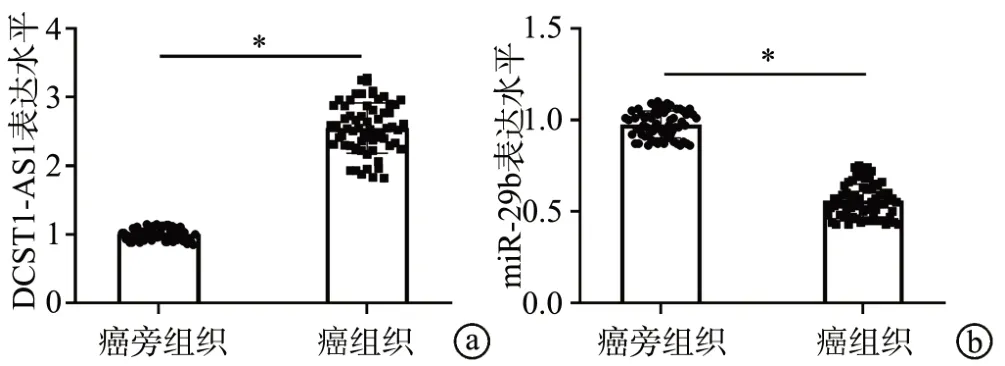
图1 RT-qPCR检测DCST1-AS1、miR-29b的表达
2.2 DCST1-AS1的表达与患者临床特征的关系
非小细胞肺癌组织中DCST1-AS1 的表达与患者TNM 分期、组织分化程度、淋巴结转移及病理类型存在相关性(P<0.05),见表2。
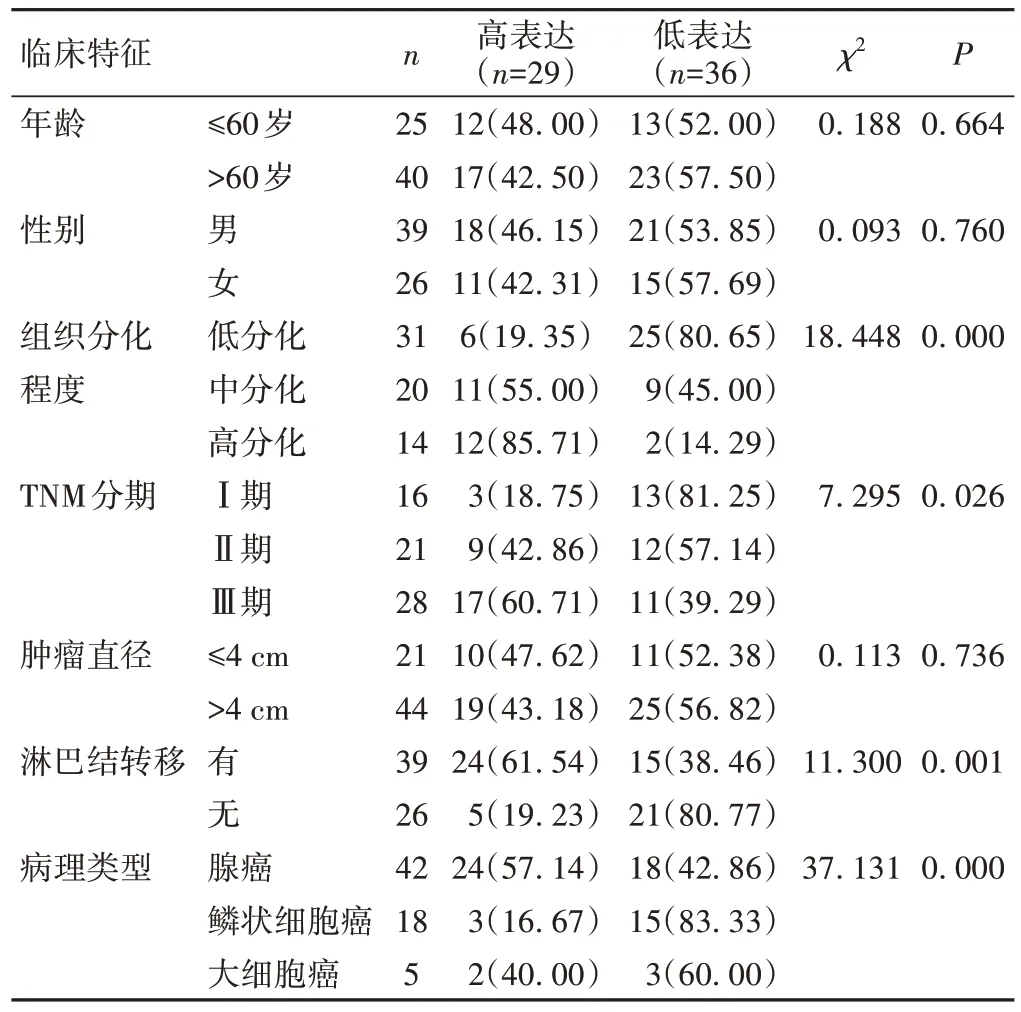
表2 DCST1-AS1表达水平与患者临床特征的相关性
2.3 下调DCST1-AS1 表达对细胞中miR-29b 表达的影响
与对照组或si-NC 组比较,si-DCST1-AS1 组A549细胞中DCST1-AS1 表达水平降低(P<0.05),miR-29b表达水平升高(P<0.05);而对照组和si-NC 组各指标比较,差异均无统计学意义(P>0.05),见表3。
表3 下调DCST1-AS1 对细胞中miR-29b 表达的影响(±s)
*:与对照组相比,P<0.05;#:与si-NC组相比,P<0.05
组别对照组si-NC组si-DCST1-AS1组F P DCST1-AS1 1.06±0.04 1.04±0.05 0.33±0.03*#933.660<0.001 miR-29b 1.01±0.08 1.03±0.09 2.82±0.15*#788.181<0.001
2.4 下调DCST1-AS1 表达对细胞增殖、迁移和侵袭的影响
与对照组或si-NC 组比较,si-DCST1-AS1 组A549细胞OD 值、克隆形成数、迁移细胞数和侵袭细胞数均降低(P<0.05);而对照组和si-NC 组各指标比较,差异均无统计学意义(P>0.05),见图2、表4。
表4 下调DCST1-AS1对细胞增殖、迁移和侵袭的影响(±s)
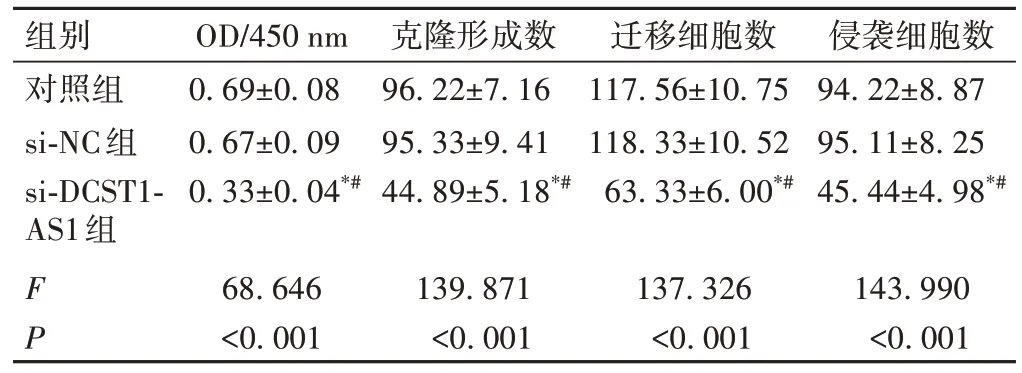
表4 下调DCST1-AS1对细胞增殖、迁移和侵袭的影响(±s)
*:与对照组相比,P<0.05;#:与si-NC组相比,P<0.05
组别对照组si-NC组si-DCST1-AS1组F P OD/450 nm 0.69±0.08 0.67±0.09 0.33±0.04*#68.646<0.001克隆形成数96.22±7.16 95.33±9.41 44.89±5.18*#139.871<0.001迁移细胞数117.56±10.75 118.33±10.52 63.33±6.00*#137.326<0.001侵袭细胞数94.22±8.87 95.11±8.25 45.44±4.98*#143.990<0.001
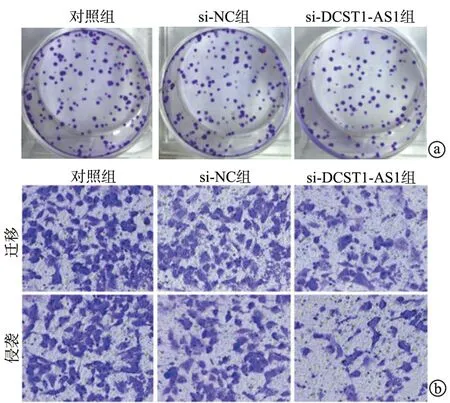
图2 下调DCST1-AS1 对细胞克隆形成能力、迁移和侵袭的影响
2.5 下调DCST1-AS1 表达对细胞中E-cadherin、Vimentin和N-cadherin表达的影响
与对照组或si-NC 组比较,si-DCST1-AS1 组A549细胞中E-cadherin 表达水平升高(P<0.05),Vimentin、N-cadherin 表达水平降低(P<0.05);而对照组与si-NC组A549 细胞中E-cadherin、Vimentin、N-cadherin 表达水平比较差异均无统计学意义(P>0.05),见图3、表5。
表5 各组细胞中E-cadherin、N-cadherin 和Vimentin 表达比较(±s)
*:与对照组相比,P<0.05;#:与si-NC组相比,P<0.05
组别对照组si-NC组si-DCST1-AS1组F P E-cadherin 0.22±0.03 0.24±0.05 0.75±0.06*#348.043<0.001 N-cadherin 0.66±0.07 0.63±0.06 0.21±0.04*#169.218<0.001 Vimentin 0.87±0.09 0.85±0.07 0.24±0.04*#237.144<0.001
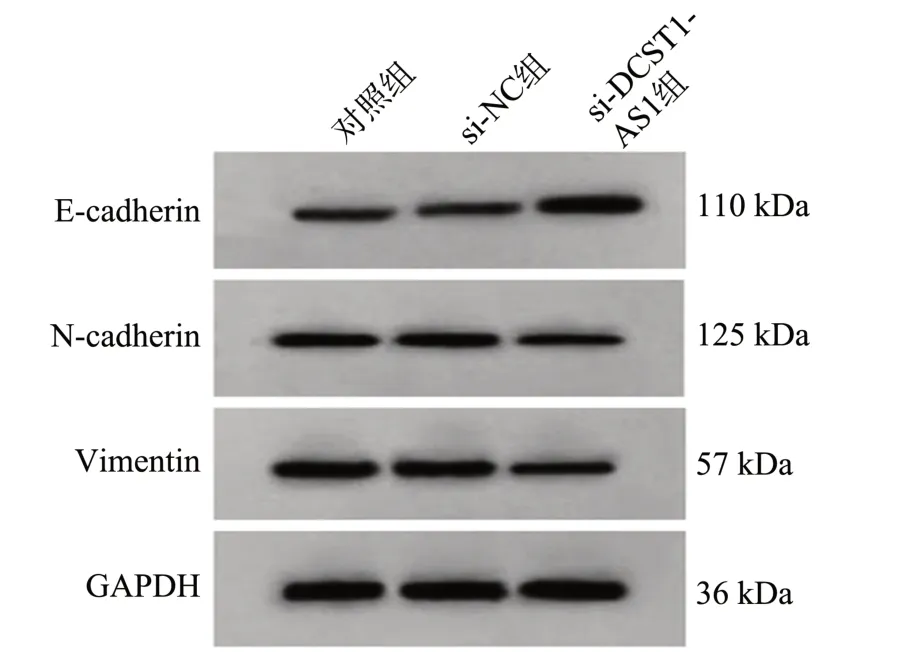
图3 Western blot 检测E-cadherin、N-cadherin 和Vimentin表达
2.6 敲低miR-29b 可减弱下调DCST1-AS1 表达对细胞恶性生物学行为的影响
与si-DCST1-AS1+anti-NC 组比较,si-DCST1-AS1+anti-miR-29b 组miR-29b、E-cadherin 表达水平降低(P<0.05),细胞OD 值、克隆形成数、迁移细胞数、侵袭细胞数及Vimentin、N-cadherin 表达水平增加/升高(P<0.05),见表6、图4。
表6 敲低miR-29b减弱下调DCST1-AS1表达对细胞恶性生物学行为的影响(±s)
表6 敲低miR-29b减弱下调DCST1-AS1表达对细胞恶性生物学行为的影响(±s)
组别si-DCST1-AS1+anti-NC组si-DCST1-AS1+anti-miR-29b组t P DCST1-AS1 0.99±0.08 1.02±0.11 0.662 0.518 miR-29b 1.00±0.10 0.41±0.06 15.178<0.001 OD/450 nm 0.35±0.04 0.62±0.07 10.047<0.001克隆形成数40.52±3.68 86.16±5.29 21.247<0.001迁移细胞数68.49±5.17 105.30±8.25 11.342<0.001侵袭细胞数47.65±5.04 96.21±7.38 16.301<0.001 E-cadherin 0.74±0.07 0.20±0.04 20.094<0.001 N-cadherin 0.23±0.04 0.78±0.09 16.753<0.001 Vimentin 0.25±0.05 0.80±0.09 16.026<0.001

图4 敲低miR-29b减弱下调DCST1-AS1表达对细胞克隆形成、迁移和侵袭的影响
3 讨论
lncRNA 在非小细胞肺癌的发生发展中起重要作用,可作为诊断和预后的生物标志物及治疗靶点,如MCM3AP-AS1[8]、LINC00680[9]、LINC02159[10]。研究显示,在胃癌组织和细胞中DCST1-AS1 呈高表达,下调DCST1-AS1 可抑制胃癌细胞增殖、侵袭和迁移[11]。DCST1-AS1 在三阴性乳腺癌组织和细胞中的表达上调,与远处转移和组织病理学分级呈正相关[12]。在肝癌组织中,DCST1-AS1 的高表达与肿瘤大小和生存时间密切相关,敲低DCST1-AS1 可降低体外肝癌细胞的增殖能力,促进细胞凋亡[13]。以上研究表明DCST1-AS1可作为癌基因参与肿瘤的发生和发展。
在本研究中,DCST1-AS1 在非小细胞肺癌组织中呈高表达,且其高表达与非小细胞肺癌患者的TNM 分期、组织分化程度、淋巴结转移及病理类型相关,提示DCST1-AS1 在非小细胞肺癌中可能发挥促癌作用。已知癌细胞的转移是导致患者死亡的关键因素[14]。本研究结果显示,下调DCST1-AS1后,A549细胞的增殖、迁移和侵袭能力均降低,提示DCST1-AS1 可能是非小细胞肺癌治疗的潜在分子靶标。
上皮-间质转化是细胞失去上皮细胞极性得到间质特性的一个过程,在此过程中,上皮标志物E-cadherin表达降低,而间质标志物Vimentin、N-cadherin表达升高[15]。肿瘤细胞发生上皮-间质转化过程中,细胞间黏附力会降低,进而促进细胞迁移和侵袭[16]。研究显示,lncRNA 可通过调控肿瘤细胞上皮-间质转化过程影响非小细胞肺癌细胞迁移和侵袭[17-18]。本研究结果显示,下调DCST1-AS1 表达后,A549 细胞中E-cadherin 表达升高,Vimentin 和N-cadherin 表达降低,提示下调DCST1-AS1 可抑制上皮-间质转化过程,进而降低A549细胞的迁移和侵袭能力。
miRNA 具有调节细胞增殖、凋亡、迁移和侵袭的功能,已成为包括非小细胞肺癌在内的肿瘤诊断和治疗的特异性靶点[19]。研究表明,miR-29b 与非小细胞肺癌的发生、发展密切相关[7,20],且miR-29b是DCST1-AS1 的靶基因[6]。本研究结果显示,miR-29b在非小细胞肺癌组织和细胞中均呈低表达,与DCST1-AS1 的表达趋势相反,且下调DCST1-AS1 表达后,A549 细胞中miR-29b 的表达水平升高。因此,推测miR-29b可能介导DCST1-AS1在非小细胞肺癌中的作用。为了验证此推测,本研究在下调DCST1-AS1 表达的基础上,采用miR-29b inhibitor 转染来抑制miR-29b 表达,结果显示,敲低miR-29b 表达可减弱下调DCST1-AS1 对A549 细胞恶性生物学行为的抑制作用。提示下调DCST1-AS1可能通过上调miR-29b表达来抑制非小细胞肺癌细胞的恶性生物学行为。
综上所述,在非小细胞肺癌组织中DCST1-AS1 呈高表达,且与患者临床特征相关,敲低DCST1-AS1 可抑制非小细胞肺癌细胞的恶性生物学行为,其作用机制与上调miR-29b 表达有关。DCST1-AS1 可能是非小细胞肺癌治疗的潜在分子靶点,但DCST1-AS1 的表达水平是否与非小细胞肺癌患者的预后有关将在后续的研究中进行分析。

