不同术前营养评分系统在肝细胞癌切除术预后评估中的意义
陆 明,胡孔旺,涂从银
(1. 中国科学技术大学附属第一医院西区普外科,安徽 合肥 230031;2. 安徽医科大学第一附属医院普外科,安徽 合肥 230022)
肝癌是临床上常见的恶性肿瘤,2020 年全球新发肝癌患者约91 万例,死亡约83 万例,分别占恶性肿瘤的第六位和第三位,其中肝细胞癌占肝原发肿瘤的70%~80%[1-2]。目前肝切除术仍然是治疗原发性肝细胞癌的首选方法,但由于术后的高复发率和并发症发生率,患者的预后仍不理想[3]。因此,寻找影响患者术后预后的因素具有重要的临床意义。近年来,营养和炎症指标对肝细胞癌患者预后的影响受到广泛关注[4-5]。炎症产生的活性氧及活性氮等物质可破坏DNA 大分子、蛋白质和脂质等结构,导致其功能障碍,从而发挥致癌作用[6]。而营养不良不仅会损害免疫系统,抑制细胞介导的免疫功能,导致防疫功能的减弱及丧失,增加癌症复发和转移的可能性,还会显著增加术后并发症的发生率[7-8]。预后营养指数(prognostic nutritional index,PNI)、控制营养状态评分(controlling nutritional status,CONUT)、那不勒斯预后评分(Naples prognostic score,NPS)是临床常用的3 种营养评分系统,目前这3 种营养评分系统与肝细胞癌切除术患者生存预后之间的关系尚未明确。因此,本研究拟探讨术前PNI、CONUT、NPS 与肝细胞癌切除术患者临床病理特征及预后的关系,以及这3 种营养评分系统对肝细胞癌切除术患者预后的预测能力。
1 资料与方法
1.1 临床资料
选择2016 年1 月至2019 年12 月于中国科学技术大学附属第一医院行肝细胞癌根治性切除术的122例肝细胞癌患者为研究对象。纳入标准:①行肝细胞癌根治性切除术;②术后经病理证实为肝细胞癌;③随访资料及病理资料完整。排除标准:①合并其他原发肿瘤;②死亡原因与原发肿瘤无关。
1.2 方法
收集患者一般资料,包括:年龄、性别、BMI、肿瘤大小、肿瘤数目、微血管侵犯(microvascular invasion,MVI)、术后住院时间、术后并发症等临床资料。根据术前1 周内的血清白蛋白、血红蛋白、胆固醇、外周血淋巴细胞计数、单核细胞计数、中性粒细胞计数、甲胎蛋白水平计算PNI、CONUT 及NPS,PNI=血清白蛋白值(g/L)+5×外周血淋巴细胞总数(×109/L),CONUT 及NPS评分为各项分值之和,评分标准见表1、2。

表1 CONUT评分标准
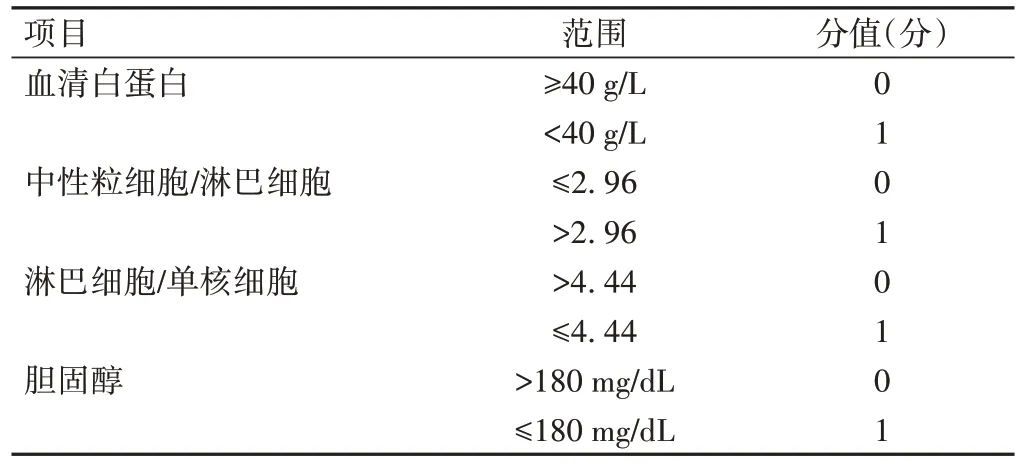
表2 NPS评分标准
采用受试者工作特征(receiver operating characteristic,ROC)曲线计算约登指数,约登指数=敏感度+特异度-1,约登指数最大时对应的PNI、CONUT、NPS 值为最佳截断值。本研究应用生存结局作为终点绘制ROC曲线,所对应PNI、CONUT、NPS 的最佳截断值分别为50.775、2.500、2.500,根据结果将患者分为高PNI 组(≥51)及低PNI 组(<51)、高CONUT 组(≥3)及低CONUT 组(<3)、高NPS组(≥3)及低NPS组(<3)。
1.3 统计学分析
应用SPSS 22.0 统计软件进行数据分析,符合正态分布的计量资料用均数±标准差(±s)表示,组间比较采用t检验;计数资料以频数表示,组间比较采用χ2检验;Kaplan-Meier曲线评估患者生存率,行log-rank检验。用Cox比例风险模型进行单因素和多因素分析。绘制ROC曲线并计算曲线下面积(area under the curve,AUC)以评估不同营养评分系统的预测能力。以P<0.05为差异有统计学意义。
2 结果
2.1 术前PNI、CONUT、NPS 与肝细胞癌患者临床病理特征的关系
术前PNI 与肿瘤分化程度、MVI、肝硬化、术前血红蛋白水平有关(P<0.05);术前CONUT 与肿瘤分化程度、肝硬化、术前血红蛋白水平有关(P<0.05);术前NPS 与肝硬化、术前血红蛋白水平有关(P<0.05)。低PNI 组、高CONUT 组、高NPS 组分别较高PNI 组、低CONUT组、低NPS组术后住院时间更长、术后并发症发生率更高,差异均具有统计学意义(P<0.05),见表3。
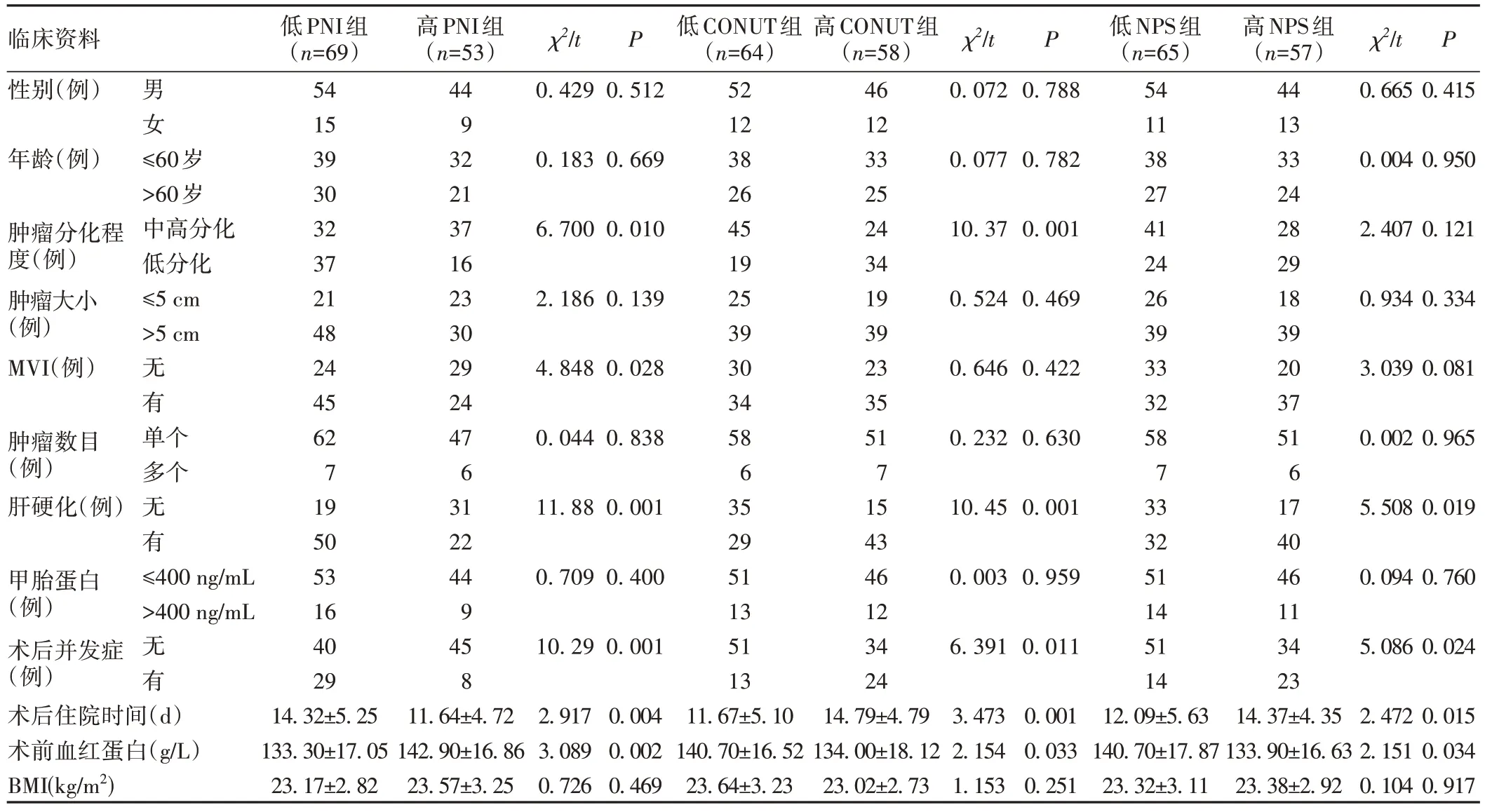
表3 术前PNI、CONUT、NPS与肝细胞癌患者临床病理特征的关系
2.2 不同营养评分系统的预测效能评估
计算不同营养评分系统预测总体生存的AUC,结果显示,PNI、CONUT、NPS 的AUC分别为0.718(95%CI: 0.626~0.811,P<0.001)、 0.707(95%CI:0.615~0.800,P<0.001)、0.722(95%CI:0.631~0.813,P<0.001),提示NPS 评分系统在肝细胞癌患者术后生存的预测效能方面优于PNI、CONUT,见图1。
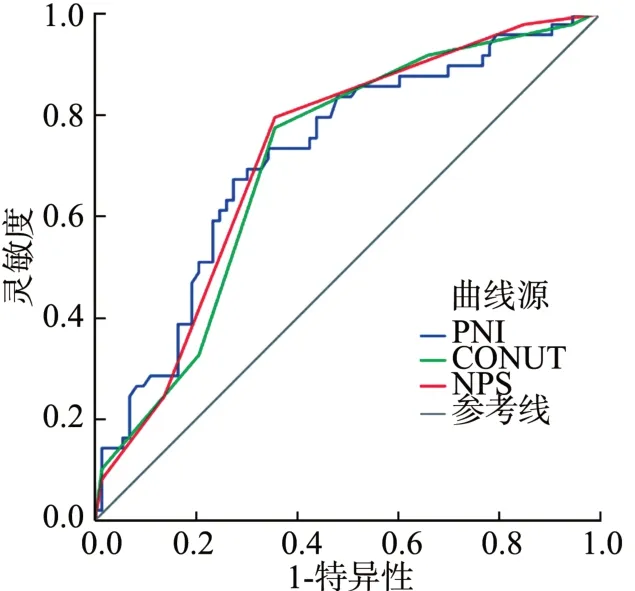
图1 术前PNI、NPS、CONUT 预测肝细胞癌切除术后患者总体生存的ROC曲线
2.3 不同术前PNI、CONUT和NPS的肝细胞癌患者的术后生存情况
患者术后随访时间为9~73 个月,中位随访时间36.5个月。其中,低PNI组、高PNI组患者中位总生存期(overall survival,OS)分别为36个月、65个月,高PNI组患者的生存率明显高于低PNI组(χ2=13.403,P<0.001);低CONUT 组、高CONUT 组患者中位OS 分别为66 个月、35 个月,低CONUT 组患者的生存率明显高于高CONUT 组(χ2=14.550,P<0.001);低NPS 组、高NPS 组患者中位OS分别为65个月、34个月,低NPS组患者的生存率明显高于高NPS 组(χ2=16.694,P<0.001),见图2。

图2 PNI、CONUT、NPS分组与肝细胞癌患者预后的Kaplan-Meier生存曲线
2.4 影响生存时间的独立危险因素
将总生存率进行单因素Cox回归分析发现,肿瘤分化程度、肿瘤大小、MVI、肿瘤数目、肝硬化、甲胎蛋白及术前PNI、CONUT、NPS 与肝细胞癌患者的预后相关(P<0.05);多因素Cox回归分析发现,肿瘤分化程度、肿瘤大小、MVI、肿瘤数目、甲胎蛋白、术前NPS是影响肝细胞癌患者预后的独立危险因素(P<0.05),见表4。

表4 影响肝细胞癌预后的单因素及多因素分析
3 讨论
越来越多的证据表明,恶性肿瘤的进展不仅与肿瘤自身状态有关,也受宿主营养、炎症和免疫状态等的影响[9-10]。PNI评估内容包含血清白蛋白和淋巴细胞数,最早用于评估胃肠道肿瘤患者的营养和免疫状态,是一种简单且实用的反映机体全身炎症反应的指标[11]。CONUT 评估内容包含血清白蛋白、淋巴细胞数和总胆固醇,相比PNI,增加了总胆固醇成分。胆固醇作为细胞膜的重要组成部分,不仅反映了热量的摄入情况,而且也参与肿瘤的发生、发展和免疫应答等相关过程[12-13]。NPS是一个新的评分系统,评估内容包括血清白蛋白、总胆固醇、中性粒细胞/淋巴细胞比值、淋巴细胞/单核细胞比值,相比PNI 和CONUT 更加全面地反映了患者的营养和免疫应答状况。
本研究探讨了术前PNI、CONUT、NPS 预测肝细胞癌患者术后预后的价值,结果显示,术前PNI、CONUT、NPS 均与术后住院时间及并发症密切相关;术前营养状况越好,术后住院时间越短,且并发症发生率越低;术前PNI、CONUT、NPS 均为肝细胞癌患者OS 的影响因素。既往Saito 等[14]研究得出,高PNI 组肝细胞癌患者的术后并发症发生情况及术后恢复情况均优于低PNI 组。Wang 等[5]通过大样本系统荟萃分析研究发现,CONUT 高的患者术前免疫功能(CD3+CD4+、CD3+CD8+、IgG 和IgM)明显较CONUT 低的患者更差,总并发症发生率也显著更高,住院时间显著更长。NPS是目前新提出的评分系统,多项研究表明其在食管癌、胃癌、结直肠癌、胰腺癌等消化道肿瘤的短期及长期预后的预测中有着重要的意义,但关于其对肝细胞癌切除术患者预后的影响研究较少[15-18]。因此,在临床中,对于术前低PNI、高CONUT 和高NPS 患者,需要更加关注营养状况的改善,术后早期需要更仔细的护理及治疗,以降低并发症风险及缩短术后住院时间。
本研究结果显示,术前NPS 是影响肝细胞癌患者术后预后的独立危险因素,且NPS 的AUC较PNI、CONUT 更高,提示NPS在肝细胞癌患者术后生存的预测效能方面优于PNI、CONUT。NPS 包含了较PNI 和CONUT 更全面的营养和炎症指标,其中血清白蛋白和总胆固醇都是反映人体营养状况的重要指标[19],与营养不良的程度密切相关。白蛋白不仅是营养指标,也是全身炎症的参数[20],术前白蛋白水平降低提示患者预后较差。胆固醇在膜流动性和蛋白质活性方面发挥着重要的作用,低胆固醇水平在很大程度上削弱了细胞膜的流动性,并损害细胞表面受体传递跨膜信号的能力[21],与癌症的发生和发展有潜在的关系[22],因此胆固醇水平下降可能提示患者预后不佳。癌症在发生、发展过程中会触发局部炎症反应,释放促炎细胞因子,导致炎症微环境形成,肿瘤细胞通常会通过削弱抗原呈递作用,释放免疫抑制因子,诱导免疫耐受以及募集有肿瘤支持的免疫细胞来诱导免疫抑制微环境的形成,而中性粒细胞能通过抑制淋巴细胞介导的细胞溶解作用,促进肿瘤血管的生成并创造适合肿瘤生存的微环境[23]。淋巴细胞可以通过分泌一系列细胞因子进行癌症的免疫监测,进而抑制肿瘤的生长,故淋巴细胞在肿瘤免疫微环境中对肿瘤细胞的生长具有调节作用;但在癌症患者中,促炎细胞因子的释放会引起淋巴细胞减少,故不能产生足够的免疫应答反应[24]。研究发现,血液中的单核细胞可以在癌组织中募集,并有可能分化为肿瘤相关巨噬细胞,而肿瘤相关巨噬细胞是维持肿瘤微环境、促进癌细胞增殖及远处转移的关键因素[25]。因此,外周血单核细胞的增加可能代表了癌症高负荷状态。
综上,营养不良会延长住院时间,增加术后并发症发生率,加速肿瘤进展,缩短生存时间。术前NPS与肝细胞癌切除术患者的预后密切相关,是评估患者预后的潜在指标。因此,肝细胞癌患者术前应接受营养筛查,评估营养不良风险,制定最合理的营养干预手段。

