Epac1 对垂体腺瘤细胞增殖和细胞周期的影响及分子机制研究
孙 炜,王俊文,李 然,黄逸民,张 卓,雷 霆(华中科技大学同济医学院附属同济医院神经外科,湖北 武汉 430030)
垂体腺瘤(pituitary adenoma,PA)起源于垂体前叶,是第三大常见的中枢神经系统肿瘤,是蝶鞍最常见的病变,占所有中枢神经系统肿瘤的10%[1-2]。大多数PA 为散发,且65%以上为功能性PA 或激素分泌型PA,即使没有发生转移,也会导致激素分泌过多或分泌不足、视觉缺陷以及其他残疾等[3]。功能性生长激素垂体腺瘤(functional growth hormone-secreting pituitary adenoma,fGH-PA)是PA 最重要的一种形式,其分泌生长激素和生长激素释放激素,引起生长激素细胞增生和生长激素过量释放[4]。成年人生长激素过量会导致肢端肥大症;年轻人若在骨骺尚未闭合时开始发病,会导致身材高大或巨人症。
细胞周期检查点失调、细胞发生持续增殖是PA生长的主要驱动因素,高达80%的PA 存在G1/S 期检查点失调[5]。cAMP 直接激活的交换蛋白1(exchange protein 1 directly activated by cAMP,Epac1)是一种新发现的cAMP 效应器蛋白,在癌症中具有双重功能,可促进或抑制癌症的形成和进展[6]。cAMP 反应元件结合蛋白(cAMP response element-binding protein,CREB)是一种具有cAMP 响应元件的转录因子,可通过下游多种通路改变细胞周期进程。本研究通过测定PA 组织临床样本中Epac1 的表达水平和体外实验,探讨Epac1通过磷酸化CREB引起细胞周期检查点失调、促进PA细胞增殖的分子机制。
1 材料与方法
1.1 主要材料与试剂
大鼠视网膜永生化细胞系RGC-5 细胞、大鼠泌乳素瘤细胞系MMQ 细胞、大鼠垂体瘤细胞系GH3 细胞、Ham's F-12K 培养液购自武汉普诺赛生物科技有限公司。TRIzol 裂解缓冲液(批号:2792739)、RIPA 裂解和提取缓冲液(批号:YJ378720)、胎牛血清(fetal bovine serum,FBS;批号:2831969RP)、DMEM 培养液(批号:2797239)、Lipofectamine 3000 脂质体(批号:2754186)购自美国赛默飞世尔科技公司。马血清购自上海酶研生物科技有限公司。FastKing RT Kit(批号:116502396)、SuperReal PreMix Plus (SYBR Green) Kit(批号:205709634)购自天根生化科技有限公司。一抗(兔抗人单抗):Epac1(批号:107789164)、p-CREB(批号:109645324)、CREB(批号:315769455)、Cyclin D1(批号:164389790)、CDK2(批号:324758912)、p21(批号:521467936)、β-actin(批号264683965)购自美国Abcam 公司。山羊抗兔IgG(H+L)HRP 二抗(批号:LK7046567915)购自杭州联科生物科技有限公司。细胞周期检测试剂盒(PI/RNase A Staining;批号:DJD45762318)购自日本Dojindo生物公司。
正置光学显微镜(型号:ECLIPSE Ti2)购自日本Nikon 株式会社,流式细胞仪(型号:CytoFLEX SRT)购自贝克曼库尔特商贸(中国)有限公司,酶标仪(型号:Sunrise)购自帝肯(上海)实验器材有限公司。
1.2 临床样本收集
收集2019 年8 月至2021 年7 月我院12 例肢端肥大症患者的fGH-PA 组织。其中男7 例,女5 例;年龄26~56 岁,中位年龄39 岁。纳入标准:年龄在18 岁及以上;基于临床特征和生化证据确诊为肢端肥大症;磁共振成像显示蝶鞍内有垂体瘤;经2 h 口服葡萄糖耐量试验后未抑制的生长激素低于0.4 μg/L;胰岛素样生长因子-1(insulin like growth factor-1,IGF-1)水平超过正常上限的1.3 倍;距离最近一次垂体手术已有3 个月以上。
1.3 qPCR
使用TRIzol裂解缓冲液在液氮中研磨并裂解组织或细胞,提取组织及细胞总RNA。使用FastKing RT Kit 试剂盒合成cDNA。使用SuperReal PreMix Plus(SYBR Green)Kit 进行qPCR 扩增。引物序列(5'-3'):Epac1 正向GCTGGCTCCTTCGTCTGAG,Epac1 反向G CTGGCTCCTTCGTCTGAG;GAPDH 正向ATGGGCAG CCGTTAGGAAAG,GAPDH 反向AGGAAAAGCATCA CCCGGAG。
1.4 免疫组织化学
手术获得fGH-PA 样本后,立即浸没于10%中性福尔马林缓冲液中,4 ℃下固定超过48 h 后进行石蜡包埋和切片。切片经二甲苯脱蜡和梯度乙醇水化后,常规使用微波炉进行抗原修复。向切片滴加3%的双氧水,于室温避光封闭30 min;向切片滴加封闭缓冲液,于室温封闭1 h;向切片滴加Epac1 一抗工作液,于4 ℃孵育过夜;次日向切片滴加二抗山羊抗兔IgG(H+L)HRP 工作液,于室温孵育1 h。向切片滴加生物素底物,于室温孵育30 min;向切片滴加1×DAB 显色液,避光显色5~10 min,于光学显微镜下观察并拍照。
1.5 细胞培养
RGC-5 细胞培养于含10.0% FBS 和100 UI/mL 青霉素-链霉素的DMEM 培养液中;MMQ 细胞和GH3 细胞培养于含2.5% FBS、15.0%马血清和100 UI/mL 青霉素-链霉素的Ham's F-12K 培养液中,置于37 ℃恒温湿润的CO2孵育箱中维持培养。
1.6 Western blot
使用含蛋白酶抑制剂和磷酸酶抑制剂的RIPA 裂解和提取缓冲液,在液氮中研磨并裂解组织或细胞,提取总蛋白。采用含10.0%脱脂奶粉的TBS-T缓冲液封闭PVDF 膜。向膜上滴加一抗工作液并于4 ℃孵育过夜。次日,向膜上滴加二抗工作液并于室温孵育1 h。使用ECL 超敏化学发光底物对目的条带进行显影。使用Image J v 1.8.0对图像进行灰度分析。
1.7 转染
使用GH3细胞进行转染,过表达或敲低Epac1,或敲低CREB。使用Lipofectamine 3000 脂质体进行转染。转染结束48 h 后,检测下游指标。对于过表达Epac1实验,分别向细胞转染pcDNA3.1空质粒(Vector组)或pcDNA3.1-Epac1 质粒(Epac1-OE 组),未做任何转染处理的细胞为Control组。为了扩增Epac1开放阅读框(open reading frame,ORF)完整序列,使用引物对Epac1 ORF-正向引物5'-CCCCTTATCAAAGCTGATG-3',Epac1 ORF-反向引物5'-CTAATCCTGCAAAAGAATA-3'扩增Epac1,并将其插入pcDNA3.1载体中,构建Epac1过表达载体。对于敲低Epac1 实验,分别向细胞转染Epac1 shRNA(Epac1 shRNA 组)或shRNA NT(shRNA NT 组),未做任何转染处理的细胞为Control 组。Epac1 shRNA 序列为5'-GCAGTGCTGCTCTGGCCGG-3';shRNA NT 序列为5'-CACGGTCTGACACTGACTG-3'。对于敲低CREB 实验,分别向细胞转染CREB shRNA(CREB shRNA 组)或shRNA NT-2(shRNA NT-2组),未做任何转染处理的细胞为Control组。CREB shRNA 序列为5'-ACGGAGGAGCTTGTA CCAC-3';shRNA NT-2序列为5'-CAGACTGTGCT AGACAATG-3'。
1.8 流式细胞术
将6 孔板中的各组细胞制备为单细胞悬液,每0.5 mL 单细胞悬液中加入5 mL 冰预冷的70.0%乙醇,于4 ℃固定细胞过夜。次日,以800 r/min 离心15 min,收集固定好的细胞;加入0.5 mL PBS 重悬细胞。向单细胞悬液中加入终浓度为50 μg/mL 的RNase A,将细胞置于37 ℃水浴中孵育30 min。加入终浓度为65 μg/mL 的PI,于冰浴中避光孵育30 min。然后上机流式细胞仪测定细胞周期。
1.9 CCK-8法测定细胞增殖能力
使用CCK-8 细胞增殖及细胞毒性检测试剂盒进行测定。实验操作步骤参照说明书进行。使用酶标仪在450 nm处测定光密度(optical density, OD)值。
1.10 统计学处理
使用GraphPad Prism v8统计学软件对数据进行分析。计量数据以均数±标准差(±s)表示。2 组间比较采用t检验;多组间比较采用单因素方差分析。P<0.05为差异具有统计学意义。
2 结果
2.1 Epac1 在人fGH-PA 组织和大鼠垂体瘤细胞系中过表达
与旁侧正常组织相比,fGH-PA 组织中Epac1 mRNA 的表达水平明显增高(P<0.05),见图1a;在fGH-PA组织中Epac1蛋白免疫组织化学着色明显增强(P<0.05),见图1b。与RGC-5 细胞相比,MMQ 细胞和GH3 细胞中Epac1 mRNA和蛋白的表达水平均明显升高(P<0.05),见图1c。

图1 Epac1 mRNA和蛋白在fGH-PA组织和大鼠垂体瘤细胞系中的表达
2.2 过表达Epac1上调p-CREB 促进大鼠垂体瘤细胞周期失调和大量增殖
与Control 组相比,Epac1-OE 组G0/G1 期和S 期细胞占比明显减少(P<0.05),G2/M期细胞占比明显增多(P<0.05);Vector组G0/G1期、S期和G2/M 期细胞占比无明显差异(P>0.05),见图2a、b。与Control 组相比,Epac1-OE 组细胞增殖能力明显增强(P<0.05);而Vector 组细胞增殖能力无明显差异(P>0.05),见图2c。与Control 组相比,Epac1-OE 组细胞内p-CREB、Cyclin D1 的表达水平明显升高(P<0.05),CDK2 和p21 的表达水平明显降低(P<0.05),CREB 的表达水平无明显变化(P>0.05);而Vector 组细胞内上述蛋白的表达水平无明显差异(P>0.05),见图2d~f。
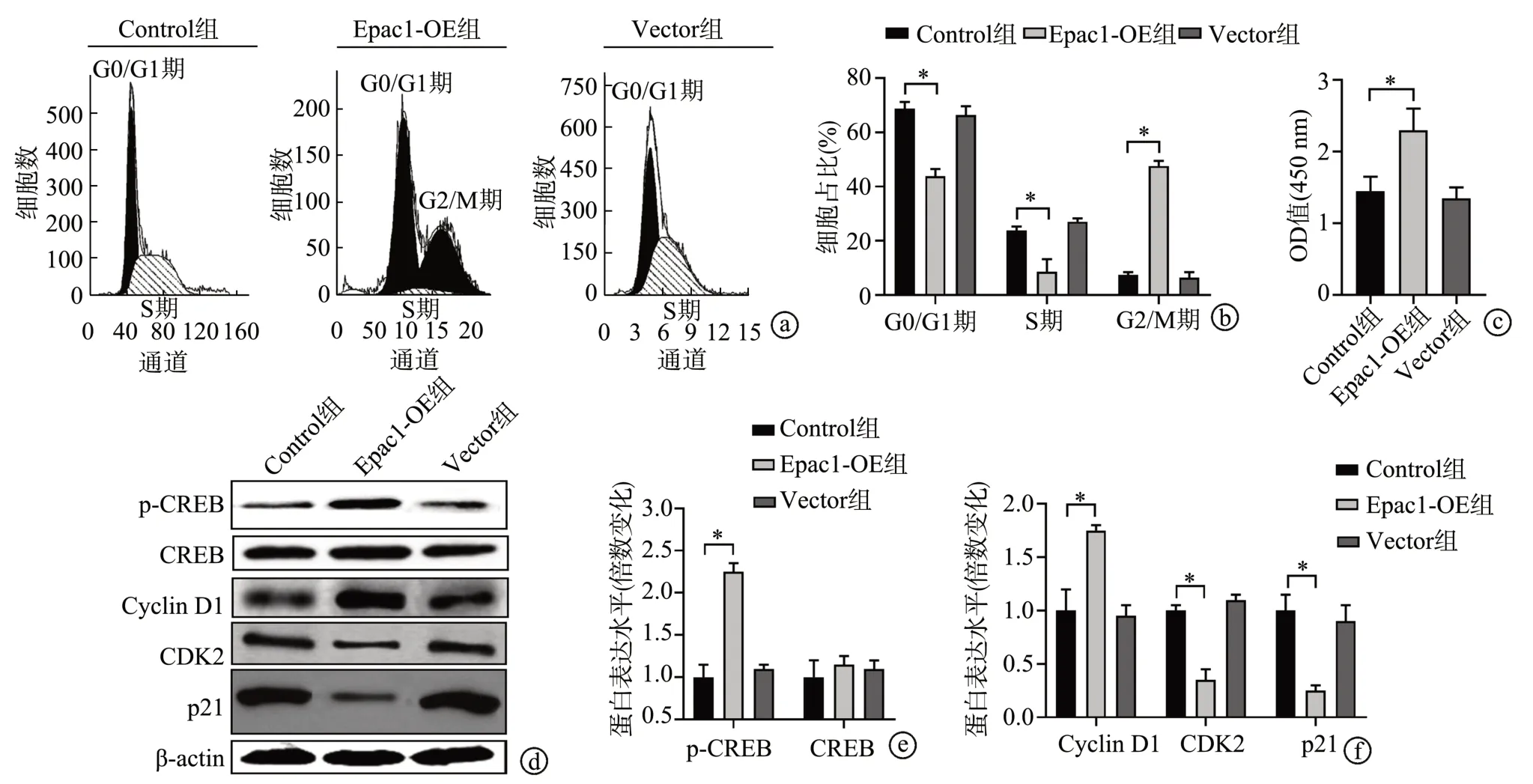
图2 过表达Epac1前后细胞周期及其相关蛋白和细胞增殖能力变化测定
2.3 敲低Epac1 抑制大鼠垂体瘤细胞周期失调和大量增殖
与Control组相比,Epac1 shRNA组G0/G1期细胞占比明显增多(P<0.05),S期细胞占比明显减少(P<0.05),G2/M 期细胞占比无明显差异(P>0.05);shRNA NT 组G0/G1期、S期和G2/M期细胞占比无明显差异(P>0.05),见图3a、b。与Control组相比,Epac1 shRNA组细胞增殖能力明显减弱(P<0.05);而shRNA NT 组细胞增殖能力无明显差异(P>0.05),见图3c。与Control 组相比,Epac1 shRNA 组细胞内p-CREB 和Cyclin D1 的表达水平明显降低(P<0.05),CDK2 和p21 的表达水平明显升高(P<0.05),CREB 的表达水平无明显差异(P>0.05);而shRNA NT 组细胞内上述蛋白的表达水平无明显差异(P>0.05),见图3d~f。
2.4 敲低CREB 抑制大鼠垂体瘤细胞周期失调和大量增殖
与Control 组相比,CREB shRNA 组G0/G1 期细胞占比明显增多(P<0.05),S期细胞占比明显减少(P<0.05),G2/M 期细胞占比无明显差异(P>0.05);shRNA NT-2组G0/G1 期、S 期和G2/M 期细胞占比无明显差异(P>0.05),见图4a、b。CREB shRNA 组细胞增殖能力明显减弱(P<0.05);而shRNA NT-2 组细胞增殖能力无明显差异(P>0.05),见图4c。与Control 组相比,CREB shRNA 组细胞内p-CREB、CREB 和Cyclin D1 的表达水平明显降低(P<0.05),CDK2 和p21 的表达水平明显升高(P<0.05);而shRNA NT-2 组细胞内上述蛋白的表达水平无明显差异(P>0.05),见图4d~f。
3 讨论
Epac1 与多种肿瘤的恶性增殖相关。锂和Epac1特异性抑制剂ESI-09 协同抑制胰腺癌细胞增殖和存活[7]。Epac1 在低级别神经胶质瘤中的分泌水平高于其在高级别神经胶质瘤中的分泌水平,并参与神经胶质瘤的发展[8]。过表达RBM10 通过抑制Epac1 的激活抑制肺腺癌细胞增殖[9]。本研究也发现,Epac1 在人fGH-PA组织和大鼠垂体瘤细胞中高表达。
CREB 磷酸化和异常活化可促进癌细胞增殖。CREB 在食管鳞状细胞癌组织中高表达,并与食管癌患者的淋巴结转移和肿瘤-淋巴结转移-远端转移分期呈正相关。下调CREB 的表达可有效抑制体外和体内食管癌细胞生长,诱导癌细胞S期周期停滞,引发细胞凋亡并抑制细胞迁移和侵袭[10]。PAK1 对于许多癌症的发生和发展至关重要。在人非小细胞肺癌组织中发现,PAK1与CREB 的表达水平均升高,并且PAK1通过磷酸化CREB 促进癌细胞增殖[11]。在弥漫性恶性间皮瘤组织中,Aki1 高表达并通过Aki1/AKT/p-CREB轴促进癌细胞增殖[12]。本研究结果显示,在GH3 细胞中过表达Epac1 能够上调CREB 的磷酸化水平,敲低Epac1 能够下调CREB 的磷酸化水平,上调p-CREB 能够促进细胞通过G1/S 期检查点并大量增殖。这是一项新的发现,即在人fGH-PA 组织和大鼠垂体瘤细胞中高表达的Epac1 是通过上调CREB 的磷酸化水平促进癌细胞G1/S 期检查点失调并增殖。与此同时,本研究中敲低CREB 抑制大鼠垂体瘤细胞周期失调和大量增殖的结果也进一步佐证了上述结论。
细胞周期相关蛋白Cyclin D1、CDK2、p21 是关键的G1/S 期检查点蛋白[13]。Cyclin D1 可以直接与基因组DNA 结合,作为转录因子激活或下调基因表达,在肿瘤发生和发展过程中发挥关键的促癌细胞增殖作用[14]。组成型激活的Rac1 上调p-AKT 和Cyclin D1,诱导癌细胞增殖[15]。细胞周期蛋白依赖性激酶(Cyclindependent kinases,CDKs)能够加强对细胞周期S 期的控制并抵消DNA 损伤诱导的细胞周期停滞[16]。AKT通过上调TopBP1 的磷酸化水平绕过CDK2 对G1/S 期的管控,增强DNA 复制并通过S 期,促进癌细胞增殖[17]。细胞对S 期管控失控会引发癌细胞大量增殖。有研究显示,p21/p27 轴为G1/S 期转换的关键检查点通路,且该通路在许多癌症中被劫持,使癌细胞维持不受控制的增殖状态[18]。Suv4-20h1 通过下调慢性髓性白血病K562 细胞中p21WAF1/CIP1的表达促进癌细胞由G1 期向S 期转变[19]。即癌细胞可通过上调Cyclin D1,抑制CDK2 和p21 的表达,通过G1/S 期检查点并恶性增殖。本研究结果显示,过表达Epac1 引起的p-CREB水平上调能够引起CDK2 和p21 的表达下调及Cyclin D1 的高表达,导致癌细胞通过G1/S 期,发生大量增殖。
综上,Epac1 在人fGH-PA 组织中高表达,且在GH3细胞中过表达Epac1能够上调p-CREB的水平,促进GH3细胞通过G1/S期检查点,发生细胞周期检查点失调和癌细胞大量增殖。但研究结论尚需进行在体动物模型水平上的验证实验。

