UHRF1通过WNT/MMP9信号通路抑制结直肠癌细胞的侵袭和迁移
陈志华,郑艳,林素勇,3,陈绍勤
0 引言
结直肠癌是最常见恶性肿瘤之一,发病率仍然高居全球第三,死亡率居全球第二[1-3]。转移是CRC患者疗效不佳和高死亡率发生的重要因素[4-5]。CRC发生发展过程中需要多种不同的表观遗传学机制驱动[6]。类泛素样含PHD和环指域蛋白(ubiquitin-like PHD and ring finger domains,UHRF)1是一个多功能结构域蛋白,能够识别和修饰不同的染色质,从而发挥不同的生物学功能,特别在表观遗传学修饰方面[7]。UHRF1通过运用其特殊的结构域来参与表观遗传标记的传递[8-9]。UHRF1是一种已知的、负责维持细胞表观遗传的蛋白[10-11],被认为与细胞的快速增长和DNA修复密切相关[12-13]。CRC中存在UHRF1过表达现象[14],并与转移和临床分期紧密相关。UHRF1将可能成为一种独立的生物标志物运用于肿瘤检测、进展和防治监测[15]。
课题组前期研究发现U H R F 1 能够被多个miRNA结合而沉默[16-17],有望成为潜在的干预靶点,但具体的下游作用信号传递机制目前暂不明确。本研究旨在探究UHRF1对CRC生物学特性的影响及其可能的相关通路,进一步探讨其与CRC的关系及相关作用机制,为CRC诊断和防治提供新的思路。
1 材料与方法
1.1 组织和细胞来源
从癌症基因组图谱(https://portal.gdc.cancer.gov/)下载并获得结肠腺癌(COAD)、直肠腺癌(READ)和正常结直肠组织的RNA测序数据(HTSeq-Counts 和 HTSeq-FPKM)。在排除总生存期(OS)值缺失或OS时间短(<30天)的患者后,最终纳入了502例具有完整相关临床信息的患者。同时利用该机构收集的(2018年5月—2019年5月)新鲜保存于-80℃的术前未进行放化疗的CRC组织及匹配的超过5 cm范围的正常肠黏膜组织,共112例。该研究通过福建医科大学附属第一医院伦理委员会批准(批号:闽医大附一伦理医研[2019]021号)。
CRC细胞株SW480、HT29、HCT116、LOVO由福建医科大学药学院惠赠。
1.2 主要试剂与仪器
UHRF1抗体(美国Sigma公司),WNT3a、GSK3β、p-β-catenin和MMP9抗体(美国Abcam公司);慢病毒包装载体、UHRF1过表达载体和UHRF1shRNA(上海吉凯生物公司),RPMI 1640培养基(美国Gibco公司),SYBR Green Realtime PCR(日本Takara公司),GAPDH抗体(美国CST公司),PVDF膜(中国Biosharp公司),Transwell小室(美国Thermo Fisher公司)。PCR引物由上海生工生物科技有限公司合成。
倒置荧光显微镜(日本奥林巴斯),Stratagene Mx3000P PCR仪(美国Agilent公司),凝胶成像及分析系统(美国Bio-Rad公司),酶联免疫监测仪(美国Thermo Fisher公司)。
1.3 实验方法
1.3.1 免疫组织化学 冷冻保存的组织取小块石蜡包埋固定, 4 μm厚切片,抗UHRF1抗体以1:200的工作浓度检测组织中UHRF1蛋白的表达。磷酸盐缓冲液冲洗后,加入适量稀释的辣根过氧化物酶标记山羊抗小鼠抗体(工作浓度1:1 000),37℃孵育10~30 min,用磷酸盐缓冲液冲洗。用苏木精对比染色5 min,中性树胶风干。荧光显微镜下观察。
1.3.2 慢病毒转染 构建UHRF1过表达慢病毒和UHRF1敲低(sh-UHRF1)慢病毒载体。SW480细胞用UHRF1过表达慢病毒感染,HCT116细胞用sh-UHRF1慢病毒感染。选择合适的MOI值加入病毒,同时加入共感染剂Polybrene。12 h后更换正常培养基。感染72 h后,在荧光显微镜下观察荧光表达。最后用嘌呤霉素进行细胞抗性筛选,只留下慢病毒感染的细胞,获得稳定表达的细胞系。
1.3.3 Real-time PCR实验 根据试剂盒说明,使用TRIzol试剂从新鲜临床标本组织或者培养的细胞中提取总RNA。反转录试剂盒用于RNA反转录得到cDNA。使用7500 real-time PCR系统进行RT-PCR分析。相对表达式F(倍数变化)= 2-ΔΔCt进行分析和比较。引物设计如下:UHRF1(上游引物:5’-ATGACTCTACCCACGGCAAG-3’;下游引物:5’-CTGGAAGATGGTGATGGGTT-3’);GAPDH(上游引物:5’-CCCTTCATTGACCTCAACTACA TG-3’;下游引物:5’-TGGGATTTCCATTGATGA CAAGC-3 ’。
1.3.4 蛋白质印迹实验 应用细胞裂解液充分裂解并收集总蛋白。制备10%SDS-PAGE凝胶并将60微克/孔蛋白质加入梳状孔中。电泳转染后,将PVDF膜封闭2 h。然后将PVDF膜与抗UHRF1、抗GAPDH、抗WNT3a、抗GSK3β、抗p-β-连环蛋白和抗MMP9在4℃下孵育过夜。用TBST洗涤膜后,将其与辣根过氧化物酶偶联的山羊抗兔IgG(1:5 000)孵育2 h。再次洗膜并浸入适量的ECL试剂以测试凝胶成像系统中的结果。
1.3.5 肿瘤细胞生物学特性检测 EdU增殖实验:将各组细胞按1.5×105个/孔接种于24孔板中。加入制备好的试剂EdU并继续孵育细胞2 h。用聚甲醇固定并渗透液体后,加入Click反应溶液。使用Hoechst 33342进行核染色。在荧光显微镜下观察到所有细胞核都被染成蓝色。
Transwell迁移实验:实验前12 h,将细胞更换为无血清培养基进行预处理。取300 μl细胞悬液加入Transwell小室上层,即每孔6×104个细胞,加入700 μl含20%胎牛血清的培养基井板。在5%CO2和37℃下孵育48 h。用棉签轻轻擦拭室上部的细胞,用PBS清洗,用4%多聚甲醛固定20 min,结晶紫染色液染色30 min。然后在显微镜下观察并拍照。
Transwell侵袭实验:提前将Matrigel胶添加到Transwell小室底部,使其凝胶化。与迁移实验一样,Transwell小室上层加入300 μl细胞悬液,每孔接种9×104个细胞,下孔板加入700 μl含20%胎牛血清的培养基,培养48 h,处理方法同迁移实验。荧光显微镜下观察并拍照。
1.4 统计学方法
采用SPSS22.0软件分析,计数资料的比较采用卡方检验;计量资料用(±s)表示,各计量资料之间组间两两比较时先进行多样本方差齐性检验;若方差齐,则采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 UHRF1在TCGA数据库中的表达及作用
在包括结肠癌和直肠癌在内的绝大部分癌组织的UHRF1 mRNA表达量明显高于对应正常组织,UHRF1在恶性肿瘤的发生发展中可能具有重要的作用(P<0.001),见图1A。UHRF1低表达组总生存期(OS)和疾病相关存活时间(DSS)均明显优于高表达组(P<0.05),UHRF1高表达量是CRC患者不良预后因素,见图1B~C。利用ROC曲线评价UHRF1表达量预测CRC患者生存时间,1、3和5年OS的AUC分别为0.634、0.652和0.771,见图1D,具有良好的生存预后预测作用。
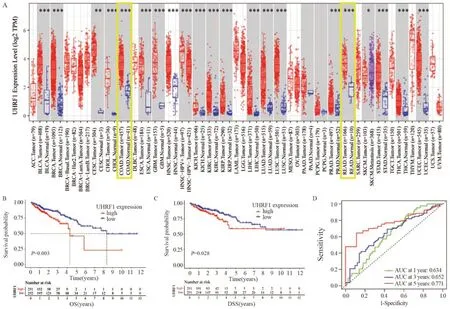
图1 在TCGA数据中UHRF1的表达及与预后的关系Figure 1 Expression of UHRF1 and its relationship with prognosis in TCGA data
2.2 UHRF1在CRC临床样本中的表达
免疫组织化学检测结果显示:UHRF1在CRC癌组织中阳性表达率为72.32%(81/112),在癌旁正常组织中阳性表达率为25.0%(28/112,P<0.05),见图2A~B,表1。RT-PCR结果示UHRF1 mRNA在癌组织中明显高于癌旁组织(P<0.001),见图2C。
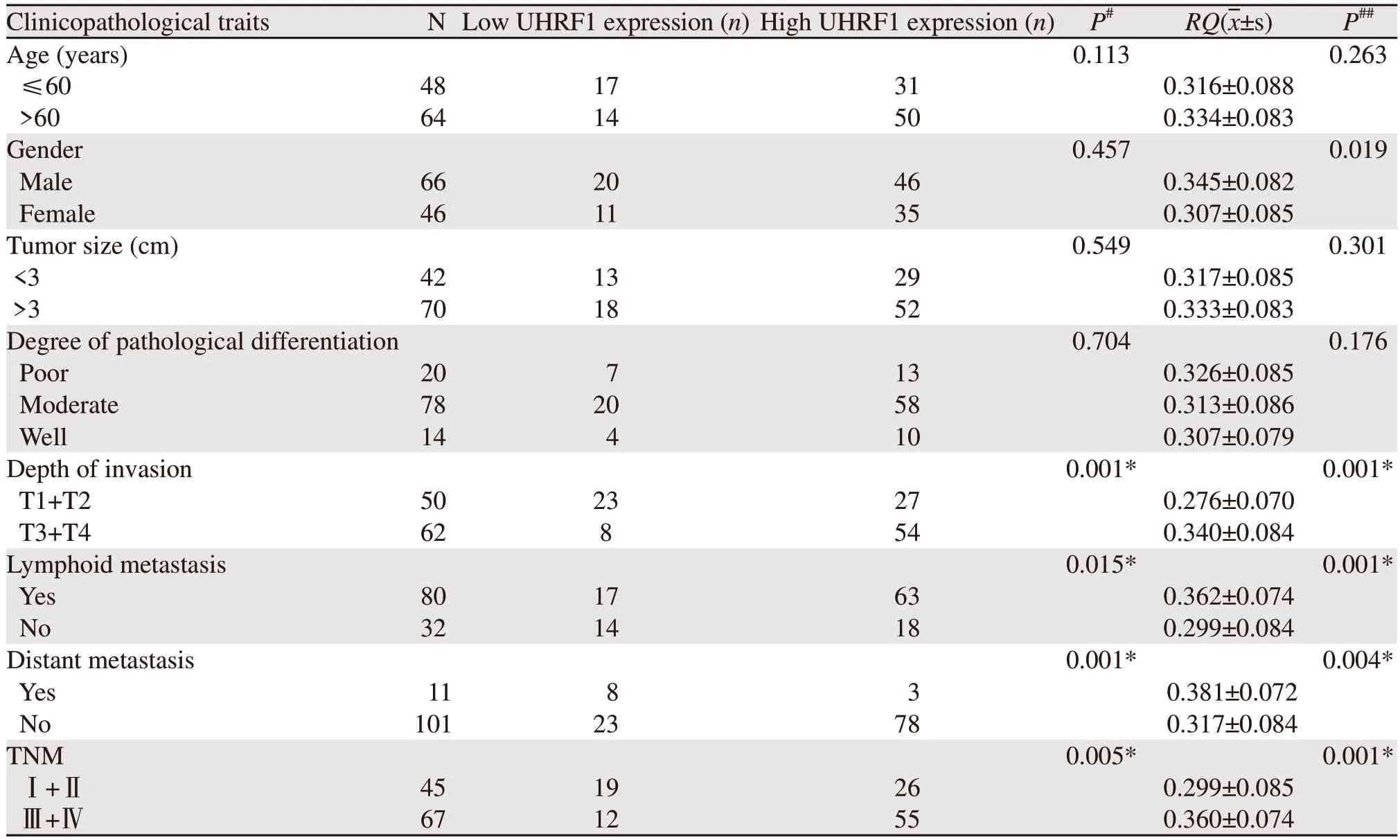
表1 UHRF1表达与CRC患者临床病理特征的关系Table 1 Relationships between UHRF1 expression and clinicopathological characteristics in CRC patients
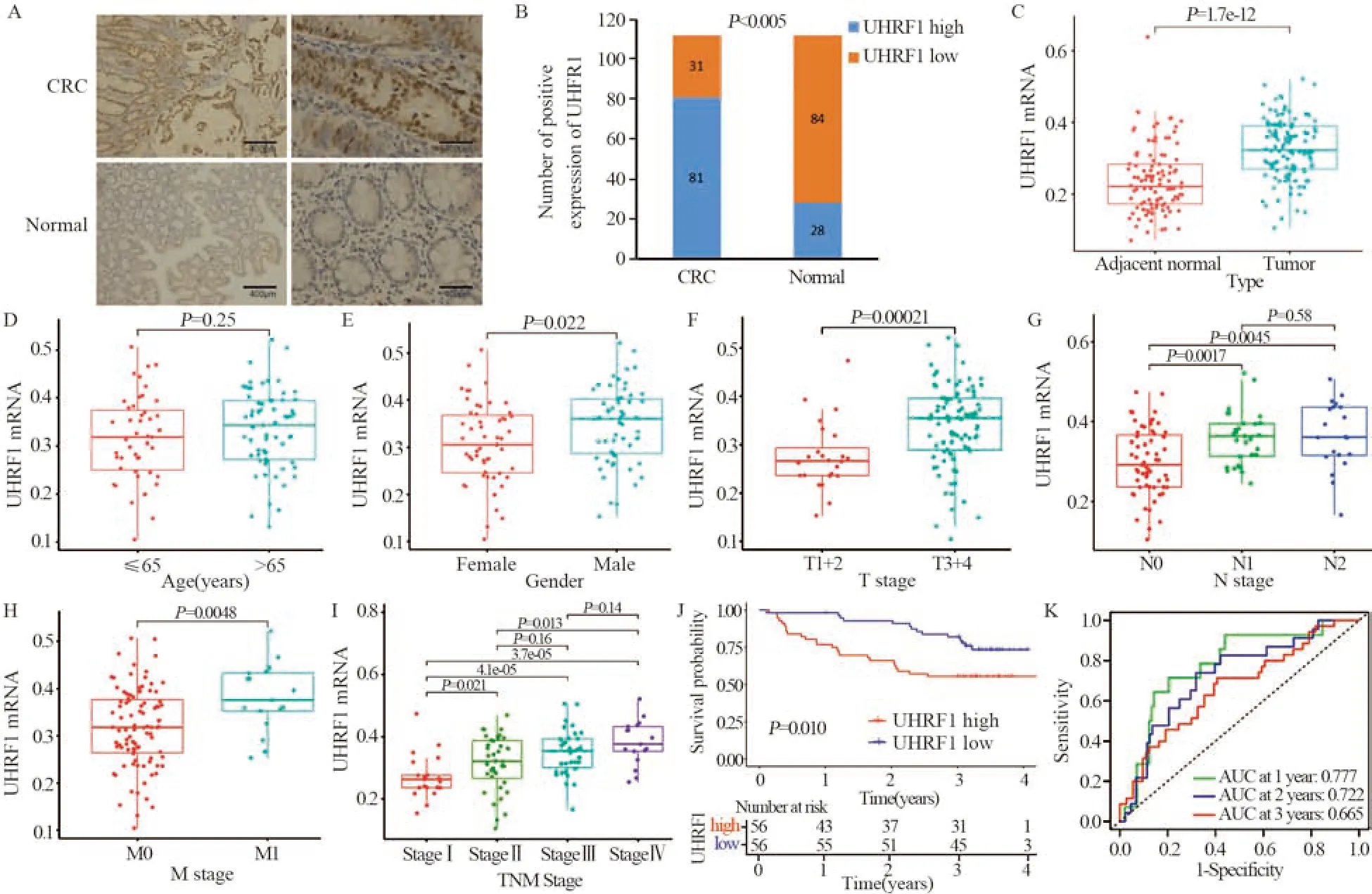
图2 UHRF1在临床样本组织中的表达及其作用Figure 2 Expression of UHRF1 in tissues and its role in the clinical CRC cohort
UHRF1 mRNA表达量男性高于女性(图2E);T3+4组高于T1+2组(图2F);N+组高于N0组(图2G);M1组高于M0组(图2H);且随着T N M 分期升高,表达量也随着升高(图2I),但与年龄无关(P>0.05)见图2D。UHRF1蛋白表达量与肿瘤浸润深度、淋巴结转移、远处转移和TNM 分期有关(P<0.05),与患者性别、年龄、肿瘤位置和肿瘤直径无关(P>0.05),见表1;均提示UHRF1高表达与不良的临床病理特征密切相关。
UHRF1低表达患者的3年OS明显优于高表达患者(P<0.05),见图2J。1、2和3年OS的AUC分别为0.777、0.722和0.665,见图2K,再次验证UHRF1具有良好的预后预测作用。
2.3 CRC细胞株筛选和慢病毒转染结果
检测4株细胞株UHRF1 mRNA和蛋白的表达,UHRF1 mRNA和蛋白表达从高到低分别是HCT116、LOVO、HT29、SW480细胞,见图3A~B。因此选用SW480细胞作为过表达转染载体,HCT116细胞作为敲减转染载体。
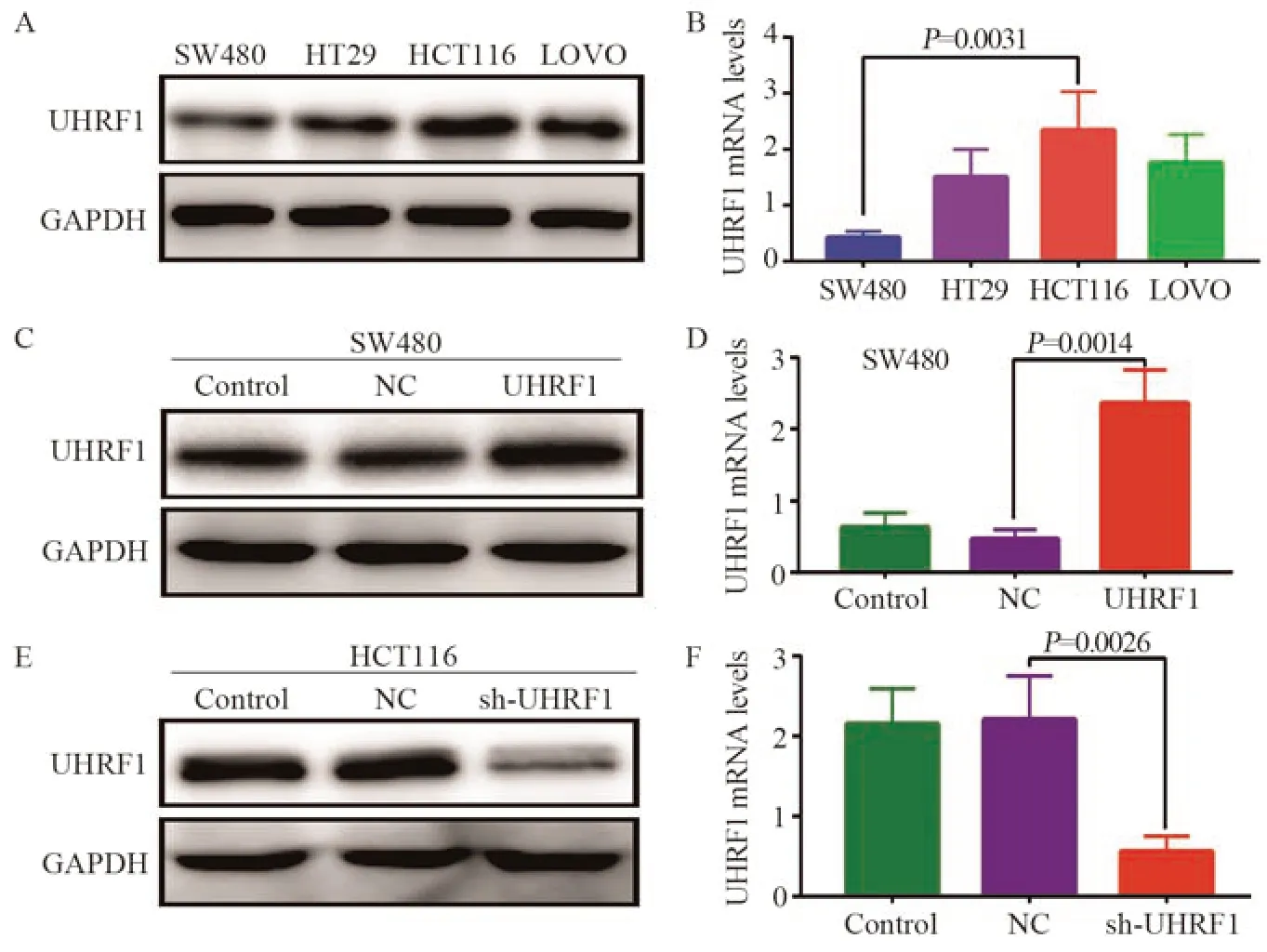
图3 UHRF1 mRNA和蛋白在不同细胞中的表达Figure 3 UHRF1 mRNA and protein expression in different cells
转染后,SW480细胞中UHRF1 mRNA和蛋白表达量明显高于NC组和Control组(P<0.01),证实过表达组细胞株构建成功,见图3C~D。
敲减后,HCT116细胞sh-UHRF1敲减组的UHRF1 mRNA和蛋白的表达量较NC组和Control组明显降低(P<0.01),表明敲减组细胞株构建成功,见图3E~F。
2.4 CRC细胞中UHRF1的表达与WNT/MMP9信号通路的关系
转染过表达后,Western blot结果显示,随着UHRF1表达量的增加,WNT信号通路中关键蛋白WNT3a和GSK3β的表达量增加,而p-β-catenin的表达量显著降低,MMP9表达量增加。在此基础上,加入了IWP-2(WNT拮抗剂),发现原来WNT信号通路中表达增加的相关蛋白均降低,见图4。

图4 CRC细胞中UHRF1调控WNT信号通路相关蛋白的表达Figure 4 UHRF1 regulated the expression of WNT signaling pathway-related proteins in CRC cells
sh-UHRF1敲低后,UHRF1表达明显降低,WNT3a和GSK3β的表达降低,MMP9表达量下降;使用HLY78(WNT激活剂)后,相关蛋白的表达趋于恢复,见图4。因此,在结直肠癌中UHRF1可能通过调节WNT信号通路影响基质金属蛋白酶MMP9的表达。
2.5 UHRF1对CRC细胞增殖、迁移和侵袭能力的影响
E d U 结果显示:过表达组增殖细胞数较N C 组和C o n t r o l 组明显增多,使用抑制剂后U H R F 1+I W P-2 组较过表达组显著降低(P<0.05),见图5A;而在sh-UHRF1组中,随着UHRF1表达的降低,细胞增殖数目也随之减少(P<0.05),加入WNT活化剂后细胞增殖率明显上升(P<0.05),见图5B。
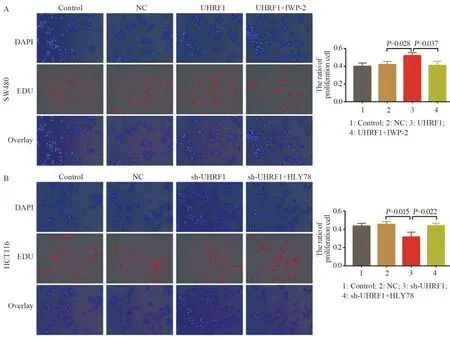
图5 UHRF1通过WNT信号通路影响结直肠癌细胞增殖Figure 5 UHRF1 affected the proliferation of colorectal cancer cells through WNT signaling pathway
Transwell迁移实验结果显示:过表达组细胞数明显较NC组和Control组多(P<0.05),并且过表达组通过IWP-2处理后细胞数明显低于未经拮抗剂处理组(P<0.05),见图6A。敲减组迁移数明显低于NC组和Control组(P<0.01),而sh-UHRF1+HLY78组明显高于敲减组(P<0.05),见图6B。

图6 UHRF1通过WNT信号通路影响结直肠癌细胞的迁移和侵袭Figure 6 UHRF1 affected migration and invasion of colorectal cancer cells through WNT signaling pathway
Transwell侵袭实验结果示:过表达组细胞数明显多于NC组和Control组(P<0.01),且明显高于UHRF1+IWP-2组(P<0.01),见图6C。敲减组细胞数明显低于NC组和Control组,sh-UHRF1+HLY78组细胞数高于敲减组(P<0.05),见图6D。
3 讨论
UHRF1基因编码蛋白是一个多功能结构域蛋白,包含UBL、PHD和TTD结构域、RING finger功能域和SET-环指状结构域,能够识别和修饰不同的染色质,在细胞增殖、DNA损伤与修复、周期调控和细胞损伤放射敏感性等方面发挥重要作用[18]。UHRF1是一个重要的表观遗传调控因子,是整合表观遗传信息的关键蛋白质,通过其特殊域参与表观遗传过程,进一步调节肿瘤的生物学特性[19]。
研究表明,UHRF1在包括CRC在内的多种恶性肿瘤的发生发展中发挥重要作用[20-22],虽然具体的调控机制尚未完全阐明。UHRF1在结直肠癌中表达上调,并与结直肠癌的进展有关[23],CRC细胞中DNA甲基化的维持高度依赖于UHRF1,因此UHRF1耗竭迅速诱导DNA去甲基化作用[24]。本研究揭示了UHRF1在具有淋巴结转移、远处转移和高TNM分期不良预后因素的CRC患者中明显高表达,可能是影响CRC患者预后的一个因素,3年随访结果显示UHRF1高表达提示不良的预后,且具有较为稳定可靠的预后预测能力,更加可靠的证据需要等待5年随访结果进一步评估预后情况。UHRF1蛋白还与细胞增殖和分化能力密切相关,增殖能力越强和分化程度越低的细胞中UHRF1表达越高。本研究还发现UHRF1的过表达可增强CRC的增殖、迁移和侵袭能力。UHRF1基因沉默后,CRC细胞的这些生物学特性受到抑制,这与UHRF1的促进增殖作用密切相关,这与课题组前期研究结果相一致[16-17],同时在体内外也验证了UHRF1在CRC中的重要作用。亦有研究发现SHMT2敲低可通过降低UHRF1的表达进而抑制CRC的增殖并诱导细胞周期阻滞,表明UHRF1可能与CRC细胞周期有关[25],但UHRF1影响侵袭、迁移能力的具体机制还需要进一步探索。
WNT信号通路是细胞生长发育过程中传递生物信息的重要通路,是一个复杂的蛋白质网络。WNT信号通路参与调节肿瘤微环境的形成。通过级联信号传递,可导致EMT、肿瘤细胞转移和肿瘤干细胞特性增强[26]。同时,无论是乳腺癌、肺癌、肝癌,甚至CRC[27],这些肿瘤的发生均被认为与WNT信号通路有关[28-30]。因此,UHRF1作为整合遗传信息的重要分子,也可引起异常细胞增殖和肿瘤形成,UHRF1和WNT信号通路之间是否存在相关性目前尚不清楚。本研究验证了UHRF1可以通过WNT信号通路调节CRC细胞中基质金属蛋白酶MMP9的表达,从而影响CRC迁移和侵袭的生物学特性,进一步揭示了UHRF1发挥作用的内在机制。UHRF1也可能通过其他作用机制发挥作用,有研究发现UHRF1可能介导的泛素化和DNA甲基转移酶1(DNMT1)的降解,导致启动子CpG岛的去甲基化和STAT1的过表达,进而促进CRC的生长[31]。
综上所述,本研究探索了UHRF1如何介导其在CRC中的促癌作用。但目前的研究仅基于细胞水平的实验研究,即体外水平。同时,我们也在思考这个系统中是否有其他分子参与,UHRF1是否是这个调控的起点,是否还有其他的信号通路,这有待未来进一步的研究和发现。本研究发现UHRF1基因可通过调控WNT信号通路影响CRC增殖、迁移和侵袭,希望为结直肠癌的分子靶向治疗提供新的可能。
利益冲突声明:
所有作者均声明不存在利益冲突。

