KCNQ1OT1基因敲除联合鸦胆子素D对乳腺癌MDA-MB-231细胞增殖、迁移及侵袭的影响
龙凤,赵玉,黄勇,刘晓燕,周旋,李雪,叶海琳
0 引言
乳腺癌是全世界女性最常见的恶性肿瘤,也是女性癌症死亡的主要原因[1]。三阴性乳腺癌(triple negative breast cancer, TNBC)约占乳腺癌新发病例的24%[2],恶性程度高、侵袭性强、且缺乏特异性靶向药物,导致其易复发、易转移、预后差,目前临床尚无良好的治疗方法[3]。因此,深入解析驱动TNBC发展的分子机制,筛选安全高效的靶向药物及药物组合是临床治疗TNBC以及改善患者生活质量的有效策略。中草药一直是抗肿瘤药物的重要来源,而长链非编码RNA(long non coding RNA, lncRNA)是肿瘤发生发展中重要调控因子及抗肿瘤药物的潜在作用靶标[4]。鸦胆子素D(Bruceine D,BD)是一种来源于中草药鸦胆子的四环三萜类化合物[5],在多种癌症中表现出显著的抗肿瘤药理学活性[6-8]。在乳腺癌中,BD可抑制TNBC细胞的迁移及侵袭[9],但其具体分子作用机制尚不明确。钾电压门控通道亚家族Q成员1重叠转录物1(potassium voltage-gated channel subfamily Q member 1 overlapping transcript 1,KCNQ1OT1)在多种人类癌症中异常表达,与癌症的进展、分期和预后不良密切相关[10]。有研究发现KCNQ1OT1可通过miR-34a/Notch3轴影响乳腺癌细胞增殖、侵袭和迁移[11]。因此,KCNQ1OT1很可能是抗乳腺癌药物的潜在分子作用靶点,但BD是否可通过调控KCNQ1OT1影响TNBC的进展尚未可知。
小干扰RNA(small interfering RNA, siRNA)技术以序列特异性的方式高效沉默靶基因的表达。目前,已开发出专门靶向肿瘤基因的siRNA药物并获批上市[12]。然而,BD联合siRNA靶向KCNQ1OT1是否能获得更佳的抗乳腺癌疗效尚不清楚。因此,本研究通过观察BD联合siKCNQ1OT1对乳腺癌细胞增殖、迁移、侵袭和上皮间质转化的影响,分析KCNQ1OT1参与调控的分子通路,探寻BD联合siKCNQ1OT1治疗人乳腺癌的可能分子机制,旨在为研发治疗乳腺癌的靶向药物及药物组合提供药理学依据。
1 材料与方法
1.1 细胞株
人正常乳腺上皮细胞MCF-10A细胞株(武汉普诺赛生命科技有限公司,编号:CL-0525);人三阴性乳腺癌MDA-MB-231细胞株(中国科学院上海细胞库,编号:TCHu227);人乳腺癌MCF-7细胞株(中国科学院上海细胞库,编号:CL-0149)。
1.2 药品及试剂
鸦胆子素D(Bruceine, BD)购自北京Solarbio公司,批号SB8280,纯度≥98%;CCK8试剂盒(日本Dojindo,批号:CK04);Transwell小室、Matrigel基底胶购自美国Corning公司,批号分别为3422、356234;RiboFECTTMCP Buffer(10×)、RiboFECTTMCP Reagent、人属KCNQ1OT1引物、RiboTMh-KCNQ1OT1 Smart Silencer-3、lncRNA Smart Silencer NC #1购自广州锐博生物技术有限公司,批号分别为C10502-05、C10511-05、LQP0003767/8、Lnc3211122065528和Lnc3N0000001-1-5;彩虹245广谱蛋白Marker(11~245 kDa)(北京Solarbio公司,批号:PR1920);超敏ECL化学发光试剂盒(苏州NCM Biotech,批号:P10100);兔抗人GAPDH多克隆抗体、兔抗人Vimentin多克隆抗体、兔抗人p-MKK7多克隆抗体、HRP标记山羊抗兔IgG二抗购自ImmunoWay Biotechnology Company,批号分别为YM3215、YT4879、YP1404、RS002;重组Anti-E cadherin抗体、Anti-N cadherin抗体、Anti-CDC42抗体(英国Abcam公司,批号:ab212059、ab76011、ab187643);兔多克隆抗体MKK7(上海Beyotime公司,批号:AF7419)。
1.3 仪器
恒温培养箱(美国Thermo公司,型号:HERAcell VIOS 160i CO2型);酶标仪(美国Thermo公司,Varioskan LUX型);实时荧光定量PCR仪(加拿大枫岭国际有限公司,型号:FTC-8000);电泳槽/电转移装置(美国伯乐公司,PowerPacTMBasic BIO-RAD型)。
1.4 方法
1.4.1 生物信息学分析 利用在线数据库lnCAR(https://lncar.renlab.org/)分析lncRNA KCNQ1OT1在乳腺癌组织及正常乳腺组织中的差异表达,并通过Kaplan-Meier Plotter(http://kmplot.com/analysis/)数据库确认lncRNA KCNQ1OT1高/低表达与乳腺癌患者总生存期之间的关系。通过ENCORI(http://starbase.sysu.edu.cn)、LncBase v.3(https://diana.e-ce.uth.gr/lncbasev3)和RNAinter(http://www.rnainter.org/)在线数据库检索与lncRNA KCNQ1OT1相互作用的miRNA。ENCORI、RNAinter、TargetScan8.0(https://www.targetsc an.org/vert_80/)和miRDB(https://mirdb.org/)在线数据库预测miR-9-5p、miR-423-5p和miR-454-3p的下游靶基因并进行交集。用DAVID、Bioinformatics在线软件将交集出来的靶基因进行GO生物功能富集分析和KEGG通路富集分析。
1.4.2 细胞培养 将MDA-MB-231和MCF-7细胞系置于含有10%胎牛血清和1%青霉素/链霉素的DMEM高糖培养基中,MCF-10A细胞系置于MCF-10A细胞专用培养基中,于37℃、5%CO2的培养箱中培养。
1.4.3 细胞活力测定 将细胞接种在96孔板中(3 000个细胞/孔),并让其生长过夜。然后用不同浓度的BD处理细胞,分别培养24、48和72 h后将CCK8溶液加入各孔中,并于培养箱中继续孵育2 h。于450 nm条件下用酶标仪检测其吸光度值(OD),并计算细胞存活率。计算公式:细胞存活率=[(OD实验孔-OD空白孔)/(OD对照孔-OD空白孔)]×100%,0 μg/ml处理组的细胞活力被认为是100%。
1.4.4 菌落形成能力 将MDA-MB-231细胞(1 000个细胞/孔)接种到六孔板中并培养过夜。用不同浓度的BD处理各孔细胞24 h,常规培养12天。用PBS缓冲液清洗2次,4%多聚甲醛固定细胞集落,然后用0.1%结晶紫染色30 min。最后对菌落拍照,人工统计菌落数。
1.4.5 RNA提取及实时定量PCR分析 收集处理后的细胞,用RNAiso Plus试剂提取MDAMB-231细胞总RNA,使用riboSCRIPTTMmRNA/lncRNA qRT-PCR Starter Kit试剂盒通过qRT-PCR法测定各组细胞中lncRNA KCNQ1OT1的表达水平。KCNQ1OT1上游引物序列:5’-GGCTGCCTATCTCTTCCACC-3’,下游引物序列:5’-GTGCGGACCCTATACGGAAG-3’,GAPDH由广州锐博生物技术有限公司提供作为内参。数据分析采用2-ΔΔCt法。
1.4.6 划痕实验 将MDA-MB-231细胞接种于6孔板中,当密度达90%时,使用100 μl枪头刮擦细胞层以产生划痕,然后用PBS洗涤两次以除去漂浮的细胞。随后加入无血清含药或不含药培养基,并于显微镜下分别拍下0、24和48 h的划痕愈合照片。迁移率的计算公式如下:迁移率(%)=(0 h划痕面积-24 h/48 h划痕面积)/0 h划痕面积×100%。实验重复三次。
1.4.7 Transwell侵袭实验 将用DMEM稀释后的基质胶50 μl均匀铺于Transwell小室底部,干燥后将不同药物处理的100 μl、浓度为5×105/ml的MDA-MB-231细胞接种于Transwell小室内,下室每孔加入600 μl含20%胎牛血清的DMEM培养基,于37℃、5%CO2培养箱培养24 h,棉签拭子擦除小室上层未侵袭的细胞,4%福尔马林固定膜下的细胞,0.1%结晶紫染色。于倒置显微镜下拍照计数。侵袭率(%)=实验组侵袭细胞数/对照组侵袭细胞数×100%。
1.4.8 蛋白免疫印迹法实验 根据说明书,将经过不同药物处理的细胞用高效组织细胞RIPA裂解液处理10 min以提取总蛋白。通过离心收集上清液部分,用BCA蛋白定量试剂盒测定各组蛋白质浓度,然后将蛋白样品进行变性处理。等量的蛋白质通过10%SDS-PAGE电泳;然后电转移到硝酸纤维素膜上;膜用5%脱脂乳封闭2 h;分别与一抗4℃孵育过夜,一抗稀释比例为:GAPDH(1:3 000);Vimentin(1:1 000);N-cadherin(1:7 000);E-cadherin(1:1 000);CDC42(1:1 0000);MKK7(1:1 000);p-MKK7(1:1 000)。随后将该膜与二抗孵育2 h,并通过ECL化学发光试剂盒和Western blot成像系统检测目标条带。GAPDH用作蛋白的内部对照。
1.4.9 细胞转染及分组 广州锐博生物技术有限公司合成了KCNQ1OT1 siRNA的靶序列(见表1)和包括在人转录组中没有靶标的siRNA作为非靶标对照(si-NC)。使用riboFECTTMCP试剂盒和RiboTMlncRNA Smart Silencer试剂在MDA-MB-231细胞中沉默KCNQ1OT1的表达。用riboFECTTMCP转染试剂在6孔板中以50%~70%的细胞密度进行siRNA转染,并将细胞孵育24 h。取对数生长期的MDA-MB-231细胞,进行加药处理并分组。用0.4 μg/ml浓度的BD处理记为BD(0.4 μg/ml)组;将si-NC、si-KCNQ1OT1分别转染至MDA-MB-231细胞中记为siNC、siKCNQ1OT1组;将si-NC、si-KCNQ1OT1分别转染至MDA-MB-231细胞中再用0.4 μg/ml BD处理记为siNC+BD(0.4 μg/ml)、siKCNQ1OT1+BD(0.4 μg/ml)组。对照组使用含或者不含有血清且DMSO终体积分数为0.1%的DMEM培养液记为BD(0 μg/ml)组。
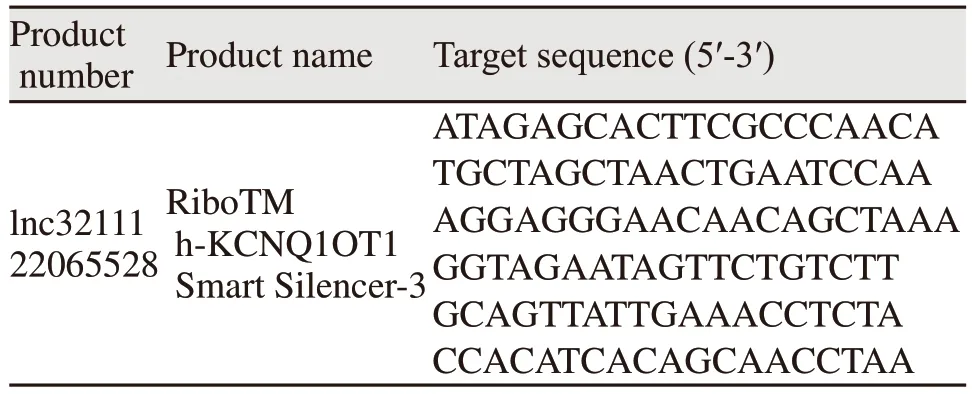
表1 siKCNQ1OT1序列Table 1 siKCNQ1OT1 sequences
1.5 统计学方法
所有实验至少重复三次,实验数据表示为均数±标准差(±s)。组间比较采用t检验,多样本比较采用单因素方差分析。所有统计分析均使用GraphPad Prism V8.0软件。P<0.05为差异有统计学意义。
2 结果
2.1 lncRNA KCNQ1OT1在人乳腺癌组织细胞中的表达及其与乳腺癌患者预后的相关性
在线数据库分析表明,与正常乳腺组织相比,KCNQ1OT1在乳腺癌组织中高表达,见图1A,并且KCNQ1OT1高表达的乳腺癌患者的总生存期显著降低,见图1B。qRT-PCR检测发现,与人正常乳腺上皮细胞MCF-10A相比, KCNQ1OT1在人乳腺癌MCF-7、MDA-MB-231细胞中均高表达,且KCNQ1OT1在MDA-MB-231细胞中的表达上调更为显著(P<0.01),见图1C。
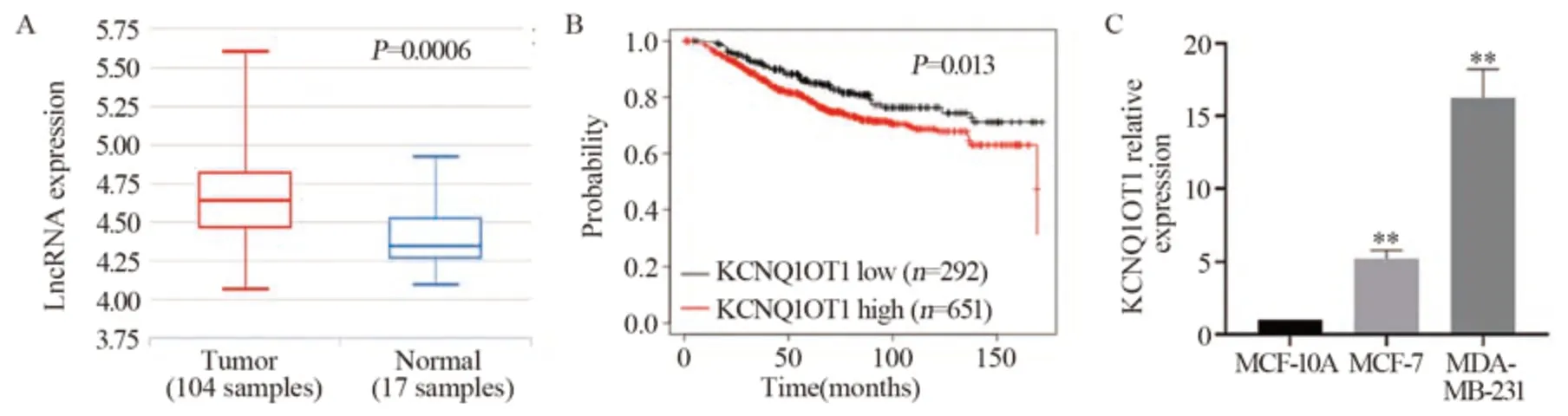
图1 LncRNA KCNQ1OT1在乳腺癌组织及细胞系中上调并与患者生存期显著相关Figure 1 LncRNA KCNQ1OT1 was up-regulated in breast cancer tissues and cell lines and is significantly related to patient survival
2.2 BD联合siKCNQ1OT1对乳腺癌MDA-MB-231细胞活力的影响
CCK8检测细胞活力实验结果发现,BD以时间和剂量依赖的方式抑制MDA-MB-231、MCF-7细胞活力(P<0.01),见图2A、B。细胞集落形成实验结果显示,BD降低了MDA-MB-231细胞的克隆形成能力(P<0.01),见图2C、D。qRTPCR结果表明BD可呈浓度依赖性地抑制MDAMB-231和MCF-7细胞中KCNQ1OT1的表达,且MDA-MB-231细胞对BD更敏感(P<0.01),见图2E。采用siRNA技术敲低并验证KCNQ1OT1在乳腺癌细胞MDA-MB-231中的表达,发现siKCNQ1OT1组细胞中KCNQ1OT1的表达显著下调(P<0.01),见图2F。按照不同分组处理后,采用qRT-PCR检测KCNQ1OT1的表达,结果显示,与siNC组相比,siKCNQ1OT1组中KCNQ1OT1的表达水平降低,BD(0.4 μg/ml)联合siKCNQ1OT1对KCNQ1OT1表达水平的抑制作用更为显著,见图2G。CCK8结果显示,与siNC组相比,siKCNQ1OT1处理组的MDA-MB-231细胞活力((66.99±2.87)%)显著降低(P<0.01),且siKCNQ1OT1联合BD(0.4 μg/ml)对MDAMB-231细胞活力((42.63±1.55)%)的抑制作用比单独应用siKCNQ1OT1或BD(0.4 μg/ml)更为显著(P<0.01),见图2H。
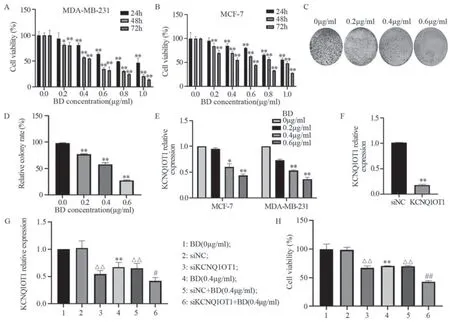
图2 BD联合siKCNQ1OT1对乳腺癌MDA-MB-231细胞活力的影响Figure 2 Effect of BD combined with siKCNQ1OT1 on viability of breast cancer MDA-MB-231 cells
2.3 BD联合siKCNQ1OT1对乳腺癌MDA-MB-231细胞迁移及侵袭能力的影响
划痕实验结果显示,siKCNQ1OT1和BD(0.4 μg/ml)联用对MDA-MB-231细胞迁移的抑制作用比单独应用siKCNQ1OT1或BD(0.4 μg/ml)更显著(P<0.05),见图3A、B。Transwell侵袭实验结果表明,与各自对照组相比,BD(0.4 μg/ml)组与siKCNQ1OT1组穿透Transwell小室的细胞比率明显减少,分别是(58.11±2.49)%和(60.00±4.18)%;而siKCNQ1OT1联合BD(0.4 μg/ml)组穿透Transwell小室的细胞比率为(27.70±0.31)%,更大程度地抑制细胞侵袭能力,见图3C、D。
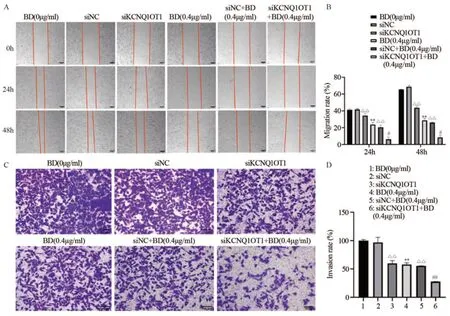
图3 BD联合siKCNQ1OT1对乳腺癌MDA-MB-231细胞迁移及侵袭能力的影响Figure 3 Effects of BD combined with siKCNQ1OT1 on migration and invasion of breast cancer MDA-MB-231 cells
2.4 BD联合siKCNQ1OT1对乳腺癌MDA-MB-231细胞中EMT相关蛋白表达的影响
Western blot实验结果显示,与对照组相比,单独应用siKCNQ1OT1或BD(0.4 μg/ml)均可下调MDA-MB-231细胞中N-cadherin和Vimentin的表达,上调E-cadherin的表达;siKCNQ1OT1和BD(0.4 μg/ml)联用时对MDA-MB-231细胞中N-cadherin、Vimentin和E-cadherin的表达调控作用更为显著(P<0.01),见图4。
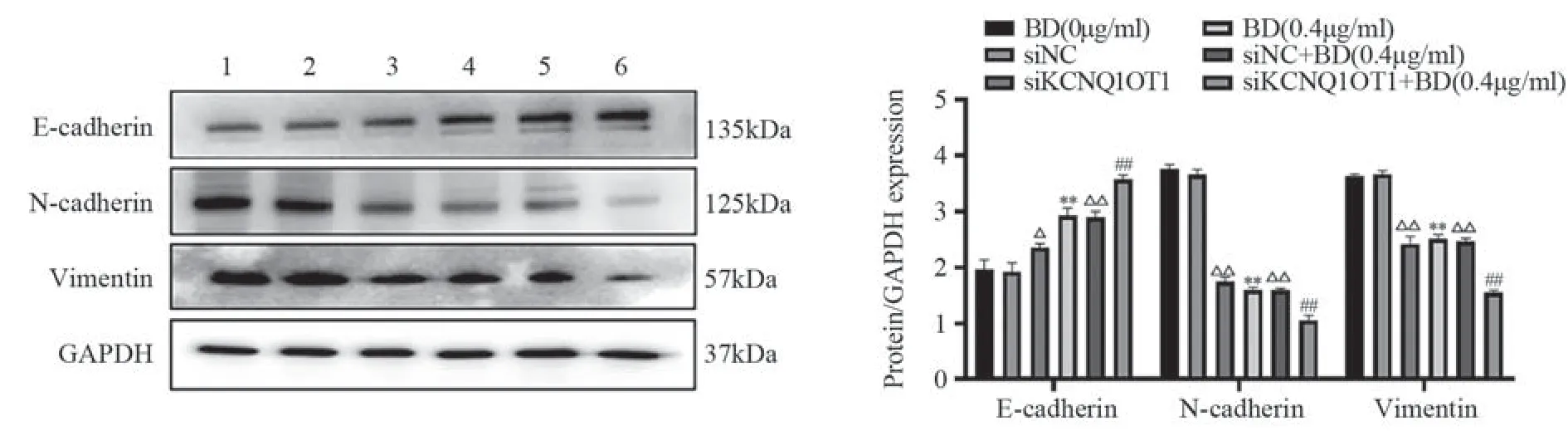
图4 BD联合siKCNQ1OT1对乳腺癌MDA-MB-231细胞中EMT相关蛋白的表达的影响Figure 4 Effect of BD combined with siKCNQ1OT1 on expression of EMT related proteins in breast cancer MDA-MB-231 cells
2.5 基于生物信息学技术预测lncRNA KC-NQ1OT1靶基因及其参与调控的相关信号通路
在线数据库分析与KCNQ1OT1相互作用的miRNA,取交集筛选出20个miRNA,见图5A,其中已有研究表明miR-9-5p[13]、miR-423-5p[14]和miR-454-3p[15]与KCNQ1OT1之间存在互补位点。再通过数据库预测miR-9-5p、miR-423-5p和miR-454-3p的靶基因并取交集,共获取包括CDC42、MKK7在内的939个靶基因,见图5B。对这939个靶基因进行GO和KEGG分析,发现其靶点主要富集于RNA聚合酶Ⅱ启动子转录调控、DNA模板和细胞迁移等关键生物过程,见图5C,其信号通路主要富集在癌症、Hippo和MAPK信号通路,见图5D。

图5 生物信息学技术分析lncRNA KCNQ1OT1靶基因Figure 5 Analysis of target gene of lncRNA KCNQ1OT1 by bioinformatics
2.6 BD联合siKCNQ1OT1对乳腺癌MDA-MB-231细胞中CDC42、MKK7和p-MKK7蛋白表达的影响
与对照组相比,BD(0.4 μg/ml)和siKCNQ1OT1均分别能下调MDA-MB-231细胞中CDC42和p-MKK7的表达(P<0.01);当BD(0.4 μg/ml)和siKCNQ1OT1联用时,MDA-MB-231细胞中CDC42和p-MKK7的表达量较单独应用BD(0.4 μg/ml)或siKCNQ1OT1下调更显著(P<0.05或P<0.01),而各处理组的MDA-MB-231细胞中MKK7的表达未见明显变化,见图6。
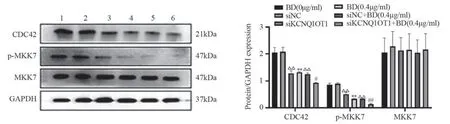
图6 BD联合siKCNQ1OT1对MDA-MB-231细胞中CDC42、MKK7和p-MKK7蛋白表达的影响Figure 6 Effect of BD combined with siKCNQ1OT1 on expression of CDC42, MKK7, and p-MKK7 proteins in MDAMB-231 cells
3 讨论
越来越多的证据表明,lncRNAs是一类新型的功能调控分子,在肿瘤细胞增殖、凋亡和迁移的基因调控中发挥作用。在乳腺癌中,多种lncRNAs通过微调组蛋白修饰或调节其靶miRNAs的生物利用度,在基因转录的表观遗传调控中发挥重要作用[16]。这使lncRNA未来可能被作为治疗癌症的新分子靶标及癌症早期诊断、评估预后的有效生物标志物,具有极其重要的临床应用价值。KCNQ1OT1是近年发现的一种致癌性lncRNA,在多种人类癌症中均高表达,并与癌症临床特征密切相关[10]。在乳腺癌中,KCNQ1OT1表达上调并可促进乳腺癌细胞的增殖和迁移,且KCNQ1OT1的高表达与患者预后生存率低相关[13,17]。本研究发现,与非TNBC细胞和人正常乳腺上皮细胞相比,KCNQ1OT1在三阴性乳腺癌MDA-MB-231细胞中异常高表达,因此,靶向KCNQ1OT1的治疗可能是治疗三阴性乳腺癌的有效方法,我们假设通过siRNA技术沉默乳腺癌细胞中的KCNQ1OT1基因可能是一种有用的治疗策略。
目前,从中药中提取的天然活性成分已被公认为是新型抗癌药物的重要来源[18]。鸦胆子素D是从中药鸦胆子中提取出来的一种化合物。研究表明,BD在多种癌症中具有显著的抗肿瘤药理活性,既可通过调控肿瘤细胞增殖、凋亡、转移、EMT进程和自噬来抑制肿瘤进展[19],也可作为一种辅助药物来提高肿瘤细胞对化疗药物的敏感性[14,20]。既往研究表明BD可通过激活靶向p38丝裂原活化蛋白激酶(p38 mitogen activated protein kinase, p38 MAPK)和Jun氨基末端激酶(Jun N-terminal kinase, JNK)信号通路来抑制乳腺癌MDA-MB-231、MCF-7细胞的运动并诱导其凋亡[21];BD还可通过抑制磷脂酰肌醇-3-激酶(phosphatidylinositol-3-kinase, PI3K)/蛋白激酶B(protein kinase B, Akt)信号通路和逆转EMT过程来降低MDA-MB-231细胞的迁移和侵袭能力[9]。联合治疗方案是临床上治疗恶性肿瘤的常用治疗手段。通过联合用药,可以同时调节多个信号通路分子,从而提高疗效、降低不良反应、减少多药耐药的发生。因此本研究分析了BD与siKCNQ1OT1联合用药对乳腺癌MDA-MB-231细胞增殖、迁移和侵袭的影响。研究结果表明,与单独应用BD(0.4 μg/ml)或siKCNQ1OT1相比,BD(0.4 μg/ml)与siKCNQ1OT1联合使用对MDAMB-231细胞的活力、迁移和侵袭能力的抑制作用更明显。
生物信息学分析表明KCNQ1OT1参与调控的信号通路主要富集在癌症、Hippo和MAPK通路。Hippo信号通路主要与肿瘤细胞的增殖、分化、凋亡等生物学过程相关[22],而GO功能分析表明靶点主要集中在细胞迁移方面,因此我们预测并筛选出与乳腺癌转移更为密切的MAPK信号通路[23]。MAPK信号通路的异常激活在肿瘤发生中起着核心作用[24],细胞分裂周期蛋白42(cell division cycle 42, CDC42)、MKK7作为MAPK信号通路上的关键蛋白,可参与调控细胞增殖、凋亡、侵袭和转移等多种生物学过程[25-26]。CDC42是Rho家族蛋白的一种小GTP酶,它的失调可以改变细胞的正常功能,导致信号通路的启动,并且与多种致病过程(例如癌症)相关。使用小分子和lncRNA抑制CDC42和CDC42相关信号通路是改善癌症治疗和开发抗肿瘤药物的新策略[27]。据报道,lncRNA可作为上游信号分子参与激活多种癌症相关信号通路,是介导癌细胞增殖、侵袭及迁移的重要参与者[28]。因此,本研究推测CDC42/MKK7作为MAPK信号通路关键分子以及KCNQ1OT1靶分子参与BD抑制MDA-MB-231细胞恶性生物学行为机制。本研究发现,与单独应用BD或siKCNQ1OT1相比,BD与siKCNQ1OT1联合对MDA-MB-231细胞中CDC42、p-MKK7蛋白表达的抑制作用更明显。这表明BD与siKCNQ1OT1对CDC42/MKK7信号通路存在一定的抑制作用。EMT是促进癌细胞侵袭性和远处转移表型的转录程序的一部分。发生EMT时,肿瘤细胞失去细胞极性,运动和迁移能力增强,最终导致肿瘤广泛侵袭和转移[29]。EMT发生的标志是上皮表面标志物E-钙黏蛋白(E-cadherin)的丢失以及间质标志物N-钙黏蛋白(N-cadherin)、波形蛋白(Vimentin)的获得[30]。本研究发现,BD与siKCNQ1OT1均能够有效抑制乳腺癌MDA-MB-231细胞的迁移及侵袭,这种抑制作用可能与N-cadherin、Vimentin的表达下调,E-cadherin的表达上调有关,且二者联用对MDAMB-231细胞中N-cadherin、Vimentin和E-cadherin的表达调控作用更显著。这些研究结果都表明了BD联合siKCNQ1OT1对三阴性乳腺癌具有更佳的抑制效果,这为临床治疗中新的药物组合的开发,特别是靶向治疗三阴性乳腺癌的药物开发提供了实验依据。
总之,BD可以剂量和时间依赖的方式下调乳腺癌MDA-MB-231细胞中lncRNA KCNQ1OT1的表达,且BD联合siKCNQ1OT1能显著抑制乳腺癌细胞的增殖、迁移、侵袭和EMT进程,其分子机制可能与CDC42/MKK7信号通路的阻断有关。因此,BD和siKCNQ1OT1联合应用是治疗乳腺癌的一种新策略。本研究结果可为中药与靶向基因联合治疗提供实验依据,并为提高乳腺癌临床治疗效果提供新的思路与途径。
利益冲突声明:
所有作者均声明不存在利益冲突。

