SULT1C2在肝癌中表达及其与预后关系生信分析
闫伟华,赵树超,张敏,时维平,周璇,马晓军
(青岛大学附属医院,山东 青岛 266000 1 病理科; 2 麻醉科)
肝癌是世界上第六大常见恶性肿瘤,也是导致癌症相关死亡的第二大原因[1]。由于早期诊断困难,大多数肝癌病人确诊时已处于中晚期而错过了有效治疗的机会,预后很差[2-3]。即使手术切除,术后生存率也不高[3]。因此,深入了解肝癌发生和发展的分子机制,对于开发肝癌的早期诊断的分子生物标志物和寻找新的治疗策略至关重要。
磺基转移酶1C2(SULT1C2)是胞浆硫转移酶1C(SULT1C)亚家族的一员,是一种Ⅱ相解毒酶,通过在靶标上添加硫酸盐基团来促进外源物质通过尿液或胆汁排出。SULT1C2对硝基苯酚和诱变剂N-羟基-2-乙酰氨基荧烯均表现出硫化活性,在致癌物质的活化中起重要作用[4]。SULT1C2已经被证明在人的胃、肾和甲状腺以及胎儿肝和肾中表达[5]。目前已有研究显示,SULT1C2在结肠腺癌细胞系LS180中表达[6],在肺腺癌中高表达并导致预后不良[7]。但关于SULT1C2在肝癌中作用的研究较少。因此,本研究通过癌症基因组图谱(TCGA)、基因表达综合(GEO)和基因型-组织表达(GTEx)数据库,并结合临床样本探讨SULT1C2基因表达与肝癌的关系,并进一步探讨其潜在的作用机制,为确定SULT1C2基因与肝癌的关系提供依据。
1 资料和方法
1.1 数据资料的收集
从TCGA数据库下载33种泛癌表达数据,并下载肝癌病人的临床信息,共将341例肝癌样本纳入研究。以肝癌为关键词从GEO数据库中筛选原始数据的数据集,共9个符合条件,分别为GSE10 2097、GSE12 1248、GSE22 058、GSE25 097、GSE36 376、GSE46 444、GSE57 957、GSE76 297和GSE76 427,分别下载原始数据,提取SULT1C2基因表达信息。肝癌分子图谱数据库(HCCDB)[8]用于进一步研究SULT1C2在泛癌、正常组织和肝癌组织中的表达。
1.2 癌和癌旁组织的收集
收集青岛大学附属医院器官移植中心2014年3月—2017年8月切除的96对肝癌和癌旁组织,置于-80 ℃保存用于SULT1C2在肝癌中表达的研究。术前已告知病人及其家属标本的采集不会造成任何额外的经济和健康负担。所有参与者都签署了书面知情同意书。
1.3 总RNA的提取
称量冷冻的肝癌和癌旁组织100 mg,加入含800 μL Trizol裂解液的1.5 mL离心管并用组织破碎仪破碎。组织匀浆置于4 ℃离心机1 500 r/min离心5 min,上清转移至新的离心管于室温裂解5 min。组织裂解液加入160 μL的氯仿,混匀,平衡15 min。混合液于4 ℃条件下、12 000 r/min离心10 min,上层RNA转移入新的EP管。RNA用异丙醇沉淀并通过离心分离,分离并沉淀后的RNA用体积分数为0.75的乙醇洗涤。RNA干燥后用DEPC水10 μL溶解。
1.4 cDNA的合成
SuperScript®Ⅲ First-Strand Synthesis kit用于cDNA的合成。将cDNA合成试剂盒平衡至室温,使用前将每种成分混合并短暂离心。将总RNA(≤2.5 μg)、dNTP混合物(1 mmol/L)、随机引物(5 mg/L)和水添加至体积5 μL。将RT缓冲液、RNaseOUT(2 U)、DDT(10 mmol/L)、SuperScript®Ⅲ(10 U)和MgCl2(5 mmol/L)添加到PCR管至总体积为10 μL。随后,在PCR仪中运行标准的cDNA合成程序。合成的cDNA用DEPC水稀释至200 μL,并在-20 ℃下储存。
1.5 qRT-PCR检测组织中SULT1C2的表达
在平衡至室温后,将引物、Sybr Green和cDNA充分混合。在短暂离心后,在384孔PCR板中加入3.8 μL双蒸水、1.0 μL cDNA、5.0 μL Sybe Green和0.2 μL引物(10 μmol/L)制备PCR溶液。PCR程序:95 ℃变性15 s,56 ℃退火30 s,72 ℃延伸50 s,共进行40个循环。Sybr Green用于确定Cq值。管家基因GAPDH用于校验靶基因的表达水平。PCR所用引物及其序列见表1。

表1 PCR扩增引物及其序列
1.6 统计学分析
TCGA下载泛癌数据后,以SULT1C2表达值为标准,将病人分为SULT1C2高表达和低表达两组。Limma R包用于差异分析,clusterProfiler R用于基因富集分析(GSEA),pheatmap用于热图的绘制,用Kapalan-Meier曲线分析SULT1C2对肝癌病人生存的影响,用Pearson法检验SULT1C2与信号通路间的线性关系,t检验用于检测两组数据间差异。以P<0.05为差异有统计学意义。
2 结 果
2.1 SULT1C2基因在肝癌组织中的表达
应用HCCDB在线HCC数据库研究SULT1C2在正常组织、泛癌组织和肝癌组织中的表达。研究结果显示,SULT1C2在各种器官和组织中表达的均值为0.89,而SULT1C2在泛癌的肿瘤组织中的表达高于癌旁组织(6.67vs3.67)。见图1A。其中,SULT1C2基因在结肠癌(COAD)、嫌色肾细胞癌(KICH)、 肝癌(LICH)和肺腺癌(LUAD) 组织高表达,在食管癌(ESCA)、肾透明细胞癌(KIRC)、肾乳头状细胞癌(KIRP)、 肺鳞状细胞癌(LUSC)和甲状腺癌(THCA)组织中低表达。见图1B。肝癌组织中SULT1C2的表达高于癌旁、肝硬化组织和正常组织。见图2A。同样,GEO数据分析结果显示,SULT1C2在多个肝癌数据集的肿瘤组织中高表达。见图2B。采用qRT-PCR检测进一步验证这一结果,证实了SULT1C2在肝癌组织中的高表达。见图2C。
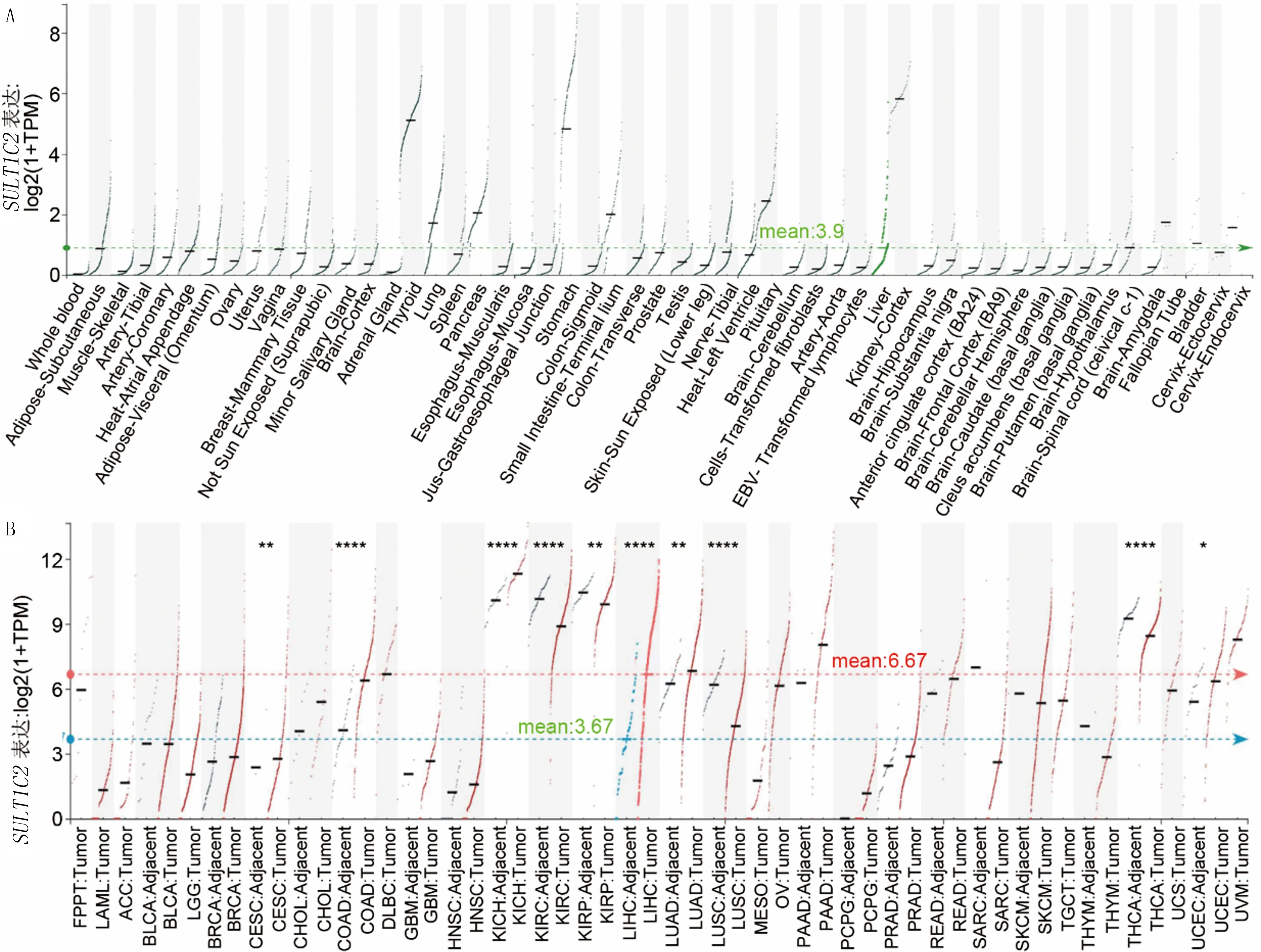
A:HCCDB在线数据库中SULT1C2在正常组织中的表达,绿色虚线表示均值;B:HCCDB在线数据库中SULT1C2在泛癌和癌旁组织中的表达,红色表示癌症样本,蓝色表示正常组织,红线表示癌症样本的表达均值,蓝线表示正常组织的表达均值。与癌旁组织相比,*P<0.05,**P<0.01,****P<0.000 1。
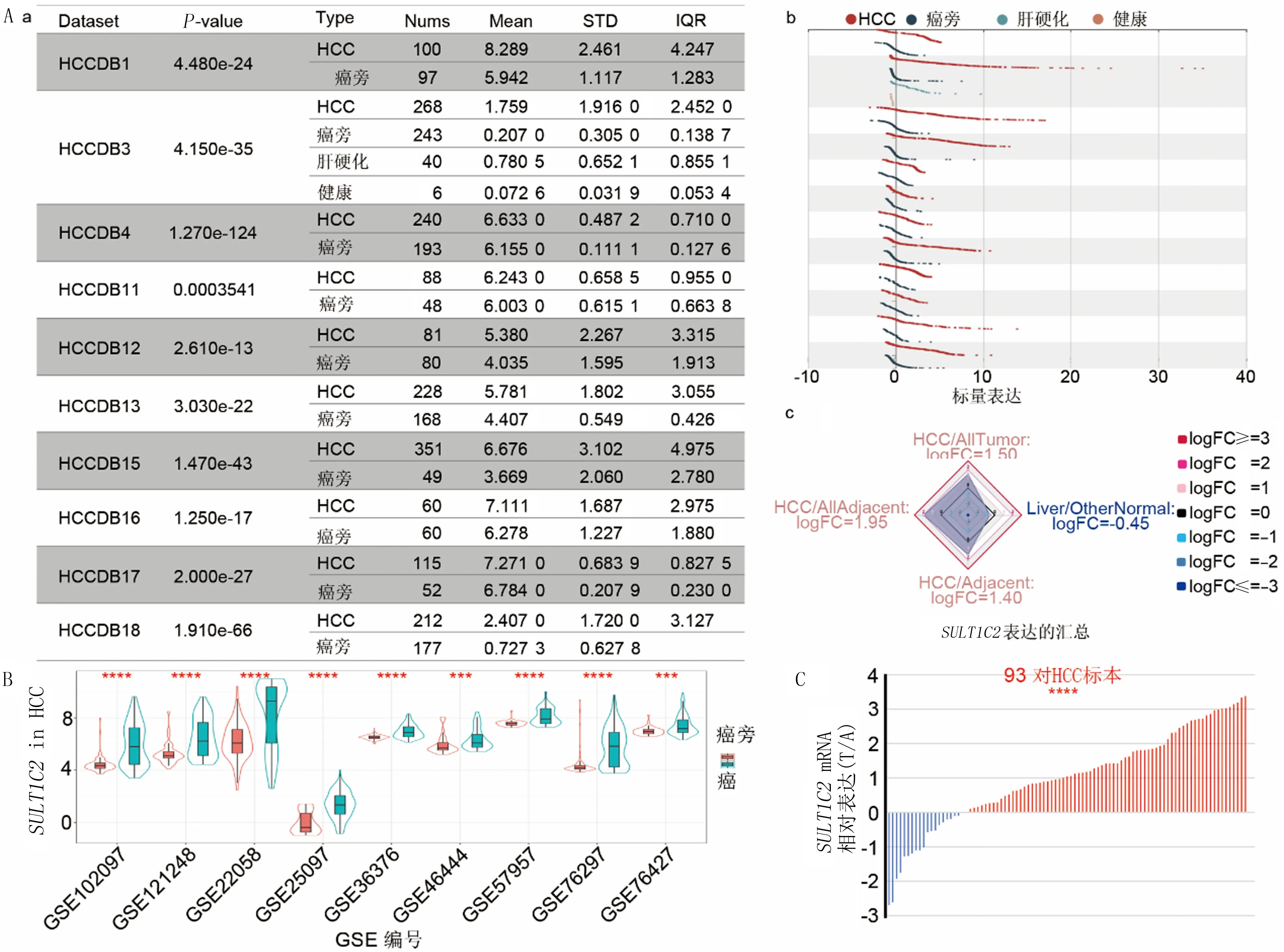
A:SULT1C2在HCCDB数据库HCC数据集中肿瘤组织、肝硬化组织、癌旁和正常组织中的表达;B:SULT1C2在GEO数据库HCC数据集中癌和癌旁组织中的表达;C:qRT-PCR检测93对肝癌和癌旁组织中SULT1C2的表达。红色表示SULT1C2高表达样本,蓝色表示SULT1C2低表达样本。与癌旁组织相比,***P<0.001,****P<0.000 1。
2.2 肝癌组织中SULT1C2基因表达与病人预后的关系
对TCGA数据库中的肝癌组织进行Kaplan-Meier分析,结果显示,SULT1C2高表达组病人的总体生存率(OS)低于低表达组(高风险=125,低风险=245,P<0.01)。见图3A。高表达组病人疾病特异性生存率(DSS)也低于低表达组(高风险=114,低风险=248,P<0.05)。见图3B。然而,高表达组病人的无病生存率(DFI)和无进展生存率(PFI)与低表达组比较差异无显著性(P>0.05)。见图3C、D。
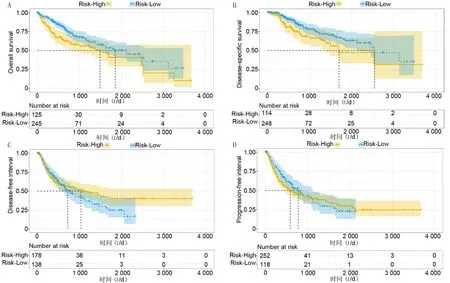
A:SULT1C2基因不同表达病人的OS;B:SULT1C2基因不同表达病人的DSS;C:SULT1C2基因不同表达病人的DFI;D:SULT1C2基因不同表达病人的PFI。
2.3 SULT1C2相关信号通路GSEA分析
GSEA分析结果显示,SULT1C2表达在不同肿瘤组织中信号通路并不完全一致,信号通路在不同组织可能被激活或抑制。见图4A和图4B。与泛癌不同的是,E2F、G2M检查点和MYC信号通路的基因频率和基因数量在SULT1C2表达肝癌中是被激活最高和最多的。见图4C、D。
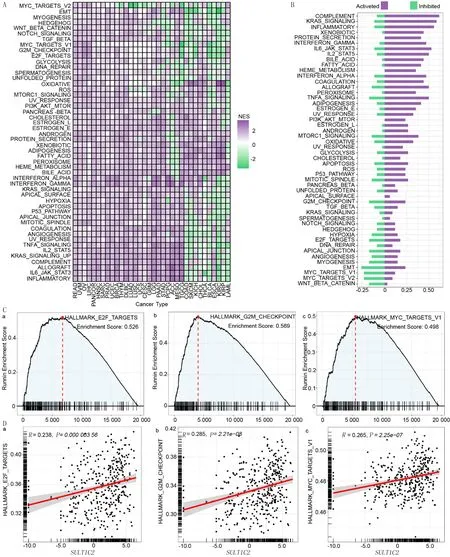
A:GESA分析SULT1C2表达在泛癌中调节的信号通路;B:SULT1C2表达在泛癌中激活/抑制信号的比率;C:E2F、G2M检查点和MYC信号通路在SULT1C2表达的肝癌中被激活;D:E2F、G2M检查点和MYC信号通路与肝癌中SULT1C2表达正相关。
3 讨 论
SULT超家族的酶参与外源物质和内源化合物的代谢,并调节激素的生物活性[9]。基于它们不同的作用,评估SULTs的表达和调控对于理解个体对药物和毒物的反应以及疾病病因学具有重要意义[10-11]。SULT1C是SULT家族的一个分支,位于染色体2q12上,是胎儿发育过程中代谢和致癌的一个潜在的重要决定性因素。然而,人们对其生理功能仍知之甚少,主要是由于SULT1C在胎儿期表达,而在成人组织中低表达[4,12-13]。SULT1C2是第一个被克隆的人类SULT1C成员[5],其在肝癌中的研究较少。本文研究结果显示,SULT1C2在肝癌组织中高表达,且其高表达时病人预后较差。
细胞内存在一系列严密的调控机制,以确保细胞周期不同时期的有序进行。细胞周期的严密调控可因基因突变、缺失、异位、扩增等改变而发生紊乱以致形成肿瘤[14]。作为视网膜母细胞瘤蛋白下游的效应因子,E2Fs通过细胞周期蛋白的进入调控细胞周期的进程[15]。MYC是细胞增殖过程中必不可少的转录因子,通过反式作用调控细胞的发育、生长和分化。MYC的异常表达诱导细胞对生长因子的依赖性减少,从而导致细胞永生化和细胞特性的改变[14-15]。SULT1C2表达的信号通路在不同的肿瘤组织中并不完全一致,可能是由于其信号通路在不同的组织中被激活或抑制。
综上所述,本文生信分析结果提示,SULT1C2基因在肝癌中高表达,它可能通过激活E2F、G2M检查点和MYC信号通路诱导肝癌病人的不良预后,故SULT1C2有望成为肝癌潜在的诊治新靶点。本研究存在不足之处,即未阐明SULT1C2基因是如何通过E2F、G2M检查点和MYC信号通路影响肝细胞癌的进展。因此,今后的研究将进一步探讨SULT1C2在肝癌发生发展中的作用及其分子机制,以期为其成为肝癌潜在的早期诊断和治疗新靶点提供线索。

