曲霉强化发酵对浏阳豆豉风味品质的影响
吴梓仟,刘晶晶,邓高文,周 晓,蒋立文,胡嘉亮,覃业优,刘 洋,*
(1.湖南农业大学食品科学技术学院,湖南 长沙 410128;2.湖南坛坛香食品科技有限公司,湖南 长沙 410128)
豆豉历史悠久,因其营养价值较高且香气特殊深受广大消费者喜爱。浏阳豆豉是湖南传统特色发酵豆制品,其历史可追溯至唐代。在湘菜中,浏阳豆豉具有增鲜提味的作用,名菜“腊味合蒸”“蒸鲜鱼”,便是以其作佐料,如此才有“南方人不可一日无豉”[1]的说法。浏阳豆豉为曲霉型豆豉代表,以黑豆为原料,经过清洗、浸泡、蒸煮、摊凉冷却、制曲、晾霉、洗霉、渥堆、转桶、渥堆、出晒等工序制成。传统的制曲工艺多采用自然发酵,以曲霉为优势菌与其他微生物共同作用分泌众多酶系,将原料中的蛋白质、碳水化合物等大分子物质降解,经过复杂的生化反应,产生大量的风味物质[2-3]。然而由于传统豆豉发酵呈开放式,发酵过程中易受气候、温度、湿度等自然条件的影响,导致产品品质不稳定。
纯种发酵可以提高产品的安全性及缩减产品的生产周期,但是产品品质往往不及自然发酵。文鹤等[4]利用从曲霉型豆豉后发酵过程中分离筛选得到的1 株产香酵母WLW用于纯种豆豉发酵,结果显示自然发酵豆豉中共检测出87 种挥发性成分,而纯种发酵豆豉中仅检测出44 种挥发性成分,远不如自然发酵风味丰富。李薇[5]因永川豆豉发酵周期长,利用纯种米曲霉(Aspergillusoryzae)制曲制做“速成豆豉”,尽管生产效率有所提升,但由于纯种发酵参与微生物较少造成酶系单一,“速成豆豉”的挥发性物质的含量与数量均低于传统发酵,导致风味不及传统发酵豆豉。相比纯种发酵,强化发酵(将一种或多种外源微生物接入到未经灭菌的原料中进行发酵的方式)既可以模拟自然发酵过程中多菌株共同发酵的特点,又有利于控制微生物,降低品控风险,是实现传统发酵食品工业化生产的重要途径。刘琨毅等[6]利用地衣芽孢杆菌强化发酵普洱茶,结果显示强化发酵可以明显改善茶叶中的特征成分;Pang Xiaona等[7]选择具有高酒精耐受性和酯酶活性的本土乳酸菌对白酒进行强化发酵,最终表明强化发酵可有效促进白酒中关键风味物质乙酸乙酯的形成,从而改善白酒风味;Merlo等[8]通过利用植物乳杆菌强化发酵果汁,改善了发酵果汁的味道。但目前浏阳豆豉强化发酵的研究鲜有报道。
本实验室前期从浏阳豆豉中鉴定并分离纯化出2 株不产毒的优势黄曲霉(A.flavus)菌株[9],但其对浏阳豆豉风味品质的影响还有待进一步研究。鉴于此,以陕西小黑豆为原料,采用自然发酵(NF)、A.oryzae强化发酵、优势菌株(A.flavus7214、A.flavus7622)强化发酵以及优势混菌发酵(A.flavus77,A.flavus7214∶A.flavus7622=1∶1)5 种发酵方式制备浏阳豆豉。通过对比强化发酵豆豉与NF豆豉的感官评定、游离氨基酸含量、有机酸含量、挥发性成分组成以及电子鼻评价结果,科学地评价强化发酵对浏阳豆豉风味品质的影响。这对浏阳豆豉的生产标准化、可控化及数字化控制具有一定的参考价值。
1 材料与方法
1.1 材料与试剂
菌株:实验室从浏阳豆豉分离纯化得到的优势菌株A.flavus7214(实验室自藏)与A.flavus7622(CGMCC 20735);A.flavus77(将A.flavus7214和A.flavus7622等比例混合);A.oryzae购于济宁玉园生物科技有限公司。
麸皮 亿乡情名优农产品创业店;黑豆(陕西肾型小黑豆)湖南坛坛香食品科技有限公司;氯化钠、乙腈、甲醇、无水乙醇、磷酸(均为分析纯)国药集团化学试剂有限公司;16 种氨基酸标品、7 种有机酸标品(均为优级纯)长沙隆和化波实验用品有限公司。
1.2 仪器与设备
1100 services型岛津LC-20a液相色谱仪、7890B 5977型气相色谱-质谱(gas chromatography-mass spectrometry,GC-MS)联用仪美国Agilent 公司;PEN3 电子鼻 德国Airsense公司;TG16-WS型台式高速离心机 湘潭湘仪仪器有限公司;DFY-10000D型摇摆式高速磨粉机 温岭市林大机械有限公司;BSa224S分析天平 德国Sartorius有限公司;57330-U型手动SPME进样器、57310-U型聚二甲基硅氧烷萃取头(50/30 μm DVB/CAR/PDMS)美国Supelco公司。
1.3 方法
1.3.1 浏阳豆豉的制备
1.3.1.1 强化菌株制备
按照麸皮∶蒸馏水=1∶0.95混匀作为菌种扩配的培养基,加入到300 mL锥形瓶中(1.5 cm厚);121 ℃高压蒸汽锅灭菌25 min。冷却至室温,把保存菌种斜面接入到培养基,培养72 h。
1.3.1.2 工艺流程
选择新鲜的黑豆→清洗→浸泡→蒸煮(2 h)→摊凉冷却→NF/强化发酵制曲(3~7 d,28~35 ℃)→晾霉(1~2 d)→洗霉→渥堆(1~2 d,室温)→转桶(加3%盐)→渥堆(1~2 d,室温)→出晒(1~2 d)→成品
1.3.2 游离氨基酸测定
参照GB/T 30987—2020《植物中游离氨基酸的测定》[10],采用高效液相色谱法。
1.3.3 有机酸测定
参考GB/T 5009.157—2016《食品中有机酸的测定》[11],采用高效液相色谱法。有机酸标准曲线如表1所示。

表1 有机酸标准曲线特征Table 1 Retention times and quantitative calibration curves for organic acids
1.3.4 电子鼻测定
参考Wang Shuyan等[12]电子鼻测定方法并稍作修改。直接将进样针头插入含样品的密封样品瓶中进行测定。测定条件:采样时间1 s/组;传感器自清洗时间120 s;传感器归零时间10 s;样品准备时间5 s;进样流量600 mL/min;分析采样时间120 s。电子鼻传感器性能描述如表2所示。
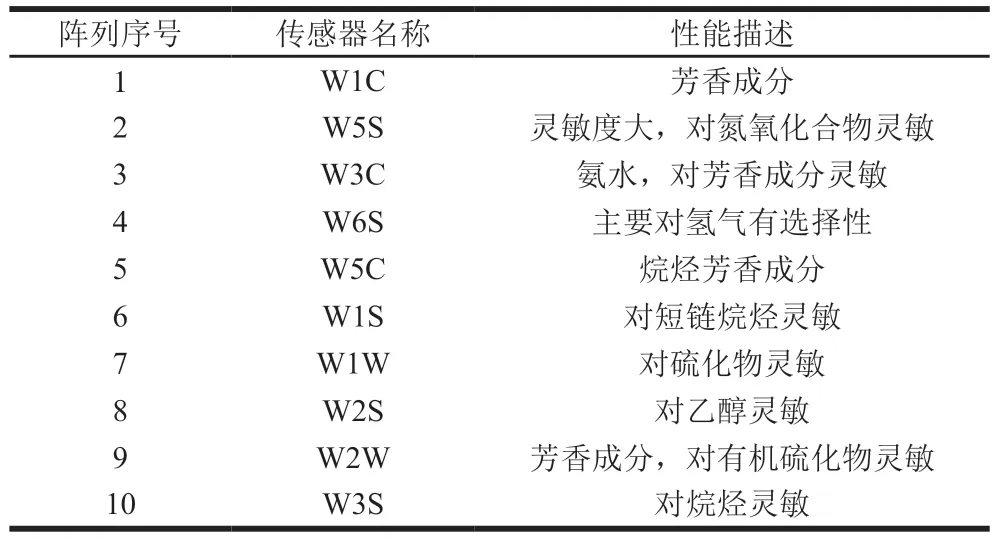
表2 传感器性能描述Table 2 Sensor performance description
1.3.5 挥发性风味物质测定
1.3.5.1 豆豉香味物质的提取
将萃取头插入气相色谱进样口,在250 ℃老化25 min;与此同时将2 g样品与20 mL饱和氯化钠溶液放置于50 mL顶空瓶中,将顶空瓶置于恒温水浴磁力搅拌锅中,在70 ℃预热10 min,将老化完毕的萃取头穿过密封垫插入顶空进样瓶内后推出纤维头(距离样品表面约10 mm),顶空吸附40 min后插入气相色谱进样口解吸5 min即可。
1.3.5.2 豆豉香味物质的分析鉴定
采用GC-MS对提取出来的香味物质进行分析。CD-WAX石英毛细管柱(30 mm×0.25 mm,0.25 μm);载气:高纯氦气(He),流速1 mL/min;进样口温度250 ℃;不分流进样。程序升温:起始柱温为40 ℃,保持5 min后,以3 ℃/min的速率升温至140 ℃保持5 min,再以5 ℃/min的速率升温至210 ℃保持10 min,最后以5 ℃/min的速率升温至240 ℃保持3 min。MS条件:电子电离源;接口温度220 ℃,离子源温度200 ℃,电子能量70 eV,质量扫描范围m/z45~500。
1.3.5.3 豆豉香味物质的定性定量分析
利用质谱数据库NIST 20对挥发性成分进行鉴定,采用面积百分比法计算挥发性化合物的相对含量。
1.3.6 感官评价
参考并修改张佳男[13]感官评定方法。采用排序试验法对不同菌种强化发酵浏阳豆豉成品进行感官评价,感官评价于(25±2)℃的感官评价室进行,对5 位来自湖南农业大学食品科学技术学院的科研人员进行感官评定培训。滋味强度采用10 点线性坐标,0(极弱)~10(极强),品评人员对每个样品与标品进行比较打分,其中2.5/5/7.5/10 分分别对应标准品含量,具体感官评价打分标准参考表3。
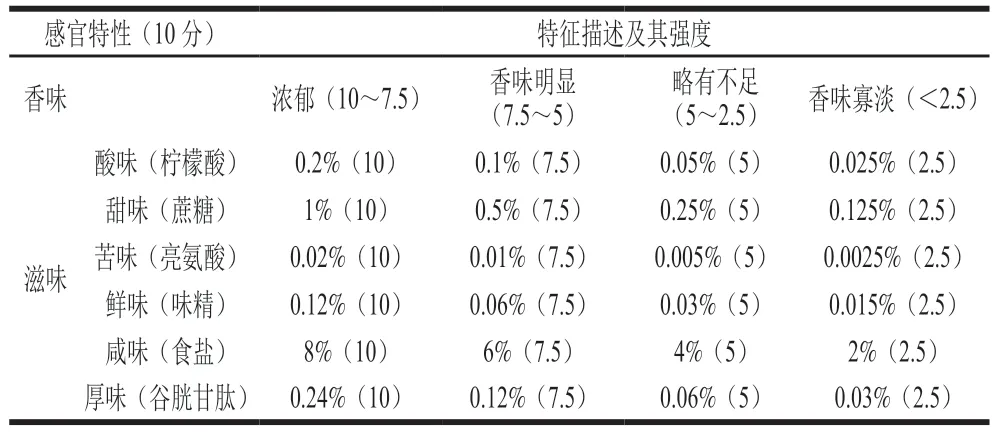
表3 感官评价标准Table 3 Criteria for sensory evaluation of Douchi
1.4 数据处理
采用SPSS 19.0统计分析软件、WinMuster、GM-MS分析软件等分析实验数据;用Excel、DataGraph、OmicStudio tools(https://www.omicstudio.cn/tool)等进行绘图。
2 结果与分析
2.1 不同菌种强化发酵豆豉游离氨基酸结果分析
发酵时,大豆中蛋白质被微生物分泌的蛋白酶分解为多肽和游离氨基酸[14-15]。由图1可知,利用A.oryzae强化发酵豆豉,豆豉中的游离氨基酸总量下降40.70%,而分离菌株强化发酵可提升游离氨基酸总量,范围为19.6%~104.3%,其中A.flavus77强化发酵豆豉和A.flavus7214强化发酵豆豉中游离氨基酸总量最高,分别为12.30%与10.40%,这可能与A.flavus7214具有高产蛋白酶有关[9]。通常,游离氨基酸具有一定的呈味特性,如鲜味(天冬氨酸、谷氨酸)、甜味(苏氨酸、丝氨酸、甘氨酸、丙氨酸)和苦味(缬氨酸、蛋氨酸、异亮氨酸、亮氨酸、酪氨酸、苯丙氨酸、组氨酸、精氨酸)等,对形成豆豉的特殊风味具有重要意义[8]。豆豉中苦味氨基酸的含量占比最高(A.flavus77强化发酵豆豉排居首位为4.03%,A.flavus7214强化发酵豆豉次之为3.36%,A.oryzae强化发酵豆豉最低为1.57%),其次是鲜味氨基酸、甜味氨基酸,这与康蕾等[16]对不同单菌制曲豆酱氨基酸研究分析一致。此外,游离氨基酸中呈鲜味的谷氨酸含量占比最高,结果与大豆原料中含有较高的谷氨酸结论吻合[18],其中,谷氨酸在A.flavus77强化发酵豆豉中含量最高(2.23%),A.flavus7214强化发酵豆豉次之(1.98%)。甜味氨基酸与鲜味间存在协同作用,可使鲜味增强[17]。甜味氨基酸含量最高的样品为A.flavus77强化发酵豆豉及A.flavus7214强化发酵豆豉,最低为A.oryzae强化发酵豆豉,含量分别为2.03%、1.67%及0.55%。
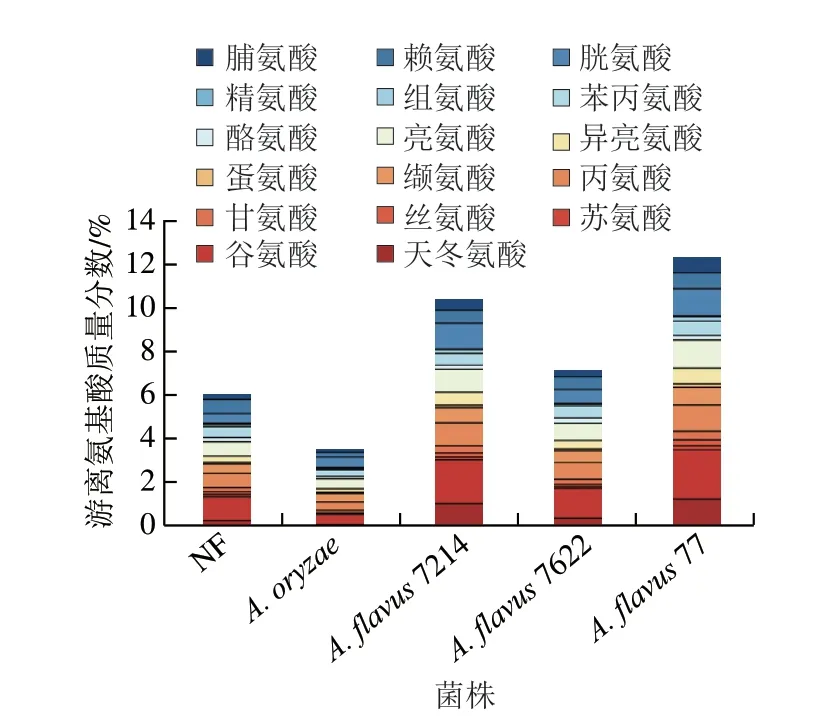
图1 不同菌种强化发酵浏阳豆豉游离氨基酸含量Fig.1 Free amino acid contents in Liuyang Douchi fermented by different strains
2.2 不同菌种强化发酵豆豉有机酸成分分析
有机酸有助于稳定豆豉香气、提高豆豉品质[19]。如图2所示,按照不同菌种发酵浏阳豆豉有机酸总含量由大到小进行排序为A.flavus7622>A.flavus77>A.flavus7214>A.oryzae>NF,可知浏阳豆豉有机酸含量因强化发酵而提升,增幅范围在0.08~0.55 mg/g之间。所有样品中草酸、酒石酸以及苹果酸的含量均不足0.05 mg/g,且阈值较高,对风味影响的不明显。乳酸、乙酸、柠檬酸和丁二酸含量较高且各样品间差异较大。其中乳酸为酯类物质的前体物质,酯类香气化合物可因乳酸含量的增加而增多,并且由于乳酸具有柔和的口感,因此也会使豆豉的口感顺滑绵长[20],除A.flavus77强化发酵豆豉外,其余样品中乳酸含量较NF豆豉均有增加,A.flavus7622强化发酵豆豉中增加幅度最大(57.24%)。乙酸味道刺激[21],低浓度时可使豆豉口感丰富,强化发酵豆豉中乙酸均出现不同程度的增长(0.01~0.39 mg/g),上调最大的为A.flavus77强化发酵豆豉。有报道称乳酸与乙酸比值越大,产品口感越柔和[22],NF豆豉比值最高,约为119。柠檬酸酸味较强,口感圆润清爽[23],A.flavus77与A.flavus7622强化发酵的豆豉中柠檬酸含量分别增加了0.10 mg/g和0.11 mg/g。丁二酸又名琥珀酸,具有酸味、咸味、苦味等特点,且呈味阈值低,对豆豉的风味具有重要影响[21]。A.oryzae、A.flavus7214与A.flavus7622强化发酵豆豉中丁二酸的含量较高,特别是A.flavus7622强化发酵豆豉(0.28 mg/g)。

图2 不同菌种强化发酵浏阳豆豉有机酸含量Fig.2 Contents of organic acids in Liuyang Douchi fermented by different strains
2.3 不同菌种强化发酵豆豉挥发性成分分析
5 种不同菌种强化发酵的浏阳豆豉经过GC-MS分析共鉴定出了9 类化合物,共92 种物质,分别为酯类(20 种)、酸类(11 种)、醛类(12 种)、酮类(9 种)、醇类(7 种)、吡嗪类(8 种)、烷烃类(10 种)、酚类(7 种)和其他化合物(8 种)。根据图3a可知,不同样品检出的风味物质组成差异明显。NF中吡嗪类及酸类为主要化合物,分别占其总挥发性物质的33.84%与17.48%。A.oryzae强化发酵豆豉则以酸类(24.62%)、醛类(16.37%)为主;分离菌株中,A.flavus77与A.flavus7214强化发酵豆豉的酸类与醛类占比最多,相较于NF均有不同程度提高,A.flavus7214强化发酵豆豉分别增长17.55%和7.9%,A.flavus77强化发酵豆豉分别提升25.76%和6.28%。A.flavus7622强化发酵豆豉则以酸类(13.98%)及吡嗪类(13.15%)为主,对比NF,前者上升11.21%,后者下降6.84%。整体而言,酸类、醛类和吡嗪类是5 种不同菌种发酵浏阳豆豉的主要化合物。N F 豆豉及强化发酵豆豉(A.oryzae、A.flavus7214、A.flavus7622和A.flavus77)中分别被检测出51、57、46、41、43 种挥发性化合物,而5 种不同菌种豆豉共有的化合物仅20 种(图3b),如乙酸、3-甲基丁醛、苯甲醛、苯乙醛、四甲基吡嗪、2-甲氧基苯酚等,而5 种不同菌种豆豉样品的特有成分分别有12、11、7、5 种以及2 种,表明强化发酵能够影响豆豉的挥发性物质的形成,进一步影响豆豉香气。
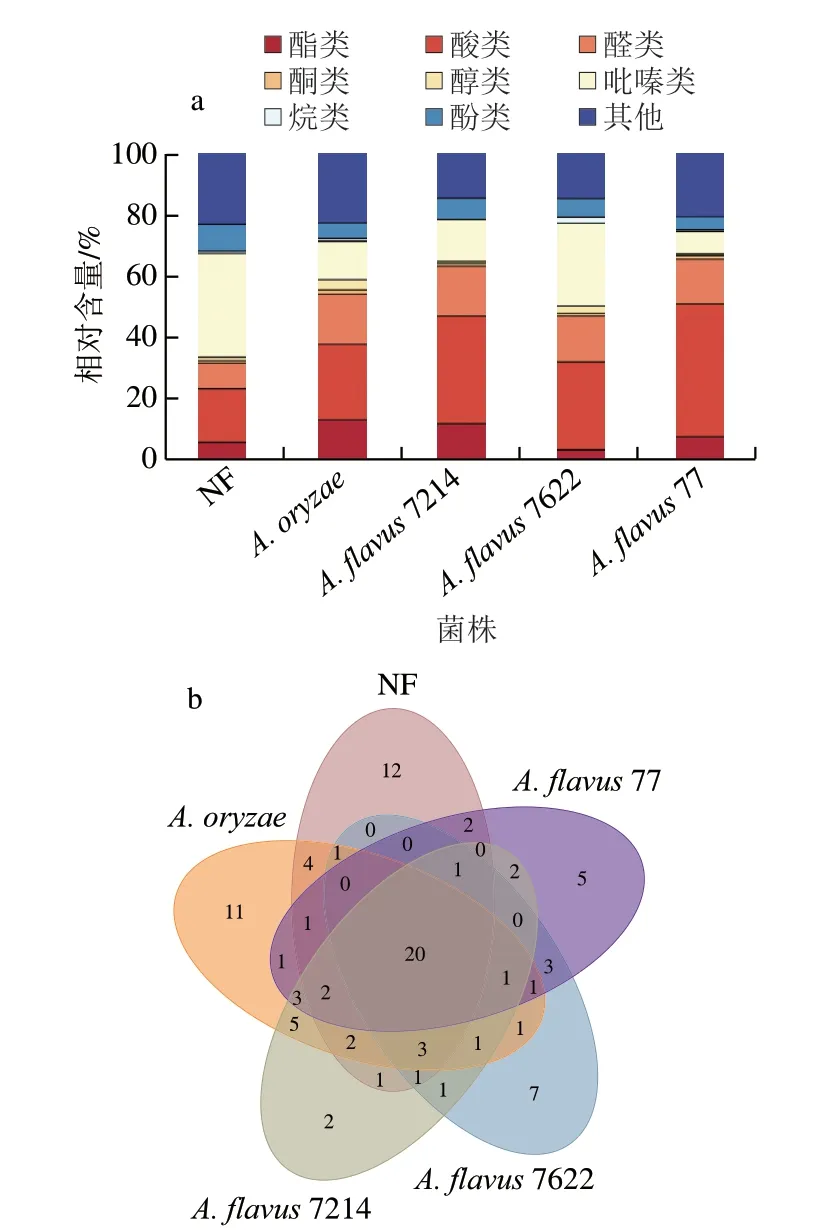
图3 不同菌种强化发酵浏阳豆豉各挥发性化合物种类相对含量(a)和数量Venn图(b)Fig.3 Relative contents of volatile compounds (a) and Venn diagram of numbers of volatile compound species (b) in Liuyang Douchi fermented by different strains
大多数酯类产生香味可使人心情愉悦,能够赋予豆豉花果的香气[24-25]。如表4所示,A.oryzae强化发酵豆豉中酯类化合物相对含量最高,A.flavus7214略低,NF与A.flavus7622强化发酵豆豉中酯类化合物相对含量最低。3-甲基-1-丁醇乙酸酯、苯甲酸乙酯、苯乙酸乙酯、2-乙酸苯乙酯为5 种样品共有物质,但相对含量少且样品间差异不明显。苯乙酸甲酯、2-羟基-3-苯基丙酸乙酯、十六烷酸甲酯、亚油酸乙酯、2-甲基丁酸乙基酯、9,15-十八碳二烯酸甲酯、十八碳烯酸乙酯、十八烷酸乙酯均为强化发酵产生的挥发性化合物。其中亚油酸乙酯仅在A.flavus7622和A.flavus7214强化发酵豆豉中存在,且在A.flavus7214强化发酵豆豉中相对含量较高(4.95%),亚油酸乙酯是一种能产生果香味的高级脂肪酸[21],能使浏阳豆豉香味更加协调、浓郁。

表4 不同菌种强化发酵浏阳豆豉挥发性成分Table 4 Volatile components of Liuyang Douchi fermented by different strains
醛类物质主要由不饱和脂肪酸的氧化以及Strecker降解两条路径产生,阈值较低,对豆豉风味贡献较大[26-27]。如表4所示,5 种样品的醛类化合物相对含量由大到小分别为:A.oryzae、A.flavus7214、A.flavus7622、A.flavus77、NF。其中3-甲基丁醛、苯甲醛和苯乙醛相对含量最高,且为5 种豆豉的共有物质。3-甲基丁醛具有独特的麦芽味、坚果味、巧克力味,阈值较低(0.06 μg/kg)[28-29],其在A.oryzae与A.flavus7214强化发酵豆豉中相对含量最高,比NF分别提升了127.70%与98.65%。苯甲醛广泛存在于植物中,具有坚果香味,可为豆豉提供类似酱油的咸香和酱香[30]。与NF豆豉相比,强化发酵豆豉中苯甲醛均有不同程度增加,其中A.flavus7214与A.flavus7622强化发酵对苯甲醛相对含量提升幅度最大(均为69%)。苯乙醛可为豆豉提供花香、甜香、蜂蜜香[31]。强化发酵豆豉中苯乙醛相对含量均高于NF豆豉。强化发酵还会产生一些新的物质,反-2-壬烯醛为A.flavus7214强化发酵豆豉的特征成分,其主要由酯类与游离脂肪酸反应及糖化时不饱和脂肪酸氧化而产生[32],呈现出黄瓜味与烤肉味[33]。2-庚醛则为A.flavus7622强化发酵豆豉的特征成分,具有草香气味[34]。2-八烯醛仅在A.flavus7214及A.flavus77强化发酵豆豉中产生,可给予豆豉似黄瓜的清香味[35]。
吡嗪是由蛋白质/氨基酸热分解及蛋白质/氨基酸与糖发生美拉德反应产生[36]。如表4所示,5 种样品中,NF的吡嗪类物质相对含量最高,其次依次是A.flavus7622强化发酵豆豉、A.flavus7214强化发酵豆豉、A.oryzae强化发酵豆豉及A.flavus77强化发酵豆豉。四甲基吡嗪与2,3,5-三甲基-6-乙基吡嗪是5 种样品共有的物质。呈现酱香味的四甲基吡嗪相对含量最多,通常与细菌代谢有关[30],强化发酵时曲霉数量的增加可能导致细菌增殖和代谢被抑制,因此强化发酵豆豉所产生的四甲基吡嗪相对含量不及NF豆豉。
酸类物质多具有刺激性气味[37],如表4所示,强化发酵豆豉中酸类化合物相对含量均高于NF豆豉,其中A.flavus77强化发酵豆豉中酸类化合物相对含量最高(43.21%)。乙酸是相对含量最高的酸类化合物,相较于NF豆豉,强化发酵豆豉中乙酸相对含量均有不同程度增加,A.flavus7622强化发酵豆豉相对含量提升幅度最大,为9.38%,此结果与有机酸结果不一致,可能由于在发酵过程中豆豉会同时产生挥发性和非挥发性酸,而使用GC-MS检测未经处理的样品时,仅可识别到样品中挥发性酸[38]。
酚类物质一般呈现烟熏香与木香[39],如表4所示,强化发酵豆豉的酚类化合物相对含量不及NF豆豉高。醇类物质多来源于微生物对糖/氨基酸的发酵代谢作用[26],其相对含量总量为A.oryzae>A.flavus7622>NF>A.flavus7214>A.flavus77。酮类化合物一般通过不饱和脂肪酸氧化/降解及氨基酸降解产生,通常表现出花香和果香[40]。但其在5 种样品中整体差异不大,且相对含量较低,对风味的贡献有限。烃类化合物尽管相对含量不低,但其阈值通常较高,因此对产品风味贡献不大[41]。
2.4 不同菌种强化发酵豆豉电子鼻结果分析
如图4a所示,不同传感器对样品表现出不同的响应强度,其中W5S(灵敏度大,对氮氧化合物灵敏)、W1S(对短链烷烃灵敏)、W1W(对硫化物灵敏)、W2W(芳香成分,对有机硫化物灵敏)四个传感器对豆豉的响应值较高(响应值>4)。A.oryzae强化发酵豆豉在W1S的响应值最高,可见其短链烷烃含量较多,A.flavus7214强化发酵的浏阳豆豉在W5S、W1W、W2W的响应值最高,说明A.flavus7214强化发酵的豆豉中氮氧化合物、芳香化合物以及硫化物含量较高。各样品在其余6 个传感器的响应值较低且差异较小。整体上看,NF和A.flavus7622强化发酵豆豉的雷达分析图谱几乎重叠,提示这两种发酵方式生产的豆豉主要挥发性化合物较为相似。
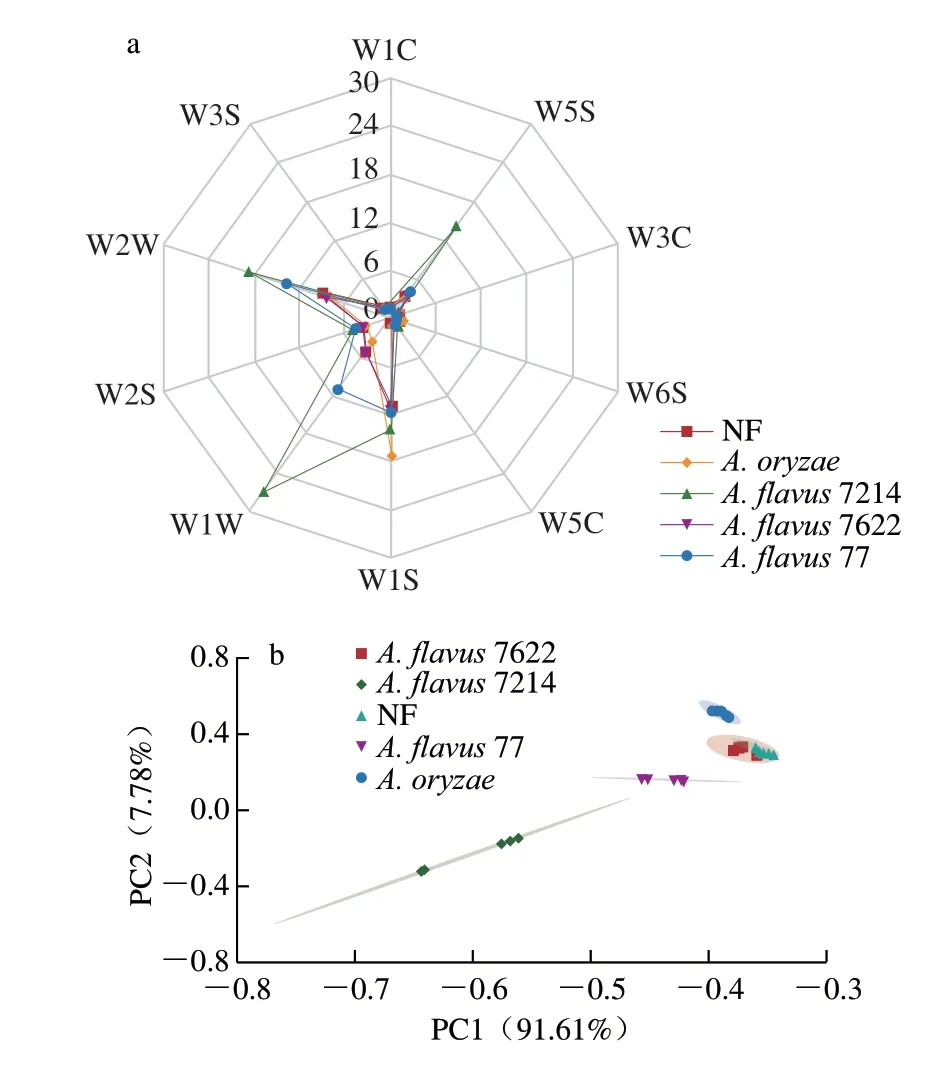
图4 不同菌种强化发酵浏阳豆豉电子鼻雷达(a)及PCA(b)图Fig.4 Radar map (a) and PCA plot (b) of Liuyang Douchi fermented by different strains based on electronic nose data
选取80~83 s的信号作为电子鼻分析的时间点,每个样品平行测定4 次进行主成分分析(principal component analysis,PCA)。PCA是将采集到的传感器响应值信号进行数据转换、降维,并将其线性分类,包含PC1、PC2方差贡献率。方差贡献率越高,说明该指标能较好地反映原多指标信息。一般情况下,总贡献率在70%~80%以上时可使用[42]。由图4b可知,5 种样品在PC1贡献率为91.61%,PC2贡献率为7.78%,累计贡献率为99.39%,基本涵盖了样品的大部分原始信息,且差异主要表现在PC1上。不同菌种浏阳豆豉样品在气味上有所差异,A.flavus7622强化发酵豆豉与NF豆豉部分重叠,可见其气味相近。A.flavus7214样品与其他4 种样品相互之间距离相对较远,其气味与其他4 种样品区别较大。
2.5 不同菌种强化发酵豆豉感官评价结果分析
如图5所示,A.flavus7214强化发酵豆豉香味得分明显高于其他样品,A.flavus7622强化发酵豆豉评分最低。这可能因为A.flavus7214强化发酵豆豉中对香味贡献最大的酯类、醛类以及酸类成分均明显高于NF(图3a)。在滋味方面,强化发酵豆豉的鲜味与咸味增加最明显。鲜味在5 种样品中普遍较强,根据李学贤等[17]对游离氨基酸改善作物风味的综述内容可推测与甜味氨基酸与鲜味的协同作用有关(图1)。从结果看,分离菌株强化发酵可以增进豆豉的鲜味,尤其是A.flavus7214及A.flavus77强化发酵豆豉鲜味强度较高,较NF相比评分高约30%,与鲜味游离氨基酸结果一致(图1)。A.flavus77的咸味提升最明显(从3.6 分升至5.0 分),这可能是由于豆豉中浓度较高的鲜味氨基酸提升了舌头对咸味的感知[43]。适当的酸味可以给豆豉滋味增加一定层次感,仅A.flavus77发酵豆豉强度低于NF,A.flavus7214强化发酵豆豉酸味较强(4.0 分),与有机酸结果有较小差异,可能与有机酸之间的协同、掩蔽及抑制作用有关[22],同时有机酸阈值高低也会对感官结果产生影响[44-45]。苦味虽不愉悦,但是可以增加一定的丰富度。除A.oryzae强化发酵豆豉外,其余样品豆豉的苦味均强于NF豆豉,其中A.flavus77强化发酵豆豉苦味感知最强,为4.8 分,这可能与豆豉中呈苦味游离氨基酸的增加有关(图1)。甜味作为大众接受度最高的滋味,只有A.flavus7214强化发酵豆豉强于NF豆豉,其余样品甜味均弱于NF豆豉。综上,风味变化最明显的为A.flavus7214强化发酵豆豉。
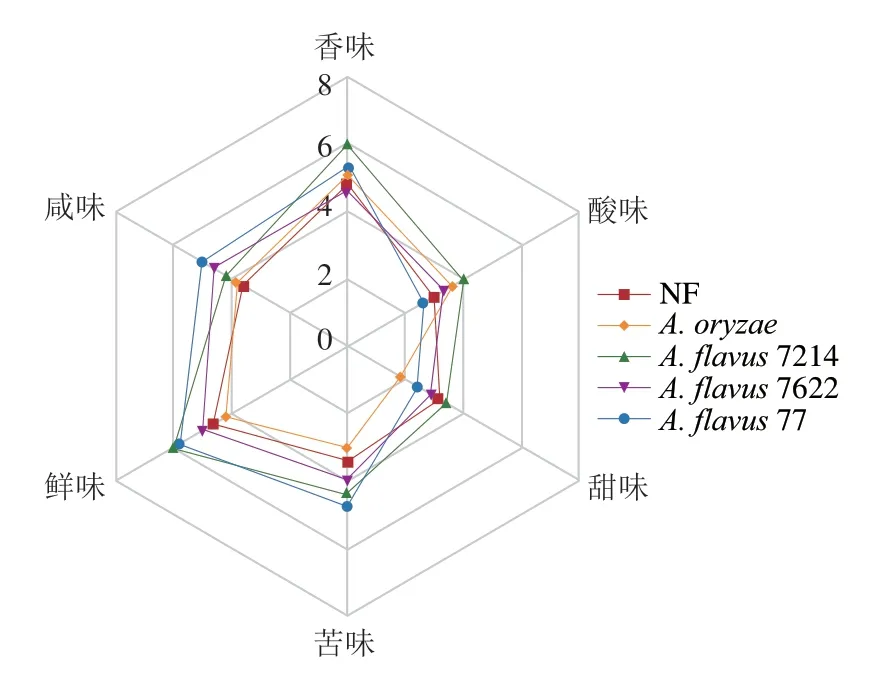
图5 不同菌种强化发酵浏阳豆豉感官雷达图Fig.5 Sensory evaluation radar map of Liuyang Douchi fermented by different strains
3 结论
分离菌株强化发酵豆豉对比NF豆豉,游离氨基酸与有机酸总量分别提升19.6%~104.3%和0.08~0.55 mg/g。特别是A.flavus77菌株强化发酵对谷氨酸以及乙酸释放的促进效果明显(分别提升108.41%和182.24%),说明强化发酵有助于浏阳豆豉的蛋白降解及有机酸的形成。通过GC-MS从各豆豉样品中鉴定出9 类化合物共92 种物质,其中酯类化合物种类最丰富(20 种),酸类化合物总计相对含量最高,共有的挥发性化合物仅20 种。较NF相比,强化发酵豆豉的酯类、醛类以及酸类化合物含量有明显增长,特别是苯乙醛与苯甲醛,给予豆豉花香、坚果香。此外,强化发酵还会生成一些新的挥发性化合物,如散发果香味的亚油酸乙酯、带来清香的2-八烯醛。电子鼻数据显示,A.flavus7622强化发酵豆豉与NF豆豉差异最小。而A.flavus7214强化发酵豆豉与其他样品差异明显,且对氮氧化合物、芳香成分及有机硫化物更为灵敏。感官评价结果亦显示,A.flavus7214强化发酵豆豉整体风味更好,香味突出(6.0 分),鲜味与甜味也较强(分别为6.0 分和3.6 分)。综上,强化发酵可以通过促进游离氨基酸、有机酸以及挥发性化合物质的释放,实现对豆豉风味的调控。本研究有助于揭示强化发酵对浏阳豆豉品质的影响,可为浏阳豆豉的生产标准化、可控化以及工厂化生产提供理论指导。

