1 株新型降解玉米赤霉烯酮的沙福芽孢杆菌及其关键酶分析
赵程程,孙长坡,孙 晶,王 峻,刘虎军
(国家粮食和物资储备局科学研究院,北京 100037)
玉米赤霉烯酮(zearalenone,ZEN)是由禾谷镰刀菌、三线镰刀菌、黄色镰刀菌等多种镰刀菌产生的次级代谢产物,是污染粮食谷物最广泛的真菌毒素之一,谷实类原料在田间、收获过程、收获后储藏期间以及饲料和食品成品储存、使用等诸多环节中,都有可能受到ZEN的污染,ZEN在玉米、高粱、燕麦、小麦、谷子、豆类等农作物及其制品中的污染均有报道[1-2]。ZEN及其代谢产物具有与17β-雌二醇相似的结构,可竞争性地结合生殖器官中的雌激素受体,主要破坏动物的生殖系统,同时破坏免疫系统,并具有一定的肝毒性、细胞毒性和潜在的致癌性,已被国际癌症研究机构列为Ⅲ类致癌物[3-5]。我国制订了ZEN国家限量标准,配合饲料、玉米中的ZEN含量不超过500 μg/kg[6],谷物及其制品中ZEN含量应低于60 μg/kg[7]。雷元培等[8]随机抽取2019年和2020年国内各省区域的玉米、玉米副产物、小麦及麸皮、杂粕和全价饲料等样品,ZEN检出率超过82%,尤其玉米副产物中ZEN检出率为100%,超标率大于17%。ZEN的毒性和污染普遍性给食品安全和人类健康带来严重威胁,因此,脱除或降解ZEN以避免其通过饲料和食品原料进入食物链非常有必要。
目前对ZEN的脱毒主要有物理、化学和生物方法。常规的物理和化学法存在降解效率低、营养物质流失和使用设备较为昂贵等问题,利用微生物或酶对ZEN进行降解的方法更为绿色、高效和安全[9-11]。微生物在生长过程中能够通过代谢或分泌的酶对ZEN进行转化,生成低毒或无毒的产物,因而ZEN降解菌株的筛选和降解酶的挖掘一直是生物方法消减ZEN的研究热点。Kakeya等[12]筛选得到1 株粉红螺旋聚孢霉(Clonostachys rosea)IFO 7063能够将ZEN转化成无雌激素活性的降解产物,并确定降解过程的关键酶为内酯水解酶ZHD101[13]。Kosawang等[14]研究也表明由于ZHD101对ZEN的脱毒,粉红螺旋聚孢霉对禾谷镰刀菌的生长具有拮抗作用,可用于ZEN的生物防控。Altalhi等[15]筛选得到可降解ZEN的恶臭假单胞菌(Pseudomonas putida)ZEA-1,并从菌株质粒中克隆得到降解酶的表达盒,在大肠杆菌中重组表达后可高效降解ZEN。Molnar等[16]从白蚁后肠中分离到1 株酵母菌Trichosporon mycotoxinivorans可以同时降解赭曲霉毒素A和ZEN,Vekiru等[17]进一步解析该酵母菌对ZEN的降解产物为ZOM-1,ZOM-1并未表现出雌激素活性。Złoch等[18]发现副干酪乳杆菌(Lactobacillus paracasei)能够将ZEN转化成毒性减弱的β-玉米赤霉烯醇。近年来芽孢杆菌对ZEN的降解能力被广泛报道。Chen等[19]分离几株能够降解ZEN的芽孢杆菌,其中枯草芽孢杆菌(Bacillus subtilis)B2可用于ZEN污染玉米的发酵,能够提高其发酵特性。段锦等[20]从发霉饲料、动物粪便等样品分离鉴定出的降解ZEN枯草芽孢杆菌和解淀粉芽孢杆菌能够缓解ZEN中毒引起的小鼠脏器损伤。Zhu Yan等[21]从玉米青贮饲料样品中筛选ZEN降解菌株时,分离到的芽孢杆菌S62-W能够快速脱除ZEN,并解析其机制是对ZEN进行磷酸化修饰生成新型衍生物ZEN-14-磷酸盐(ZEN-14-phosphate,ZEN-14P);Yang Shibin等[22]也在筛选时发现枯草芽孢杆菌(Bacillus subtilis)Y816能够对ZEN、α-玉米赤霉烯醇和β-玉米赤霉烯醇进行转化,生成其磷酸化产物,通过转录组测序分析获得ZEN转化过程的关键作用酶是ZEN磷酸转移酶(ZEN phosphotransferase,ZPH),并通过基因工程酵母传感器表征雌激素活性的方法表明ZEN-14P的雌激素活性与ZEN相比有明显下降。但是目前ZEN降解菌株和ZEN降解酶资源仍然较为匮乏。
本研究从安徽、山东的小麦样品中筛选能够快速降解ZEN的新型菌株,挖掘降解菌株中的关键酶基因,旨在为粮食谷物中真菌毒素的污染控制提供新的菌种和酶资源。
1 材料与方法
1.1 材料与试剂
小麦样品取样自安徽、山东。
甲醇、乙腈(均为色谱级)美国Thermo Fisher公司;甲酸、甲酸铵(均为质谱级)美国Sigma-Aldrich公司;ZEN为国家有证标准样品(GSB 11-3429-2017),纯度>98%;PremixTaq(ExTaqVersion 2.0)、PrimeSTAR HS(Premix)、DNA Ligation Kit宝日医生物技术(北京)有限公司;胰蛋白胨和酵母提取物 英国Oxoid公司;马铃薯浸出粉 北京奥博星生物技术有限责任公司;其他常规试剂均为国产分析纯。
基础盐培养基(minimal salt medium,MSM)配方(1 L):(NH4)2SO40.5 g,MgSO4·7H2O 0.2 g,Na2HPO4·12H2O 6.15 g,KH2PO41.52 g,CaCl20.05 g,pH 7.0~7.2;LB培养基配方(1 L):NaCl 10 g,胰蛋白胨10 g,酵母提取物5 g,固体培养基添加1.5%~2.0%的琼脂粉;马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基配方(1 L):马铃薯浸出粉10 g,葡萄糖20 g,琼脂粉15 g;磷酸盐缓冲液(phosphate buffered saline,PBS)配方(1 L):NaCl 8 g,K C l0.2 g,Na2HPO4·12 H2O 3.63 g,KH2PO40.24 g,pH 7.4。
1.2 仪器与设备
e2695高效液相色谱(high performance liquid chromatography,HPLC)仪(配备2475荧光检测器、2489二极管阵列检测器)美国Waters公司;UPLC1290-QTOF6545超高效液相色谱-四极杆飞行时间串联高分辨质谱(ultra-high performance liquid chromatography-quadrupole time-of-flight tandem mass spectrometry,UPLC-QTOF-MS/MS)联用仪 美国Agilent公司;生物安全柜 美国ESCO公司;C1000聚合酶链式反应(polymerase chain reaction,PCR)仪、Gel Doc XR+凝胶成像仪 美国Bio-Rad公司。
1.3 方法
1.3.1 ZEN降解菌的筛选和分离
取5 g小麦样品置于50 mL离心管,加入5 mL生理盐水,30 ℃、200 r/min摇床振荡2 h后静置10 min,取上层液体50 μL到450 μL MSM培养基中(其中ZEN初始质量浓度为10 μg/mL),以不加菌液、含有相同质量浓度ZEN的MSM培养基作为空白对照,30 ℃、200 r/min振荡培养7 d,然后取50 μL到新的MSM培养基中(其中ZEN质量浓度为10 μg/mL)富集3 次,培养7 d后HPLC检测ZEN残留量。验证具有降解效果的样品稀释后分别涂布于PDA和LB平板上,然后挑取纯化后单菌落接种到500 μL含10 μg/mL ZEN的MSM培养基中,30 ℃、200 r/min振荡培养培养7 d后检测ZEN残留量。选取降解效果较好的菌株,接种至LB液体培养基,在30 ℃、200 r/min培养20 h,吸取一定量发酵液接种至含10 μg/mL ZEN的MSM培养基(起始OD600nm=1.0)中,定时取样检测ZEN残留量。
样品中ZEN含量采用HPLC测定,色谱柱为Waters XBridge®C18(4.6 mm×250 mm,5 μm)。流动相为乙腈∶水=1∶1,流速1.0 mL/min,柱温30 ℃,进样10 μL,荧光检测器激发波长274 nm,发射波长440 nm。ZEN降解率计算如式(1)所示:
1.3.2 菌株鉴定
形态鉴定:分离得到的菌株在LB平板划线,30 ℃培养24 h观察菌落形状、大小、边缘、表面、隆起形状、透明度、菌落颜色等。对菌株进行革兰氏染色,在光学显微镜下观察细胞的形态特征。
16S rDNA序列比对与进化分析:对筛选获得的菌株,按照细菌基因组DNA提取试剂盒操作说明提取基因组DNA作为模板,进行16S rDNA序列扩增,引物为27F(5’-AGAGTTTGATCCTGGCTCAG-3’)和1492R(5’-TACCTTGTTACGACTT-3’),PCR扩增体系:27F 1 μL,1492R 1 μL,模板1 μL,ExTaq酶25 μL,ddH2O 22 μL。PCR扩增程序:94 ℃预变性5 min,94 ℃变性1 min,54 ℃退火1 min,72 ℃延伸2 min,循环30 次。PCR产物经1%琼脂糖凝胶检测并切胶回收纯化后测序分析,将测序结果在NCBI上进行BLAST比对,并使用MEGA7.0构建进化树。
促旋酶B亚单位(gyrase B,gyrB)基因序列比对与进化分析:以提取的细菌基因组DNA为模板,进行gyrB序列扩增,引物为UP-1(5′-GAAGTCATCATGAC CGTTCTGCAYGCNGGNGGNAARTTYGA-3′)和UP-2r(5′-AGCAGGGTACGGATGTGCGAGCCRTCNACRTCN GCRTCNGTCAT-3′)[23-25],PCR扩增体系:UP-11 μL,UP-2r 1 μL,模板1 μL,ExTaq酶25 μL,ddH2O 22 μL。PCR扩增程序:94 ℃预变性5 min,94 ℃变性1 min,63 ℃退火1 min,72 ℃延伸2 min,循环35 次。PCR产物经1%琼脂糖凝胶检测并切胶回收纯化后测序分析,将测序结果在NCBI上进行BLAST比对,并使用MEGA7.0构建进化树。
1.3.3 菌株吸附与降解ZEN活性
将菌株M7L4培养至稳定期的LB液体培养物进行等分,一部分作为发酵液,另一部分经5 000 r/min离心5 min,收集的培养基上清液,经0.22 μm无菌PES滤膜后,一部分作为发酵上清液暂存于4 ℃,一部分经121 ℃、20 min的高压蒸汽处理,作为灭活发酵上清液。收集的菌体分为3 部分,一部分用MSM洗涤菌体3 次后用等体积的MSM重悬,作为细胞重悬液;一部分用MSM洗涤3 次后用等体积的MSM重悬,经121 ℃、20 min的高压蒸汽处理,作为灭活细胞重悬液;另一部分用PBS洗涤后用等体积的PBS重悬,然后在冰浴中超声破碎,12 000 r/min、4 ℃离心20 min,离心上清液经0.22 μm无菌PES滤膜后,作为胞内液。
取5 μL 1 mg/mL ZEN溶液作为底物,加入495 μL上述各反应组分,置于摇床,37 ℃、200 r/min孵育24 h后取样进行HPLC检测ZEN残留量并计算降解率。
1.3.4 菌株M7L4对ZEN的降解产物解析
将菌株M7L4培养至稳定期的发酵液收集菌体,用MSM洗涤菌体3 次后,用等体积MSM重悬菌体并接种到含有ZEN的MSM反应体系中(M7L4菌体的起始浓度OD600nm=0.1,ZEN质量浓度为10 μg/mL),定时取样,UPLC-QTOF-MS/MS检测菌株M7L4对ZEN的降解及产物生成情况,通过降解产物的质荷比(m/z)和二级质谱结果解析产物结构。
UPLC-QTOF-MS/MS测定条件:色谱柱为Agilent Poroshell 120 EC-C18(2.1 mm×100 mm,2.7 μm);流动相:A 相为水(含0.1%甲酸和5 mmol/L 甲酸铵),B相为甲醇(含0.1%甲酸)。梯度洗脱程序:0~1 min,90% A、10% B;1~1.5 min,90%~55% A、10%~45% B;1.5~8.5 min,55%~0% A、45%~100% B,保持1 min后回到初始流动相保持0.5 min,准备下一次进样。流速为0.3 mL/min,柱温度为30 ℃,进样2 μL。采用电喷雾电离源,负离子模式扫描,扫描范围为m/z100~1 700;二级质谱中的诱导碰撞解离能量为20 eV。
1.3.5 菌株M7L4中降解酶的基因克隆与蛋白表达
根据文献报道ZPH 能够将ZEN 转化成ZEN-磷酸盐(ZEN-phosphate,ZEN-P)[22],在NCBI数据库搜索到沙福芽孢杆菌中磷酸烯醇丙酮酸利用酶(Bacillus safensisphosphoenolpyruvate-utilizing enzyme,BsaPUE)基因与zph基因(GenBank Accession No.MZ 170042.1)具有一定相似度。设计简并引物BsaPUE-F(5’-CGGGATCCATGTATTCAGTTTTATTTCAT GC-3’)和BsaPUE-R(5’-CCGCTCGAGKRCACGYG MATGCTGYTTTAAWATC-3’)从沙福芽孢杆菌M7L4中扩增BsaPUE,PCR扩增体系为:BsaPUE-F1 μL,BsaPUE-R1 μL,模板1 μL,PrimeSTAR HS(Premix)酶25 μL,ddH2O 22 μL。PCR扩增程序为:98 ℃预变性5 min,98 ℃变性10 s,55 ℃退火5 s,72 ℃延伸2 min 40 s,循环30 次。PCR产物经1%琼脂糖凝胶检测并切胶回收纯化后采用限制性内切酶XhoI和BamH I分别对载体pET-28a(+)和BsaPUE的PCR纯化产物进行双酶切,纯化回收的载体与BsaPUE基因经Solution I连接,转化大肠杆菌DH5α感受态细胞后提取pET-28a(+)-BsaPUE质粒,测序正确的pET-28a(+)-BsaPUE质粒转化大肠杆菌BL21(DE3)感受态细胞,获得BsaPUE表达菌株大肠杆菌BL21(DE3)(pET-28a(+)-BsaPUE)。挑取平板上单克隆接种到5 mL LB液体培养基(含50 mg/L卡那霉素),37 ℃、220 r/min条件下过夜培养,次日以1%接种于50 mL LB液体培养基(含50 mg/L卡那霉素),37 ℃、220 r/min条件下培养至OD600nm=0.6~0.8,加入终浓度为0.8 mmol/L的异丙基-β-D-硫代半乳糖苷,18 ℃、180 r/min条件下过夜培养后8 000 r/min离心收集菌体,超声破碎后离心上清液为粗酶液,再经Ni-NTA纯化得到纯化酶液。
1.3.6 重组酶BsaPUE对ZEN的转化效果验证
重组酶BsaPUE对ZEN转化体系体积为500 μL,取5 μL 1 mg/mL ZEN溶液作为底物,反应组1加入10 μL纯化的BsaPUE酶液,PBS补齐反应体系;反应组2加入10 μL纯化的BsaPUE酶液、10 μL ATP(终浓度10 mmol/L)和50 μL Mg2+(终浓度20 mmol/L),PBS补齐反应体系;反应组3加入495 μL菌株大肠杆菌BL21(DE3)(pET28a-BsaPUE)的细胞重悬液(菌体收集后用PBS洗涤3 次后用等体积的PBS重悬);以不加酶/菌液、含有相同质量浓度ZEN的PBS作为空白对照。反应体系置于摇床,37 ℃、200 r/min反应30 min后加入500 μL甲醇制备样品,进行检测。
ZEN转化产物采用HPLC测定,色谱柱为Waters XBridge®C18(4.6 mm×250 mm,5 μm);流动相:A相为水(含0.5%甲酸),B相为甲醇。梯度洗脱程序:0~10 min,50%~0% A、50%~100% B;10~11 min,0%~50% A、100%~50% B,保持5 min,准备下一次进样。流速为1.0 mL/min,柱温度为30 ℃,进样10 μL。ZEN转化率计算如式(2)所示:
1.4 数据处理
相关数据使用Microsoft Excel 2013软件处理,图表使用GraphPad Prism 6软件绘制,质谱数据采用Mass Hunter软件分析与处理。
2 结果与分析
2.1 ZEN降解菌株的筛选
采集的100 份样品进行3 次富集后,具有ZEN降解能力的样品有11 份(M1~M11),在LB平板和PDA平板上稀释涂布,挑取平板上形态不同的菌落再次划线纯化,然后挑取纯化后23 个单菌落分别接种到含有ZEN的MSM反应体系(ZEN质量浓度为10 μg/mL)中,培养7 d,其中6 个菌株M3P2、M5L2、M7L1、M7L4、M11L2、M11P2具有明显ZEN降解效果,降解率分别为 96.14%、53.22%、75.16%、100%、63.34%和66.49%,对菌株M3P2和M7L4降解ZEN的效果进行复证,如图1所示,来源于安徽宿州的小麦样品中分离到的菌株M7L4较其他菌株降解能力更高效,该菌株经LB培养基培养的发酵液24 h内对10 μg/mL ZEN的降解率高于95%,因此选择此菌株作为后续研究对象。
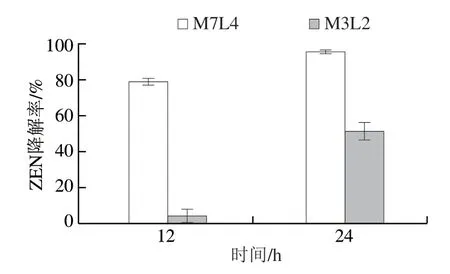
图1 M3P2和M7L4菌株对ZEN降解效果复证Fig.1 ZEN degradation capacity of strains M7L4 and M3P2
2.2 菌株M7L4的鉴定
菌株M7L4在LB培养基上可较好生长(图2A),菌落符合细菌特征。30 ℃培养24 h后如图2B所示,菌落为白色不透明,边缘较为规则,表面光滑且扁平。显微镜下形态如图2C所示,菌体细胞呈短杆状,革兰氏染色为阳性。
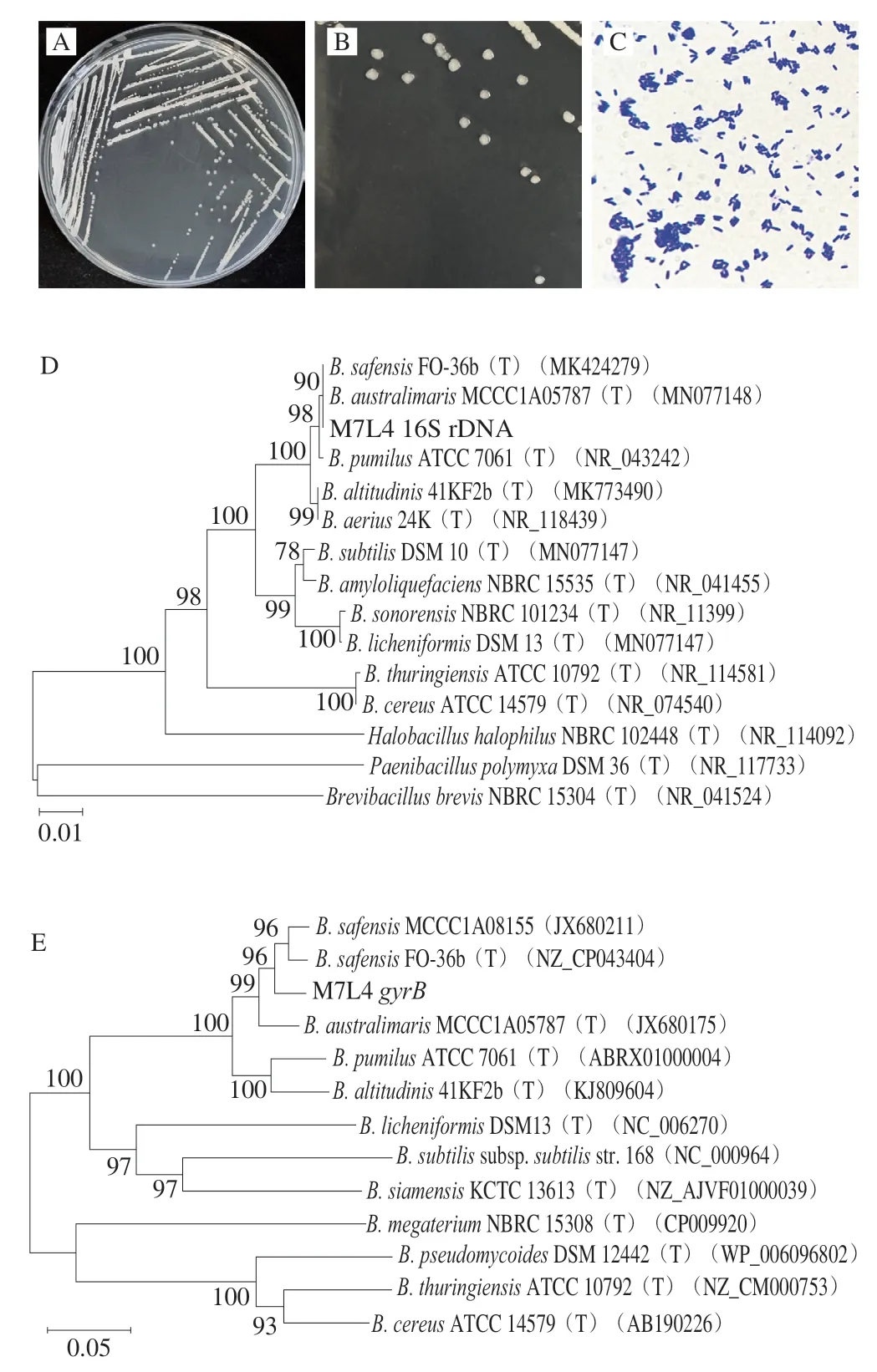
图2 菌株M7L4的鉴定Fig.2 Identification of strain M7L4
采用细菌的16S rDNA通用引物27F/1492R扩增菌株M7L4基因组上的保守序列,扩增产物的测序结果在NCBI上进行BLAST比对,结果显示与南海芽孢杆菌(B.australimaris)、沙福芽孢杆菌(B.safensis)和短小芽孢杆菌(B.pumilus)的16S rDNA序列相似度均高于99.8%。使用MEGA7.0构建菌株的系统发育进化树,如图2D所示,菌株M7L4与南海芽孢杆菌、沙福芽孢杆菌处于同一分支上。
由于16S rDNA的高度保守性,对相似率极高的近缘种无法做进一步区分,因此扩增gyrB基因进一步鉴别M7L4菌株在芽孢杆菌近缘种所属分支[26-27],采用Yamamoto等[23]报道的通用引物UP-1/UP-2r扩增菌株M7L4基因组上的gyrB基因,扩增产物的测序结果在NCBI上进行BLAST比对,结果显示与沙福芽孢杆菌的gyrB基因序列相似度最高。使用MEGA7.0构建的进化树如图2E所示,菌株M7L4与沙福芽孢杆菌处于同一分支上。
综合菌株的形态特征、16S rDNA和gyrB序列一致性及系统发育进化树分析,初步鉴定菌株M7L4为沙福芽孢杆菌。沙福芽孢杆菌在生物防控等方面的研究和应用已经有较多报道[28-30],这是首次发现沙福芽孢杆菌对ZEN具有降解能力。
2.3 菌株M7L4吸附与降解ZEN活性
根据1.3.3节方法获得菌株M7L4发酵液、发酵上清液、胞内液、细胞重悬液、灭活细胞重悬液、灭活发酵上清液,分别测定各组分对ZEN的降解效率。如图3所示,灭活细胞重悬液和灭活发酵上清液对ZEN降解率小于10%,表明该菌株对ZEN吸附作用较弱;发酵上清液对ZEN的降解率小于5%,表明M7L4的胞外分泌物质不能够降解ZEN;发酵液和细胞重悬液在24 h内对ZEN的降解率可达100%,但胞内液几乎不降解ZEN,表明菌株M7L4对ZEN起降解作用的是活细胞,其对ZEN的降解可能需要细胞提供能量或者辅酶和辅因子。
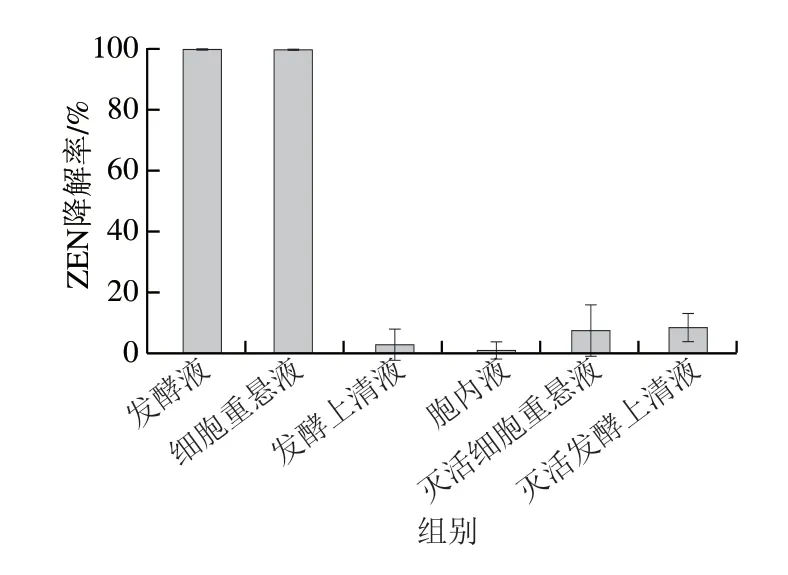
图3 菌株M7L4各组分对ZEN的降解效率Fig.3 Degradation efficiency of ZEN by intracellular and extracellular components of strain M7L4
2.4 菌株M7L4对ZEN的降解产物解析
监测菌株M7L4对ZEN的降解过程并对降解产物进行解析。如图4所示,随着底物ZEN(C18H22O5,m/z317.139 4[-H])的减少,有极性更强的产物(Compound X)积累(图4A),其m/z为397.109 5[-H](图4 B),与目前已知的ZEN 代谢产物中ZEN-P(C18H23O8P,m/z=397.105 8[-H])相符。分析该产物的二级质谱碎片,20 eV碰撞能量下该产物裂解后特征碎片离子的m/z为78.959 7(图4C),与Zhu Yan[21]和Yang Shibin[22]等报道的ZEN-P特征谱图一致,因此推断沙福芽孢杆菌M7L4对ZEN的降解产物为ZEN-P,菌株M7L4对ZEN的“降解”作用是将其转化为ZEN的磷酸化衍生物。
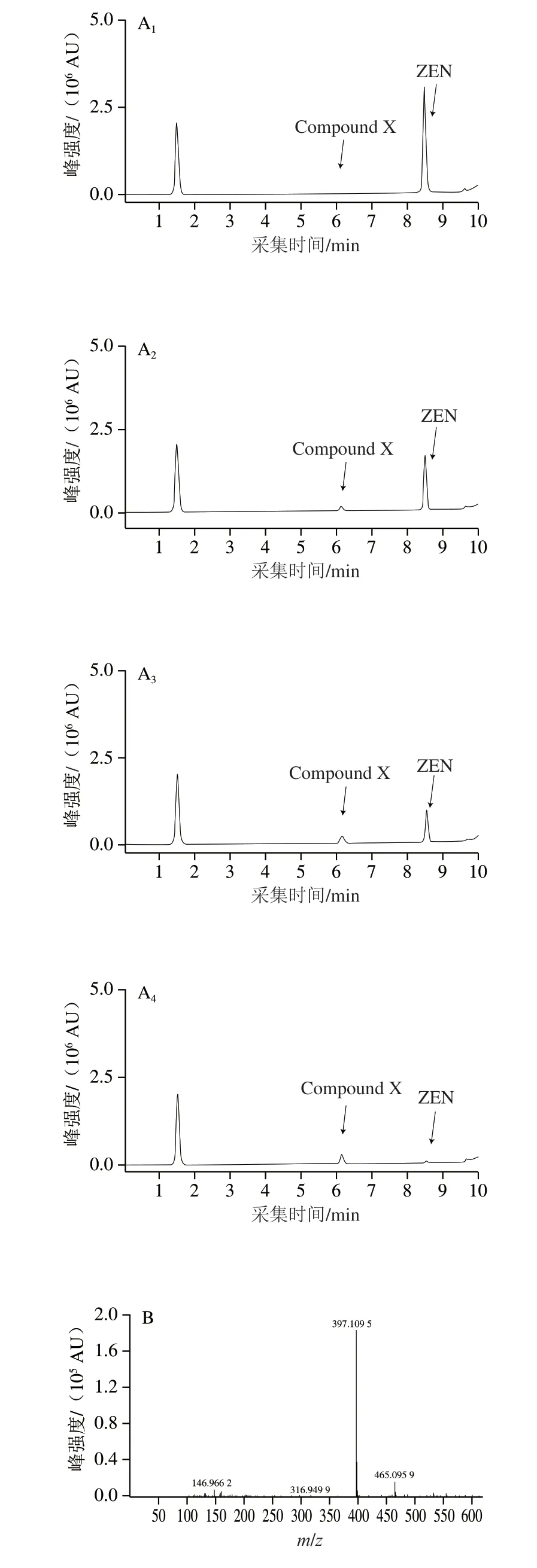

图4 菌株M7L4对ZEN降解产物的质谱分析Fig.4 Identification of the transformation products of ZEN by UPLC-QTOF-MS/MS
2.5 菌株M7L4中降解酶基因的克隆、表达与验证
根据NCBI中与zph基因相似度最高(53.20%)的沙福芽孢杆菌来源BsaPUE基因设计简并引物,从菌株M7L4中扩增得到其BsaPUE,如图5A所示,基因长度约2.5 kb,测序结果显示BsaPUE与zph的基因序列一致性为56.01%,BsaPUE蛋白与ZPH蛋白的氨基酸序列一致性为51.13%。
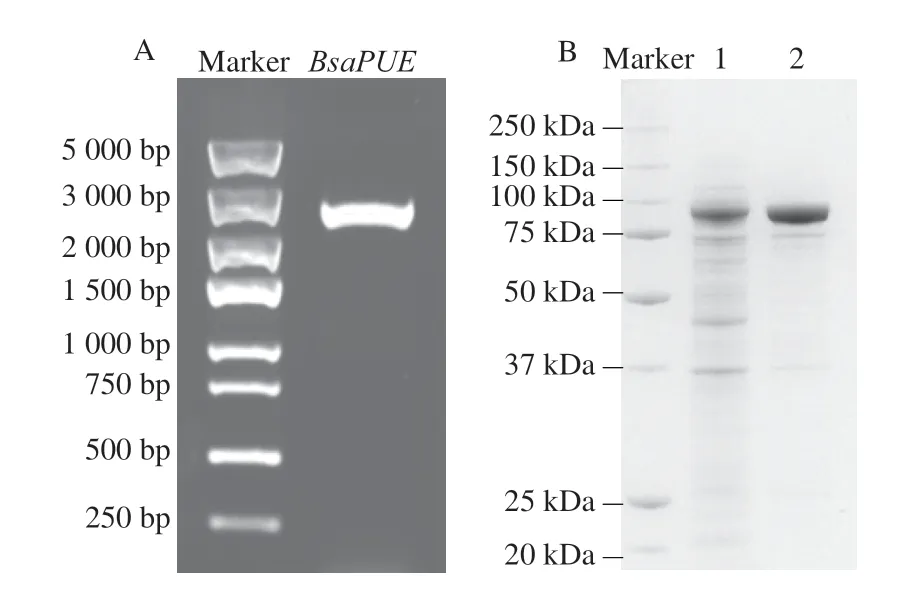
图5 BsaPUE基因的扩增与表达Fig.5 Amplification and expression of BsaPUE
根据1.3.5节方法对大肠杆菌重组菌株进行诱导表达和蛋白纯化(图5B),并验证重组酶BsaPUE对ZEN的转化效果(图6)。由图6A可以看到,反应组1仅加入重组酶BsaPUE,几乎不能转化ZEN;Yang Shibin等[22]报道的ZPH磷酸转移活性需要ATP和Mg2+参与,因此反应组2中加入重组酶BsaPUE和ATP及Mg2+,结果表明在ATP及Mg2+存在的情况下,30 min内重组酶BsaPUE可将10 μg/mL ZEN全部转化成ZEN-P(图6B);反应组3加入重组菌株大肠杆菌BL21(DE3)(pET28a-BsaPUE)的细胞重悬液,细胞内存在ATP及Mg2+的情况下重组菌株也可将ZEN转化成ZEN-P。重组酶BsaPUE对ZEN的转化需要ATP与Mg2+的参与,这与菌株M7L4对ZEN的降解可能需要细胞提供能量或者辅酶和辅因子的推测一致。已有报道表明ZEN-P与ZEN相比雌激素活性有明显下降[22],本研究验证了菌株M7L4来源的BsaPUE具有ZEN转化能力并明确其反应体系,这是首次发现沙福芽孢杆菌来源的ZPH能够催化ZEN到ZEN-P的生物转化。
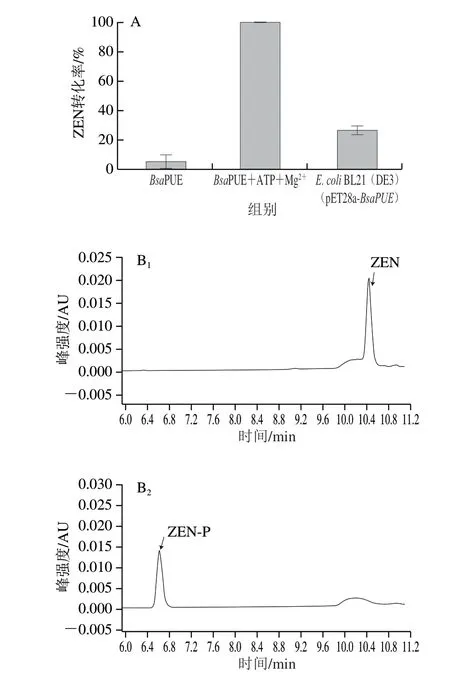
图6 重组酶BsaPUE对ZEN的转化效果Fig.6 Transformation efficiency of ZEN to ZEN-P by BsaPUE
3 结论
本研究采用富集培养法,从不同来源的小麦样品中分离获得1 株快速降解ZEN的微生物菌株,经形态学和分子生物学鉴定为沙福芽孢杆菌,并命名为M7L4。质谱分析表明,沙福芽孢杆菌M7L4的活细胞可将ZEN转化为m/z397.1的ZEN新型磷酸化衍生物ZEN-P。以菌株M7L4的基因组为模板,从中扩增出该沙福芽孢杆菌的BsaPUE基因,经大肠杆菌表达的重组酶BsaPUE,在有ATP和Mg2+存在的情况下可将ZEN转化成ZEN-P。本研究报道沙福芽孢杆菌可降解ZEN、发现沙福芽孢杆菌来源的ZPH(BsaPUE)可催化ZEN生成ZEN-P,发掘的相关菌株和基因资源,可为粮食谷物中真菌毒素的污染控制提供一定的技术支撑。

