异甘草素治疗糖尿病脑病的网络药理学分析和实验验证
付传君,陶家盛,杨靓,廖丽秀,谭欣欣,李中正,李先辉
(1.吉首大学生物资源与环境科学学院,湖南 吉首 416000;2.吉首大学医学院,湖南 吉首 416000;3.吉首大学药学院,湖南 吉首 416000)
糖尿病脑病(Diabetic encephalopathy,DE)是指糖尿病引起的认知功能障碍和脑结构变化,包括皮质萎缩、神经元死亡、突触可塑性下降等,随着全球糖尿病发病率的上升和预期寿命的增加,DE正在成为一个严重的公共卫生问题[1]。无论是1型糖尿病还是2型糖尿病患者,都可能表现出神经病理和神经行为的改变,其中认知功能障碍是DE的一种常见表现形式[2]。然而,DE的病理机制虽被探索多年,但其确切的发病机制仍未能明确,精准靶点的药物开发仍在起步阶段[3]。
中医认为DE是“消渴”合并“痴呆”和“健忘”,是脾胃肝肾同病,病程日久导致伤精耗气,气阴两虚,气滞不畅,瘀血阻滞,败血内蕴化为毒,损伤脑络导致脑病发生[4-5]。多项研究试图通过中医药的理论获得DE治疗的基础配伍处方,再应用现代技术手段探究中药的有效成分或有效部位治疗DE潜在机制[4,6]。
多项关于甘草治疗各种类型糖尿病的研究被记载,表明其对糖尿病患者具有多种治疗机制,特别是其所含的黄酮类化合物,具有巨大的潜力[7]。异甘草素(Isoliquiritigenin,ILG)是甘草中的一种黄酮类化合物,有研究证实其在糖尿病视网膜病变中发挥着重要作用[6],并且可以通过降血糖来改善糖尿病大鼠主动脉损伤[7],另外有大量研究表明其在神经保护方面具有良好的效果[8-11]。虽然目前有大量证据证明ILG在抗血糖和神经保护方面具有显著效果,但是尚未发现ILG治疗DE的相关报道。
近年网络药理学快速发展,成为中医药研究的一个重要新兴工具。网络药理学基于“疾病-基因-靶点-药物”相互作用网络的基础上,通过分析现有网络数据库的信息资料,结合实验验证,系统地、整体地揭示疾病-疾病、疾病表型-靶点蛋白、靶点蛋白-药物、药物-药物之间相互关系,揭示药物多通路、多靶点治疗疾病的特征[12-13]。因此,本研究采用网络药理学方法研究ILG治疗DE的潜在通路和靶点,并通过分子对接验证、体外试验验证,为进一步研究ILG治疗DE的临床应用提供理论和实验基础。
1 材料与方法
1.1 ILG的网络药理学分析
1.1.1 ILG的作用靶点预测 从PubChem数据库[14]获取ILG的SMILE结构,并将其输入至HERB数据库和SwissTargetPrediction数据库预测ILG的作用靶点。
1.1.2 DE相关靶蛋白获取 以“Diabetic Encephalopathy”为关键词通过GeneCards数据库、OMIM数据库[15]和PharmGkb数据库[16]获取与DE相关的靶蛋白。
1.1.3 核心靶点筛选 使用Venny 2.1.0软件绘制ILG作用靶点和DE相关靶蛋白的Venny图,得到ILG-DE交集靶点。在STRING 11.0数据库[17]中选择“Multiple proteins”,导入ILG-DE交集靶点,设定种属为“Homo Sapiens”,得到蛋白质相互作用网络(PPI)并将数据以TSV格式保存。将该文件导入到Cytoscape 3.9.1软件[18]进行可视化,利用Cytoscape软件中的“CytoNCA”插件中的节点度中心性(Degree centrality,DC)、中介中心性(Betweenness centrality,BC)、接近中心性(Closeness centrality,CC)、特征向量中心性(Eigenvector centrality,EC)、基于局部平均连接度方法(Local average connectivity-based method,LAC)和网络中心性(Network centrality,NC)等拓扑学参数筛选核心靶点。
1.1.4 核心靶点GO功能和KEGG通路富集分析 通过R软件中的“colorspace”“stringi”“ggplot2”程序包和Bioconductor中的“DOSE”“clusterProfiler”“enrichplot”程序包,并设置P值≤0.05,q value值≤0.05进行基因生物过程(GO)富集分析;使用R软件中的“colorspace”“stringi”“ggplot2”程序包和Bioconductor中的“DOSE”“clusterProfiler”“enrichplot”“pathview”程序包,并设置P≤0.05,q value≤0.05进行京都基因与基因组百科全书(KEGG)富集分析,筛选出具有显著差异生物过程的通路。
1.1.5 分子对接验证 先通过PubChem数据库下载ILG结构,PDB数据库下载核心靶点的蛋白受体结构,再应用ChemBio3D Ultra 14.0软件和Autodock Tools 1.5.6软件进行格式处理,最后应用Autodock-vina 1.1.2程序进行分子对接[19],并通过PyMol软件实现分子对接结果可视化。
1.2 体外实验验证
1.2.1 主要试剂和仪器 SH-SY5Y细胞购自丰辉生物科技有限公司;胎牛血清(货号:FSP500)购自依科赛生物科技(太仓)有限公司;高糖DMEM培养基(货号:C11995500CP)购自Gibco公司;D-葡萄糖(货号:G8150)和BCA蛋白定量试剂盒(货号:PC0020)购自索莱宝生物科技有限公司;ILG(货号:#10208)购自MedChemExpress公司;CCK-8试剂盒(货号:C0038)、蛋白酶抑制剂和磷酸酶抑制剂(货号:P1050)和RIPA蛋白裂解液(货号:P0013B)购自碧云天生物科技有限公司;所有一抗均是兔多克隆抗体:p-AKT(货号:#13038)和AKT(货号:#4691)购自Cell Signaling Technology公司;β-actin(货号:20536-1-AP)购自武汉三鹰生物科技有限公司;GSK3β(货号:ab13156)购自Abcam公司;p-GSK3β(货号:bs-2066R)购自博奥森生物科技有限公司;辣根过氧化物酶标记山羊抗兔二抗(货号:BA1054)购自武汉博士德生物工程有限公司。
CR21G型高速冷冻离心机(日立公司),SW-CJ-2D型超净工作台(苏州净化设备有限公司),CKX41型倒置显微镜(OLYMPUS公司),EL×800型酶标仪(GENE公司),NanoDrop-2000型微量核酸蛋白分析仪(Thermo公司),CLINX46110型凝胶成像系统(上海勤翔科学仪器有限公司),CKX41型倒置显微镜(OLYMPUS公司),SPX-250B-Z型恒温培养箱(上海博迅医疗生物仪器有限公司),1658001型垂直电泳槽(Bio-Rad公司),1703930型转印槽(Bio-Rad公司)。
1.2.2 细胞培养 使用含有10%胎牛血清的高糖DMEM培养基,在5%二氧化碳的37 ℃恒温培养箱中培养SH-SY5Y细胞。
1.2.3 构建细胞高糖损伤模型 将细胞中的完全培养基换成无血清培养基处理,同步化24 h后将细胞密度调整约为1×105mL-1接种到96孔板中,每孔100 μL,培养24 h待细胞贴壁后加入相应浓度的葡萄糖,分组如下:对照组(25 mmol·L-1葡萄糖),以下皆为处理组,甘露醇组(100 mmol·L-1)、梯度葡萄糖浓度(50、75、100、125、150、175 mmol·L-1)实验组,处理24h后进行检测,检测方法如下:吸出原培养基后每孔加入含有10% CCK-8试剂的完全培养基,将培养板放在培养箱中孵育1 h,随后在酶标仪450 nm波长处检测OD值。细胞存活率的计算公式为:(A处理-A空白)/(A对照-A空白)×100%。
1.2.4 检测ILG对高糖损伤模型细胞的保护作用 将SH-SY5Y细胞按每孔3×105个接种于6孔板中,细胞贴壁后加入高糖和ILG处理24 h,再用PBS洗3次后置倒置相差显微镜下观察形态并拍照。将细胞密度调整约为1×105mL-1接种到96孔板中,每孔100 μL,通过检测细胞活力来筛选合适的药物浓度和ILG对细胞的毒性,药物浓度分组如下:对照组(25 mmol·L-1葡萄糖),以下皆为处理组,高糖组(100 mmol·L-1葡萄糖,HG)、高糖+ILG梯度浓度(10、20、40、80 μmol·L-1)组;药物毒性分组如下:空白对照组(25 mmol·L-1葡萄糖)、25 mmol·L-1+ILG梯度浓度(10、20、40、80 μmol·L-1)组,放入培养箱培养24 h。最后检测细胞的存活率,检测方法与“1.2.3”相同。
1.2.5 Western blot实验 先向处理24 h后的细胞中加入含有蛋白酶抑制剂、磷酸酶抑制剂的RIPA蛋白裂解液裂解,再通过BCA试剂法测定蛋白总浓度,然后10%SDS-PAGE电泳分离蛋白样品并转移至PVDF膜上,在5%脱脂奶粉中室温封闭1.5 h后,加入特异性蛋白:兔多克隆抗体β-actin(1∶3 000)、兔多克隆抗体p-AKT(1∶500)、兔多克隆抗体AKT(1∶1 000)、兔多克隆抗体p-GSK3β(1∶1 000)和兔多克隆抗体GSK3β(1∶1 000)在4 ℃下孵育过夜。第2天使用TBST洗膜3次,每次10 min,洗膜结束后加入辣根过氧化物酶标记山羊抗兔二抗室温孵育1.5 h,再使用TBST洗膜3次,每次10 min,之后使用ECL发光试剂盒在成像系统中显影并拍照,用Image J 2.0.0软件分析蛋白条带并计算灰度值,并用内参进行归一化处理。
1.3 统计分析

2 结果
2.1 网络药理学分析结果
2.1.1 ILG作用靶点和DE相关靶蛋白的获取结果 通过HERB数据库和SwissTargetPrediction数据库分别得到30和100个作用靶点,去除重复靶点后共得到119个ILG作用靶点。
获得DE相关靶点数量分别为:GeneCards数据库得到3 039个、OMIM数据库得到341个、PharmGkb数据库得到86个,去除重复靶点后,共得到的3 161个DE相关靶蛋白。
利用R语言的“Venn”程序包,对ILG作用靶点和DE相关蛋白进行韦恩图的绘制,得到65个交集靶点(图1)。
2.1.2 核心靶点筛选 通过STRING数据库对65个交集靶点进行PPI网络构建,将最低互动要求分数设置为0.5并且隐藏网络中断开连接的节点,获得PPI的关系。然后使用Cytoscape软件对所得PPI网络进行可视化。结果显示,63个节点代表靶蛋白,1 184条边代表靶蛋白之间的互相关系,越红的节点表示DC值越高,表明这些靶点与DE之间存在很强的相关性,排名前五的靶点是EGFR、ESR1、PTGS2、PPARG和GSK3β(图2A)。
利用MCODE分析从基于拓扑结构的PPI网络中识别出三个功能相关蛋白簇。它们各自的簇属性如图2B~2D所示。三个族的种子基因为CDK2、PIK3R1和F3。
2.1.3 GO功能和KEGG通路富集分析结果 使用R软件对65个交集靶点进行GO生物过程富集分析(P<0.01),共得到77个条目,其中包含39种BP、13个CC、25个MF,根据P值筛选出每部分的前10个条目(图3),结果表明,LIG抗DE涉及多个生物学过程,影响多种细胞组分和分子功能,如对脂多糖的反应、蛋白磷酸化、蛋白激酶活性、蛋白丝氨酸/苏氨酸/酪氨酸激酶活性等。
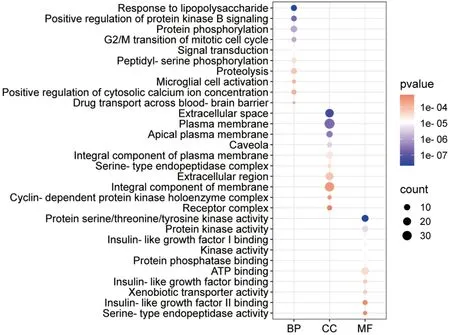
图3 GO功能分析结果气泡图
使用R软件对交集靶点进行KEGG信号通路富集分析(P<0.01),共获得43条通路,根据P值取排名前10的通路绘制气泡图(图4),主要涉及PI3K-Akt信号通路、癌症中的蛋白多糖信号通路、内分泌抵抗通路等。

图4 KEGG通路富集分析气泡图
2.1.4 分子对接验证 选择PPI网络DC值前5的靶蛋白和3个种子基因与ILG进行分子对接验证。结果8个核心靶点与ILG均有较好的结合,结合能的高低与对接效果成反比[20],GSK3β的结合能最低(-7.22 kcal·mol-1),其次为PTGS2(-6.97 kcal·mol-1)。结果见表1和图5。

表1 ILG与核心靶点结合自由能表
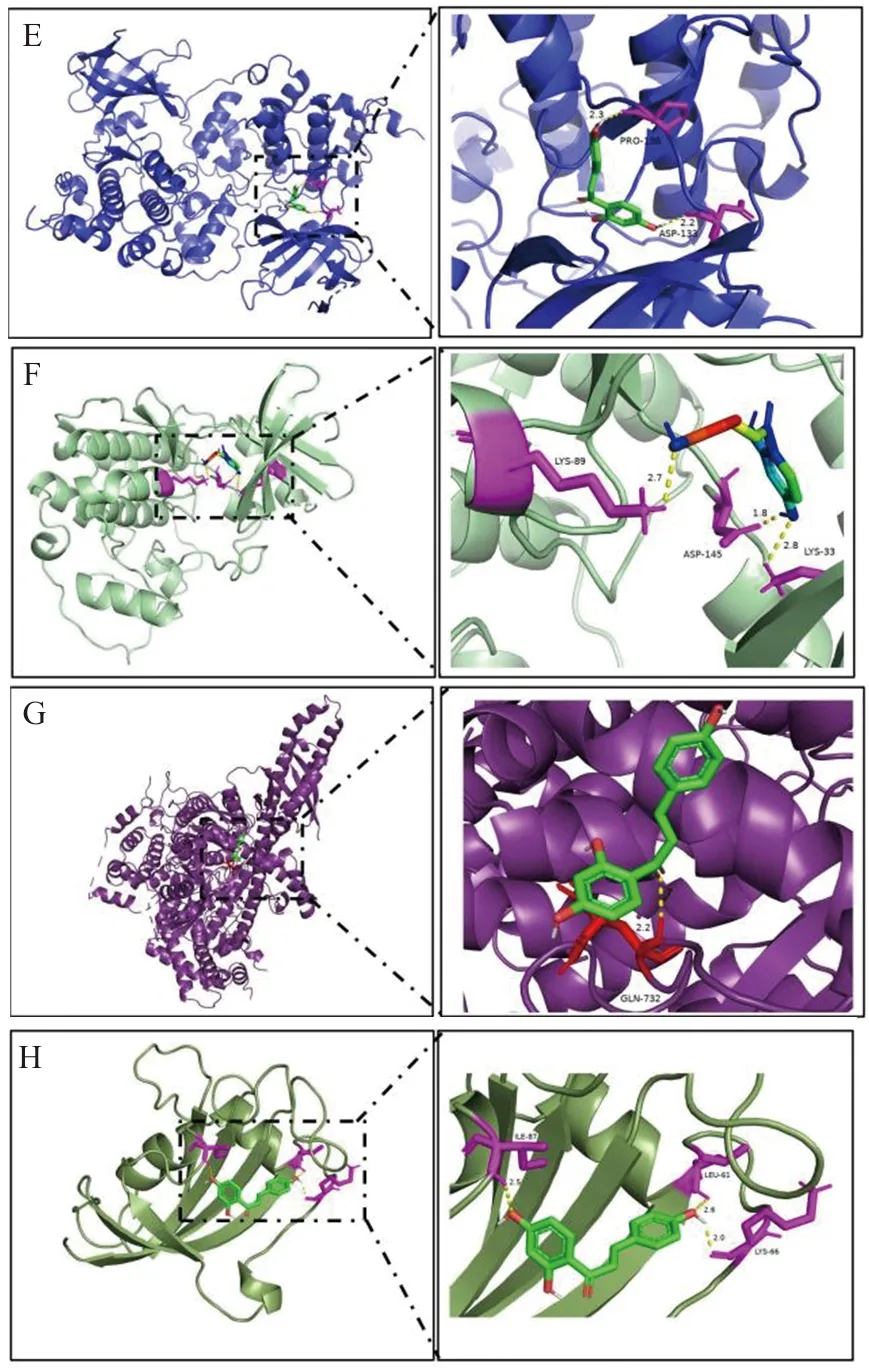
注:A.EGFR-ILG;B.ESR1-ILG;C.PTGS2-ILG;D.PPARG-ILG;E.GSK3β-ILG;F.CDK2-ILG;G.PIK3R1-ILG;H.F3-ILG
2.2 实验验证
2.2.1 SH-SY5Y细胞高糖损伤模型的构建 将细胞以100 mmol·L-1的葡萄糖进行处理24 h后,发现细胞活性大约保持在50%的水平。基于这一发现,我们选定此处理条件,并在随后的试验中以此构建高糖损伤模型(图6)。
2.2.2 ILG对高糖诱导SH-SY5Y细胞形态的影响 通过倒置相差显微镜(放大100倍)对细胞进行观测(图7),我们发现经过24 h培养后的对照组细胞呈梭形,紧密贴附于培养基上,细胞表面充满突起,细胞间互有连接。然而在高糖组,细胞出现明显缩小且形状变圆,细胞之间的间隙增大,连接消失,说明高糖环境对细胞形态产生损伤。与高糖组相比,ILG保护组(10、20、40、80 μmol·L-1)的细胞数量显著增多,细胞间的间隙变小,细胞突起增多。其中,ILG 20 μmol·L-1组的细胞形态改善最为显著,这表明ILG对高糖环境引起的细胞损伤有一定的保护作用。但当ILG浓度升至40 μmol·L-1和80 μmol·L-1时,会对细胞形态造成一定程度的损伤。
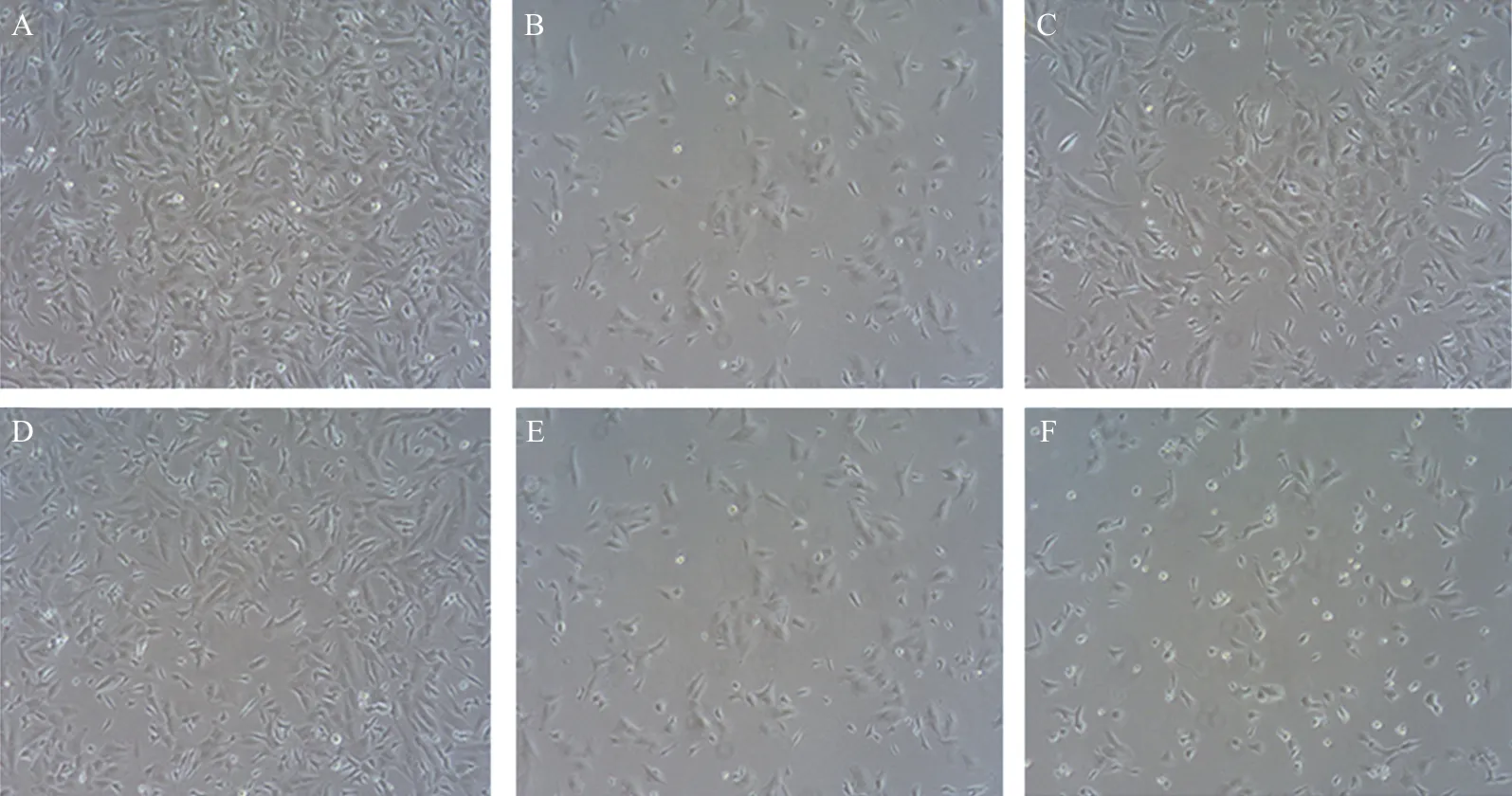
注:A.空白组;B.HG组;C.HG+10μmol·L-1 ILG组;D.HG+20 μmol·L-1 ILG组;E.HG+40 μmol·L-1 ILG组;F:HG+80μmol·L-1 ILG组
2.2.3 ILG对SH-SY5Y细胞存活率的影响 结果显示20 μmol·L-1的药物浓度对高糖损伤模型细胞具有较好的保护效果(图8A)。此外,在25 mmol·L-1葡萄糖培养的细胞中添加梯度浓度的药物时,药物浓度≤20 μmol·L-1时对细胞基本无杀伤作用;然而,当药物浓度升至40 μmol·L-1时,会显著抑制细胞活性(见图8B)。因此在后续实验中使用20 μmol·L-1ILG对细胞进行处理。

注:A.筛选药物保护浓度;B.药物毒性测试。与模型组比较,
2.2.4 ILG对高糖损伤模型中相关通路的影响 高糖损伤模型细胞中加20 μmol·L-1ILG后PI3K/AKT/GSK3β信号通路的表达情况见图9。结果显示20 μmol·L-1ILG处理后高糖组中p-AKT水平显著下调、p-GSK3β水平显著上调。
3 讨论
DE作为糖尿病的一种常见并发症,大量流行病学结果表明糖尿病与认知功能障碍的发生密切相关[21-22]。目前对于DE治疗还是一个难题,因此本研究试图通过网络药理学的方法找到安全且有效的DE治疗策略。
本研究KEGG富集分析发现,PI3K-Akt信号通路是ILG抗DE的主要信号通路之一。PI3K/AKT信号通路被认为是2型糖尿病的经典通路,具有调控细胞生长、凋亡、糖脂代谢等功能[23],其作为胰岛素效应信号传导的主要途径,任何一个环节出现异常均会干扰胰岛素的生理功能,进而导致2型糖尿病及其并发症的发生[23]。基于中药通过调控PI3K/AKT信号通路治疗糖尿病及其并发症的研究获得了众多关注[23-25]。有研究认为中药提取物葛根素、槲皮素、淫羊藿苷、木犀草素等能够通过调控PI3K/AKT信号通路改善糖尿病的认知功能障碍[25]。
本研究PPI网络分析结果显示ILG抗DE的最重要的靶点是EGFR、ESR1、PTGS2、PPARG、GSK3β、CDK2、PIK3R1和F3。进一步分子对接验证结果显示,这些核心靶点与ILG均有较高的结合力。GSK3β是一种丝氨酸/苏氨酸激酶,是Wnt信号通路的重要组成部分[26],抑制GSK3β磷酸化可以促进大鼠脑内轴突的再生[27],改善精神分裂症[28],不仅在神经性疾病中发挥重要作用,而且有大量研究表明GSK3β在糖尿病并发症中也扮演着重要的角色[29-31]。
ILG具有抗炎[32]、抗菌、抗氧化等多种作用[33],不仅如此,ILG还可以激活SIRT1从而改善糖尿病神经病变[34],通过抑制谷氨酸诱导的ROS反应进而减轻海马神经细胞死亡[10],并且ILG可以抑制神经氨酸酶的活性,最近有研究表明ILG与GSK3β结合抑制脑损伤后促炎因子的释放,从而改善创伤性脑损伤[35]。本研究发现适宜浓度的ILG对高糖损伤模型细胞可以起到一定程度的保护作用。GSK3β是PI3K/AKT信号通路的下游靶点,其活性受AKT1的负调控,在多种细胞过程中发挥作用。激活AKT/GSK3β信号通路可以起到神经修复的作用[36],PI3K/AKT/GSK-3β/CRMP-2通路被活化可以改善大鼠缺血后神经功能损伤[37],并且可以有效改善精神分裂症[28]。本研究结果显示ILG通过调控GSK3β进而激活PI3K/AKT信号通路达到改善DE的作用,为未来进一步研究奠定了基础。

