用于快速检测铅离子的新型双发射碳点比率荧光探针
易敏娜, 曹汇敏*, 黎双娜丝, 张朱珊莹, 朱春楠
1. 中南民族大学生物医学工程学院, 湖北 武汉 430074 2. 中南民族大学认知科学国家民委重点实验室, 湖北 武汉 430074 3. 中南民族大学医学信息分析及肿瘤诊疗湖北省重点实验室, 湖北 武汉 430074
引 言
铅是环境和生物系统中广泛分布的最常见、 最有害、 最具毒性的重金属之一, 可能存在于含铅质的粉类化妆品、 锡器劣质陶器的釉质或珐琅、 涂料油漆中。 重金属铅在生物体内难以被降解, Pb2+通常吸附在颗粒物上, 被舔食或吸入后会在人体器官中长期积累造成慢性中毒, 进而导致人体神经、 免疫、 心血管等多种系统功能被损坏。 世界卫生组织和国际癌症研究机构已将铅列为致癌物[1], 血铅水平是判定铅中毒的主要手段, 含量大于等于0.1 mg·L-1即被判定为铅中毒。 由于Pb2+的生物毒性和累积性对人体的危害巨大, 因此研究和开发具有选择性和敏感性的探针和方案至关重要[2]。 传统的铅离子检测方法有电化学检测法[3-5]、 电感耦合等离子体质谱法[6]等, 这些方法虽然已被广泛使用于铅的检测, 但制样难度大, 并且还需要专业的技术和精密仪器支持。 在众多检测方法中荧光传感法[7]的检测周期短、 操作步骤简单、 灵敏度高[8], 是一种高效的铅离子检测方法。
近年来, 荧光探针凭借其稳定性和高灵敏度受到更多关注, 许多新型荧光材料已被开发, 如有机染料、 量子点、 金纳米团簇等都已用于检测金属离子、 农药残留、 气体含量、 化学药剂、 生物分子等多种领域。 Zhang等合成了用于酸性化合物中Pb2+的纳米活性吸附剂[9]; Sahu等合成掺杂硼的蓝绿色碳点, 研究了在生理pH下性能稳定的纳米传感探针[10]; Wang等合成了用于检测水和活细胞中Pb2+含量的银纳米团簇[11]等。 量子点一般具有毒性, 对环境危害大, 为了提高量子点的稳定性和生物相容性等特性, 制备过程中需要用某些金属加以修饰, 这导致成本升高、 合成步骤繁琐等问题。 碳量子点(CQDs) 也称为碳点或碳纳米点, 它具有许多传统的量子点不具备的优点, 其光致发光特性在检测有害物质方面效果显著, 是一种成本低、 易于合成、 安全无毒的绿色纳米材料, 并且具有较高的稳定性[12]、 良好的水溶性[13]、 生物相容性[14]等优势。
目前, 很多荧光探针还局限于单发射荧光响应来进行检测, 这种方法容易在检测过程中受到外界因素的干扰从而影响其检测的准确性。 相比于单发射量子点, 同一激发下具有两种发射峰的双发射荧光材料, 能够与自身对比参照进行标定, 通过其荧光强度变化的比值来表达被测信息, 具有更好的灵敏度和稳定性, 能有效避免外界无关因素的干扰和探针本征的荧光缺陷, 提高检测效果、 灵敏度和稳定性。 Mehta等结合苯并噻唑聚氰乙烯基荧光团合成了一种比例荧光肽探针[15], 但其检测耗时较长, 完成检测最快需要6 min; Gao等采用水热法合成了双发射碳量子点, 用于喷墨和检测Fe3+[16]; 石吉勇等提出基于碳点和铜纳米团簇的比率型荧光探针, 用于检测螃蟹中Hg2+含量[17]; Shu等以二维镍基金属有机骨架纳米片为基体制成可视化即时检测生物分子硫醇的双发射比率探针[18], 许多研究者们都在对双发射比率荧光探针进行各种研究和尝试, 但就制备成本、 工序难易程度等方面还存在许多可以优化的地方, 从检测耗时方面来看, 许多比率探针目前还无法做到对被测物质的快速响应。
基于上述考虑, 本研究分别以柠檬酸钠和对苯二胺(p-PD)为碳源, 采用水相法合成蓝红两种碳点, BCDs作为响应信号与Pb2+反应导致荧光强度减弱, RCDs对Pb2+的化学惰性在整个检测系统中用于背景参考, 将两种碳点按照一定荧光强度比混合, 二者因其物理、 化学性质的改变从而引起光谱的显著变化[19]。 当Pb2+存在时探针在短短几秒作出响应, 视觉上表现出由蓝到红的荧光颜色变化, 能够直观地反映被测物浓度的含量。 作为Pb2+的选择性检测探针, 通过透射电子显微镜 (TEM) 、 荧光光谱和紫外可见吸收光谱等手段进行表征和检测, 依据粒子大小、 形貌特征、 吸收强度、 荧光光强、 荧光猝灭等信息对Pb2+的响应机理、 特异性选择、 pH环境的影响和荧光稳定性能等各种基本性质进行了比色研究, 以证明该比率荧光探针的可行性。
1 实验部分
1.1 仪器与试剂
二水柠檬酸钠(C6H5Na3O7·2H2O) 分析纯(AR, 99.0%)购自上海阿拉丁生化科技股份有限公司、 氯化铵(NH4Cl)分析纯(AR, 99.5%)购自成都市科隆化学品有限公司、 对苯二胺(p-PD)购自上海麦克林生化科技股份有限公司、 氢氧化钠(NaOH)、 盐酸(HCl), Pb2+标准溶液(1 μg·mL-1)购自山东省冶金科学研究院有限公司, Zn2+、 Fe3+、 K+、 Mn2+、 Na+、 Al3+、 Mg2+、 Hg2+、 Ca2+、 Cu2+的标准液(100 μg·mL-1) 均购自北京有色金属研究总院, 本实验中使用的所有试剂均为分析级, 无需进一步纯化。 在整个制备过程中使用了纯水。
美国Thermo Fishre公司Thermo Scientific Talos F200X透射电子显微镜, 美国PerkinElmer 公司LS-55荧光分光光度计, 岛津UV-3600iPlus紫外可见分光光度计, 上海耀特仪器设备有限公司DF-101S集热式恒温加热磁力搅拌器, 上海精密科学仪器有限公司FA2204B电子天平, 梅特勒托利多FE28pH计, 湖南湘仪实验室仪器开发有限公司TG16-WS医用离心机, 武汉品冠仪器设备有限公司PGUV-10-AS超纯水机, 南京先欧仪器制造有限公司XO-5200DT超声波清洗机。
1.2 蓝红碳点的制备
蓝色碳点 (BCDs) 制备方法参照李文婷等聚四氟乙烯反应釜水热合成方法[20]加以改进。 称取0.4 g柠檬酸钠和2.12 g氯化铵于50 mL三颈烧瓶中, 加入20 mL纯水进行搅拌, 通入氩气后将温度逐步加热至100 ℃, 控制温度不变持续回流6 h。 将所得的淡黄色溶液BCDs冷却至室温后保存在4 ℃条件下以备后续使用。
红色碳点 (RCDs) 的制备方法如下。 称取0.216 g对苯二胺, 溶于20 mL纯水中, 倒入50 mL三颈烧瓶中磁力搅拌, 温度逐步加热至100 ℃并回流保持5 h, 待溶液冷却至室温后, 将得到的产物在10 000 r·min-1转速下离心10 min以去除不溶性杂质, 保留上清液, 用纯水分散备用。
1.3 铅离子荧光检测
将制备的BCDs与RCDs以合适的体积比混合, 制成荧光强度比约2.3∶1的双发射比率探针溶液。 控制溶液总量不变, 分别取980 μL比率探针溶液与20 μL浓度0~0.5 mg·L-1的Pb2+溶液超声混合均匀, 确保在1 min内扫描溶液荧光发射光谱, 设置扫描范围380~800 nm, 激发波长为360 nm。 通过计算蓝红碳点荧光强度比值来定量分析与Pb2+浓度的关系, 肉眼观察并记录其荧光颜色的变化。
1.4 选择性实验
将选取的十种常见的干扰离子Zn2+、 Fe3+、 K+、 Mn2+、 Na+、 Al3+、 Mg2+、 Hg2+、 Ca2+、 Cu2+以Pb2+浓度的两倍, 即浓度为1 mg·L-1的干扰离子分别加入比率荧光探针溶液中, 记录其荧光响应, 以离子的荧光强度比值为纵坐标考察该探针对铅离子的选择性。
1.5 稳定性实验
对比率探针溶液在0.25、 0.5、 0.75、 1、 1.5、 2、 2.5、 3、 4、 5和6 h时间内进行荧光发射谱扫描, 记录其荧光响应, 同上述方法, 分析孵育时间对比率探针荧光强度的影响。
用NaOH和HCl调节去离子水的pH值, 配制Pb2+浓度为0.1 mg·L-1的溶液, 将含Pb2+的比率探针溶液分散在等量的pH值为1~14的溶液中, 记录其荧光强度随pH值的变化趋势, 通过荧光强度比考察pH值对比率探针荧光性能的影响。
2 结果与讨论
2.1 CDs及比率探针的表征
采用TEM对CDs的尺寸、 形貌等性质进行表征。 图1(a)表明制备的BCDs与RCDs纳米粒子分布均匀, 具有良好的单分散性。 BCDs颗粒呈球形, 平均直径小于10 nm, 在高分辨率透射电子显微镜(HRTEM)下呈晶格条纹状[图1(a)插图]。 当Pb2+与BCDs-RCDs共存的情况下, 图1(b) TEM结果表明, BCDs表面官能团与Pb2+之间的螯合和静电相互作用[21]导致纳米粒子聚集形成团簇, RCDs保持稳定不参与反应, 这一现象印证了蓝色荧光猝灭的原因, 图1(b)插图为HRTEM图像, 清晰地显示了BCDs的与Pb2+聚集形态。

图1 (a) BCDs和RCDs的TEM图像, 插图为BCDs的HRTEM图像; (b) BCDs-RCDs与Pb2+的TEM图像, 插图为BCDs与Pb2+聚集后的HRTEM图像Fig.1 (a) TEM images of BCDs and RCDs, Inset is the HRTEM image of BCDs; (b) TEM images of BCDs-RCDs and Pb2+, Inset is the HRTEM image after BCDs and Pb2+ aggregated
采用荧光激发光谱和荧光发射光谱分别对BCDs、 RCDs和双发射比率探针的光学性质进行表征。 图2(a)所示, 发射波长为440 nm时, BCDs的激发光谱在251和353.5 nm出现两个激发峰; 发射波长为700 nm时, RCDs激发光谱激发峰在300和360.5 nm附近。 为保证两者同时被激发, 选取360 nm作为激发波长, 图2(b)黑色曲线所示, 比率探针在440和712 nm出现两个发射峰荧光信号, 且峰宽较窄。 在365 nm手持紫光灯照射下肉眼可见明亮的蓝色荧光和红色荧光[图2(b)插图]。 两者混合后可能由于BCDs与RCDs发生了能量转移效应[20], 导致BCDs的荧光略有降低。
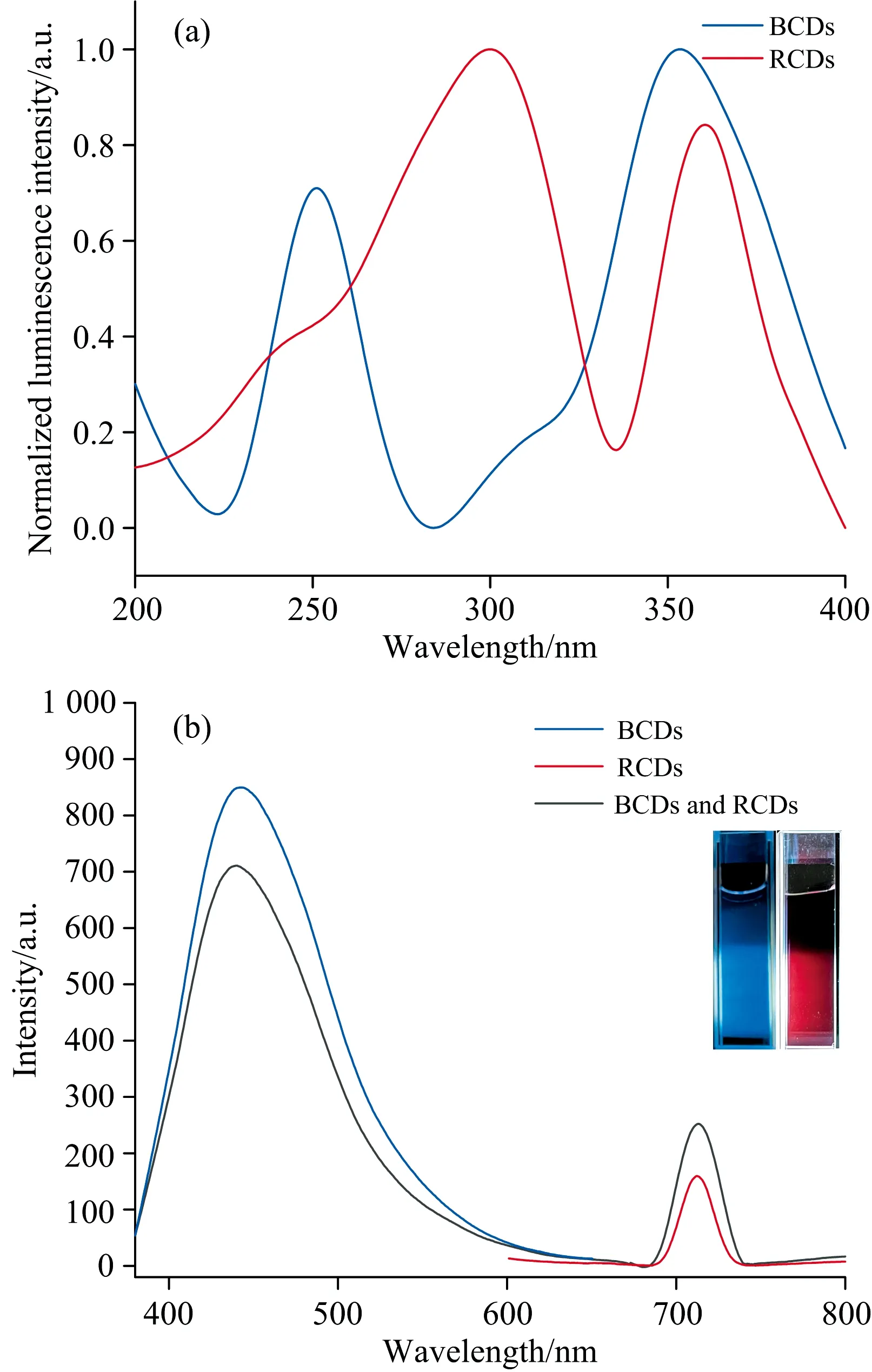
图2 (a) BCDs与RCDs归一化的激发光谱图; (b) BCDs、 RCDs及混合溶液的荧光发射光谱(λex=360 nm)Fig.2 (a) Excitation spectra normalized by BCDs and RCDs; (b) Fluorescence emission spectra of BCDs, RCDs and mixed solutions (λex=360 nm)
2.2 铅离子的响应机理
整个铅离子的传感检测体系中BCDs发挥主要作用, RCDs不参与反应, 只有BCDs颗粒表面的官能团与Pb2+的螯合作用导致纳米粒子相互之间吸附聚集, 从而发生团聚现象导致荧光颜色发生变化, 示意图如图3所示。
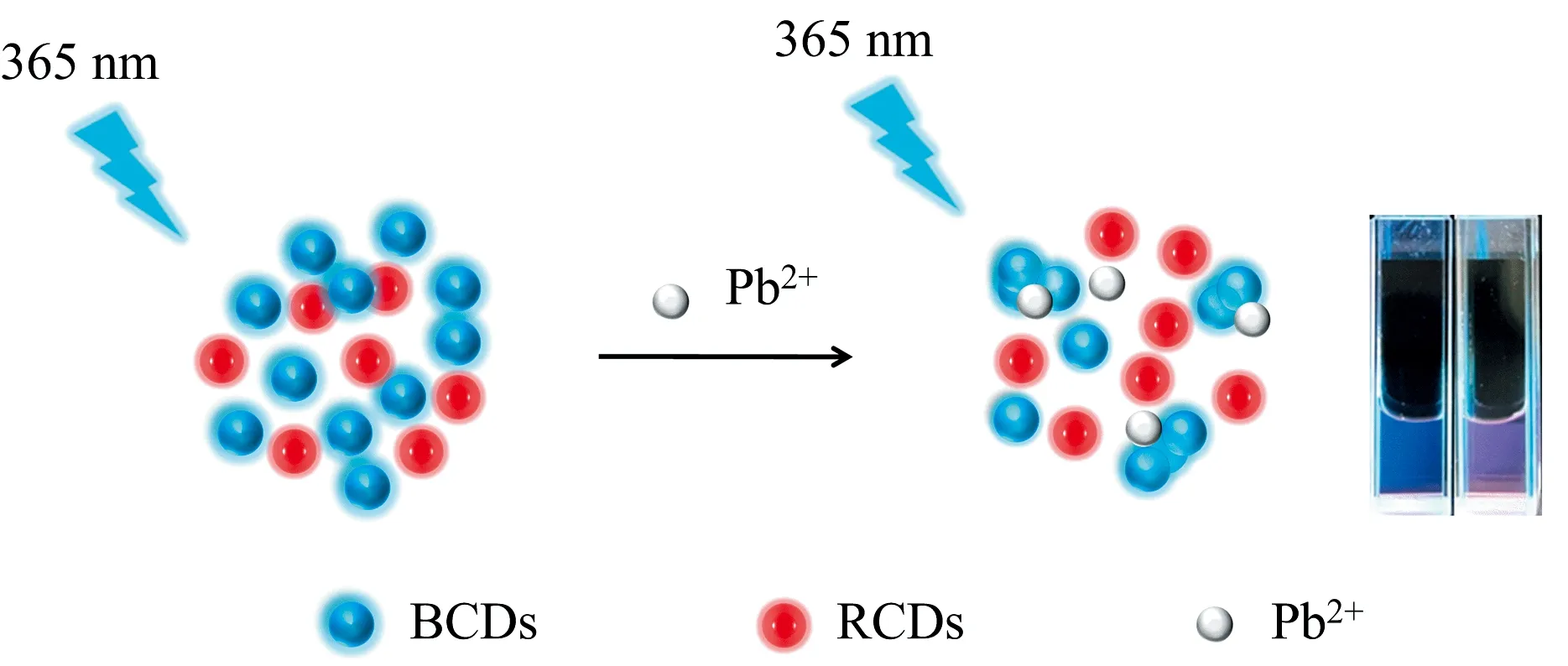
图3 比率荧光探针Pb2+检测示意图Fig.3 Schematic diagram of ratio fluorescent probe Pb2+ detection
以目前医学应用的Pb2+含量范围为标准分别考察了0~0.50 mg·L-1Pb2+浓度下单个碳点与比率探针对铅离子的响应。 图4中Pb2+在342 nm处存在吸收峰, 与BCDs的峰值所在的位置接近, BCDs的激发光谱和Pb2+的紫外吸收光谱形状相似, 表明该碳点能够用于检测Pb2+。
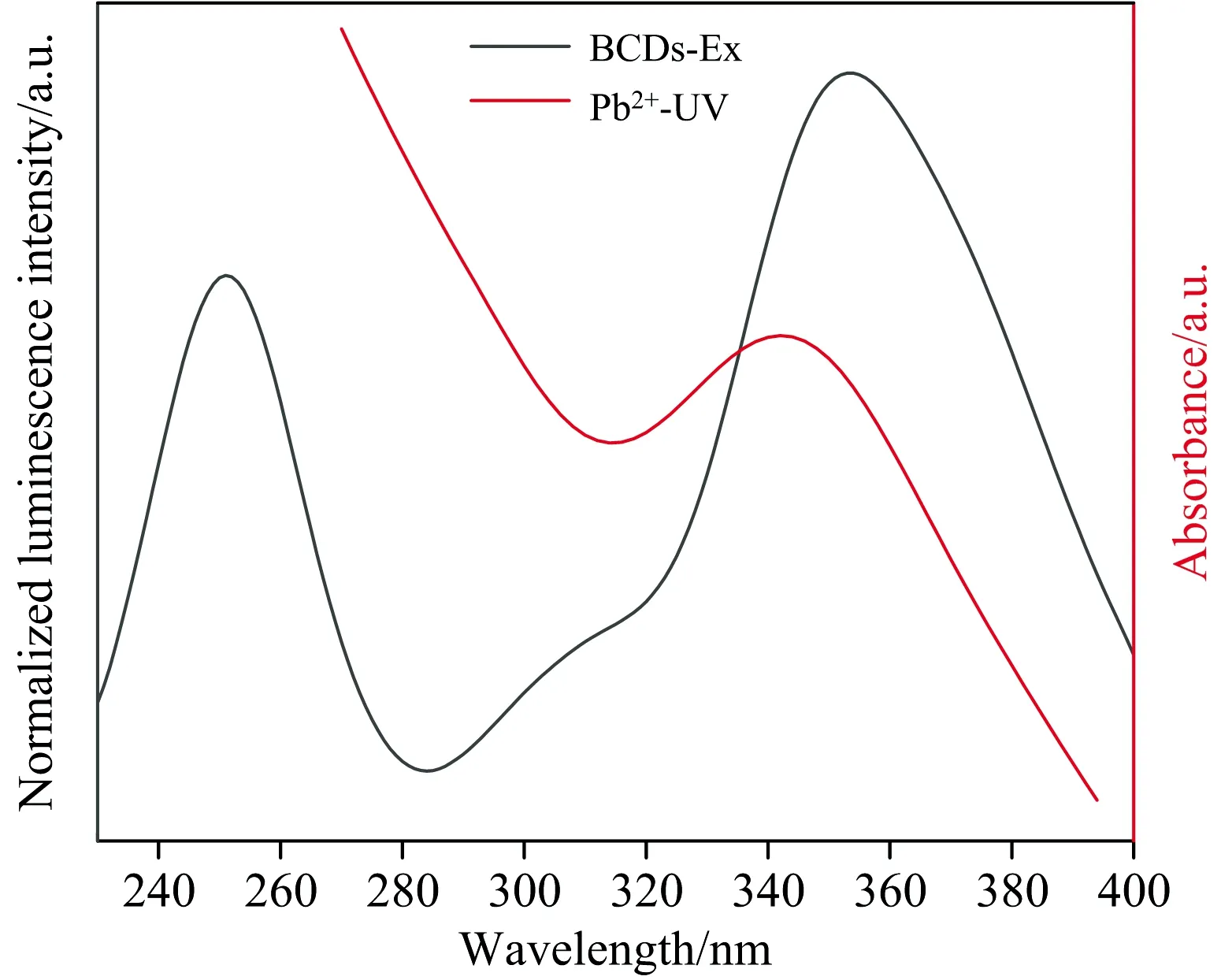
图4 BCDs的激发光谱和Pb2+的紫外吸收光谱Fig.4 Excitation spectra of BCDs and UV absorption spectra of Pb2+
RCDs与Pb2+混合时不发生反应, 如图5(a)所示, 712 nm处发射峰的荧光强度在0~0.50 mg·L-1浓度的Pb2+存在时几乎保持不变, 因此可以证实RCDs对Pb2+无响应。 BCDs表面的-COOH能够与Pb2+形成螯合产物, -NH2与Pb2+发生络合反应使得蓝色荧光颗粒产生聚集现象, 基于内滤波效应导致荧光猝灭[22], TEM图1(b)也能证明这一现象。 图5(b)体现了随着Pb2+浓度的提高, 440 nm处的发射峰的荧光强度逐渐减弱, 插图为365 nm紫光灯照射下的荧光变化情况。
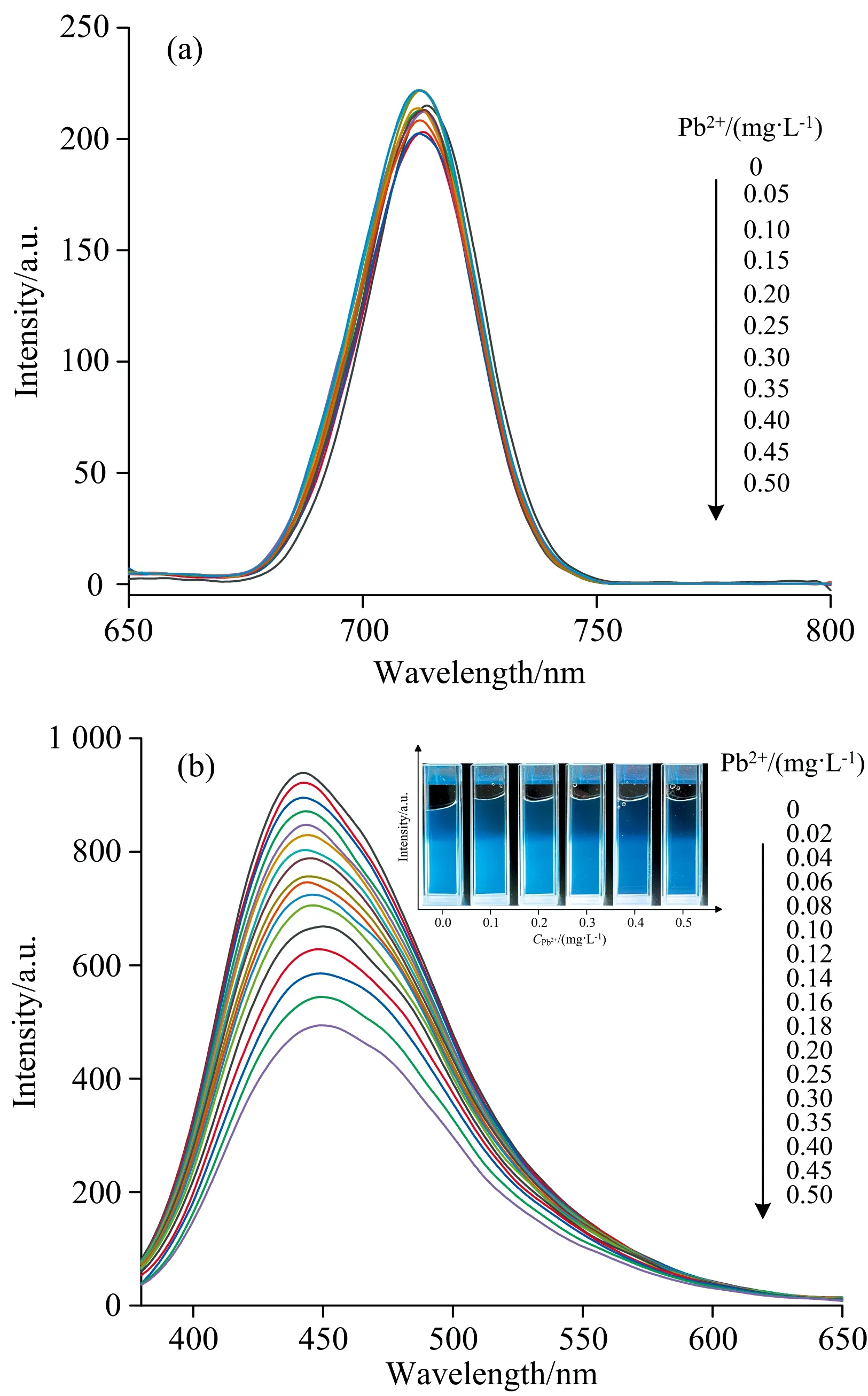
图5 (a) RCDs的荧光发射光谱; (b) BCDs的荧光发射光谱Fig.5 (a) Fluorescence emission spectra of RCDs; (b) Fluorescence emission spectra of BCDs
根据蓝红碳点的不同体积配比设置荧光强度比I440/I712分别为1.3∶1、 1.8∶1和2.3∶1时测试不同浓度下对Pb2+的荧光响应, 确定两种碳点的发射峰比值为2.3∶1时从蓝色到紫红色的荧光颜色变化范围最宽。 将蓝红碳点基于最佳荧光强度2.3: 1均匀混合成比率荧光探针溶液, 通过荧光强度和颜色的变化来实现铅离子含量的判定。 如图6(a)为0~0.50 mg·L-1浓度的Pb2+比率荧光探针的发射光谱, 插图为溶液由蓝色到红色的变化情况。 比率探针在440 nm处的荧光强度随Pb2+的浓度增加呈规律性递减趋势, 而712 nm处的荧光强度不受其浓度影响。 为明确比率探针荧光强度与Pb2+浓度的关系, 绘制440和712 nm处的峰值比值I440/I712与Pb2+浓度的关系图来评估Pb2+含量[21]。 如图6(b)所示, 二者线性关系良好,R2=0.987 44, 基于三倍标准差规则, LOD=3σ/s, 其中σ为空白探针样品测量的标准差,s为线性拟合曲线的斜率, Pb2+的检出限为0.013 6 mg·L-1。 以上数据均由三组实验所得。

图6 (a) 比率荧光探针与Pb2+混合后的发射光谱; (b) I440/I712比值与Pb2+浓度的线性关系Fig.6 (a) Emission spectra of ratio fluorescent probe mixed with Pb2+; (b) Linear relationship between I440/I712 ratio and Pb2+ concentration
2.3 比率荧光探针的选择性
选择性是对荧光探针性能评估的一个很关键的指标, 选取了十种生活中常见的金属阳离子Zn2+、 Fe3+、 K+、 Mn2+、 Na+、 Al3+、 Mg2+、 Hg2+、 Ca2+、 Cu2+作为干扰离子分别加入比率探针溶液中, 除Cu2+外未观察到干扰离子荧光比值(I440/I712)/(I440/I712)0的明显变化(图7) , 其中(I440/I712)0为无任何离子存在时的荧光强度比。 由于RCDs的碳源p-PD中氮原子的孤对电子与Cu2+的空轨道能形成络合物会使得712 nm处的荧光强度增大, 但在整个体系中RCDs含量极少且BCDs对Cu2+具有惰性, 对整个检测系统的影响微乎其微, 因此在365 nm激发下仍然表现出强烈的蓝色荧光。 干扰离子对蓝色荧光几乎没有猝灭作用, 实验表明比率探针对Pb2+有良好的选择性。

图7 比率荧光探针对其他金属离子的选择性Fig.7 Selectivity of the ratio fluorescent probe to other metal ions
2.4 比率荧光探针的稳定性
以孵育时间和pH环境为变量, 利用荧光光谱法系统研究了比率荧光探针的稳定性。 图8(a)为室温下相对荧光强度随时间的变化情况, 探针的相对荧光强度在6 h内变化微小, 表明光学稳定性良好。 不同pH环境下比率探针的荧光变化情况如图8(b)所示, 在强酸和强碱环境下探针的荧光强度有很大的变化, 在pH<3的强酸环境下, 由于BCDs表面-COOH和-NH2与H+结合去质子化, 削弱了Pb2+的螯合作用, 导致BCDs失去稳定性, 使得蓝色荧光减弱[23]。 在pH值为12、 13的碱性条件下, Pb2+与高浓度的OH-结合形成沉淀从而减弱Pb2+对BCDs的猝灭反应程度, 因此荧光强度骤增。 pH值为14的强碱环境下, BCDs表面的官能团被破坏, 导致荧光减弱[24]。 在pH值为3~11较大的范围内荧光强度比值波动不大, 实验结果表明该探针具有较好的耐盐性和耐酸性。 综合上述结果与讨论, 表明该探针的荧光稳定性良好。
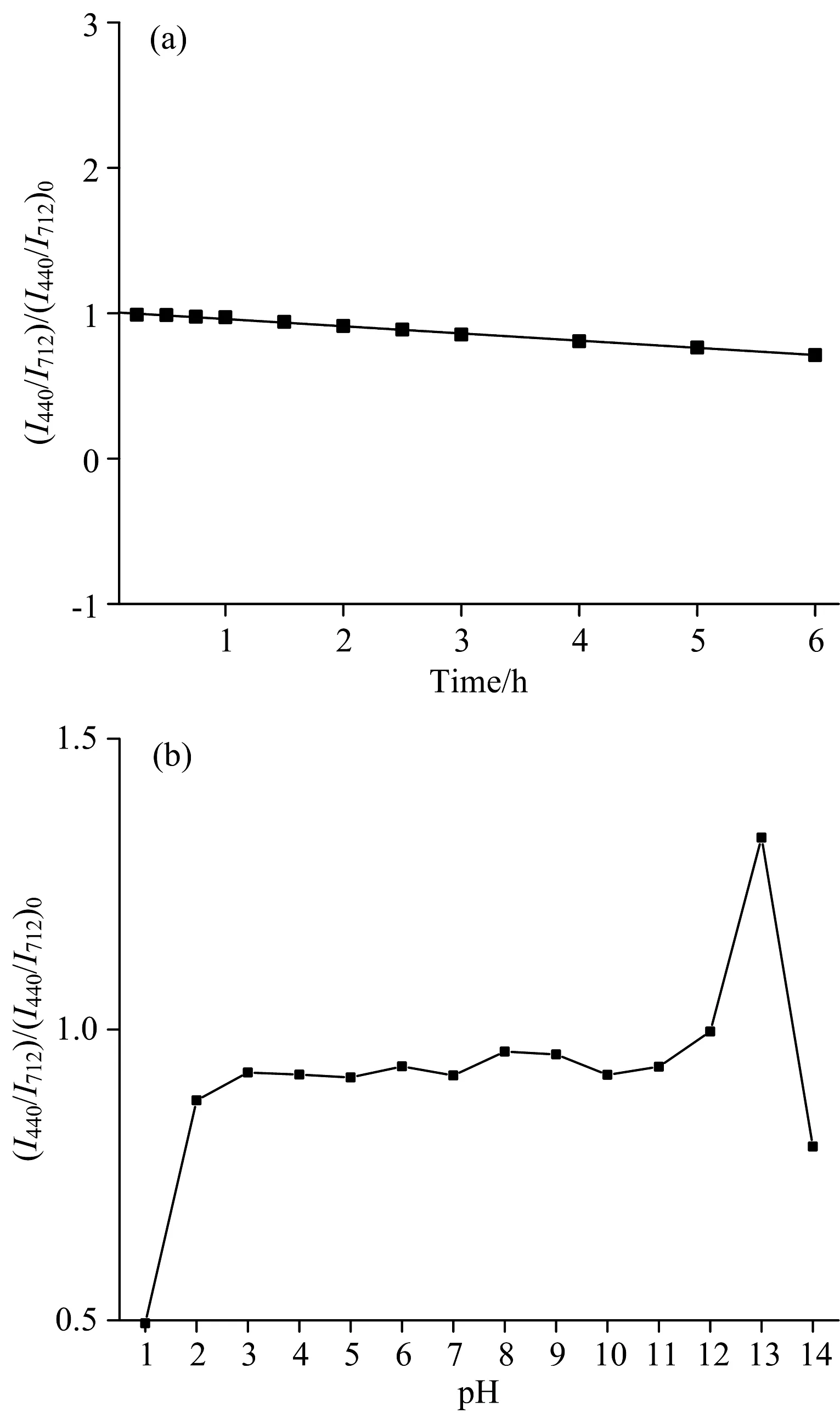
图8 (a) 孵育时间对比率探针性能的影响; (b)不同pH对比率探针性能的影响Fig.8 (a) Effect of incubation time on the performance of ratio probes; (b) Effect of different pH on the performance of ratio probe
3 结 论
采用水相合成法制备了能快速检测铅离子的双发射可视化比率荧光探针, TEM图显示探针尺寸小、 粒径均匀, 该探针无需任何修饰, 成本低、 检测方法简便。 结果表明BCDs-RCDs具有斯托克斯位移大、 光稳定性好、 发射带谱窄的优点。 基于荧光猝灭的原理, 双发射比率荧光探针通过荧光颜色的变化实现Pb2+的可视化检测, 两种荧光团之间的荧光强度比与Pb2+浓度具有良好的线性关系, 检出限低至0.013 6 mg·L-1。 该比率探针无需长时间孵育便能快速对Pb2+做出反应, 在较大pH范围和时间范围内探针的灵敏度和稳定性良好, 检测浓度也符合医学应用所需范围, 在不同生理条件下有较好的生物传感应用潜力, 在生物医学工程领域有广泛的应用前景, 也为临床医学的即时检测提供了新的思路。

