Beckwith-Wiedemann综合征产前诊断的临床进展
安祥友 综述 袁 静,杨媛媛 审校
Beckwith-Wiedemann综合征(Beckwith-Wiede mann syndrome,BWS)是一种过度生长和胚胎性肿瘤易感的印记障碍性疾病,与染色体11p15.5区域的遗传或表观遗传异常导致的亲本等位基因表达异常有关。据报道[1-2],BWS发病率约为1/10 000~1/13 700,通过辅助生殖技术(assisted reproductive techniques, ART)妊娠的胎儿患BWS的风险比自然受孕胎儿增加10倍[3]。BWS具有临床异质性,主要表现为巨舌、腹壁缺陷、偏侧增生、内脏肿大、耳朵特殊折痕、新生儿低血糖、胚胎性肿瘤易感等。BWS具有遗传多样性,11p15.5区域包括受印记中心1(imprinting center 1, IC1)调控的H19和IGF2及IC2调控的KCNQ1、KCNQ1OT1、CDKN1C。约80%的BWS患儿在11p15.5区域内有分子缺陷[4],其中IC2区域的甲基化缺失(loss of methylation, LOM)约见于50%的患者,IC1区域的过度甲基化(gain of methylation, GOM)约见于5%~10%的患者,父源性单亲二倍体(paternal uniparental isodisomy, pUPD)约见于20%的患者,CDKN1C突变约见于5%的散发性BWS和40%的家族遗传性病例,另有少部分患者为染色体结构异常[5]。BWS患者中约85%为散发性病例,15%为家族遗传性病例。
BWS常通过患者的临床表型进行诊断,BWS国际共识小组建立了临床评分体系[1],见表1。由于巨舌、偏侧增生、新生儿低血糖、胚胎性肿瘤等典型表型多于妊娠中、晚期及产后出现,大多数病例于新生儿期或儿童期被诊断。因此,产前早期诊断BWS并进行遗传咨询对围产期及产后临床处理具有重要意义。
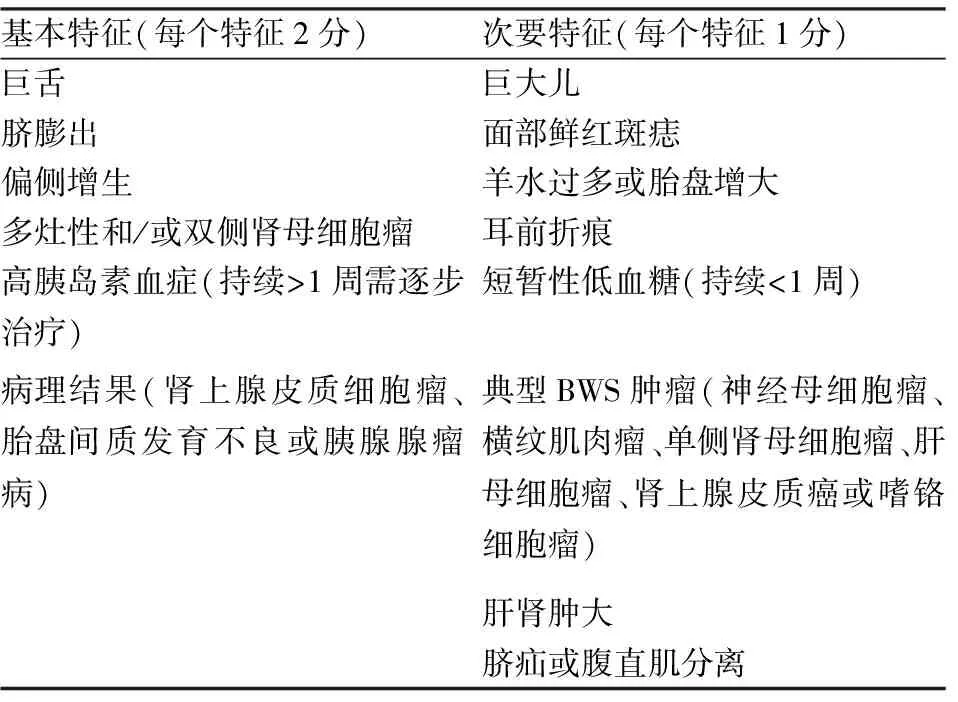
表1 BWS的临床表型
1 BWS的产前诊断
1.1 一般生化检查妊娠早、中期的血清学标志物联合筛查:甲胎蛋白(alpha-fetoprotein, AFP)、β-人绒毛膜促性腺激素(beta human chorionic gonadotropin, β-hCG)、游离雌三醇(unconjugated estriol, μE3)和抑制素A (inhibin A)四联筛查常用于唐氏综合征、18-三体、神经管缺陷的筛查。这4种血清学标志物水平升高也可能与BWS有关[6-7],在没有其他明显异常的情况下可能有助于BWS的早期发现,基于这4种血清学标志物的异常升高和胎儿脐膨出,可早在妊娠14周发现BWS[6]。但是血清学筛查对BWS的特异性并不高,这也为BWS的产前早期诊断增加了难度。
1.2 产前超声检查大多数BWS病例是在出生后依据患者的临床表型被诊断出来的,但产前胎儿影像学检查可以发现某些提示BWS的特征:包括腹壁缺陷(脐疝、脐膨出)、羊水过多、巨大儿、巨舌,其他可见的特征还包括胎盘间质发育不良或胎盘肿大、胼胝体发育不全、腹内脏器肿大、心脏横纹肌瘤、肾上腺肿大/肾上腺皮质癌等[8-9]。目前临床上根据妊娠中期超声检查,可以依据两个主要特征(巨舌、巨大儿、腹壁缺陷)或一个主要特征加两个次要特征(羊水过多、肾肿大/肾发育不全、肾上腺肿块/肾上腺巨细胞瘤、胎盘间质发育不良)来判断是否需要进行进一步产前诊断BWS。
Shieh et al[10]关于对BWS孕期影像学检查的一项研究表明,腹壁缺陷是最常见且最早发现的异常表现,发现腹壁缺陷的时间明显早于巨大儿和巨舌,中位胎龄为妊娠18周,并且出生后100%得到证实,其余体征多在妊娠晚期时发现,因此,可对早期提示腹壁缺陷的胎儿进行连续超声监测,以便及时发现妊娠期间可能出现的其他BWS体征。有10%~20%的孤立性脐膨出的胎儿会被诊断为BWS,如果合并其他表型,诊断率可能会增加[10-11]。BWS是巨舌最常见原因之一,高达50%的巨舌胎儿会被诊断为BWS[12],但巨舌往往很难在胎儿期被超声发现。胎盘间质发育不良的胎儿约20%被诊断为BWS[13]。相比最常见的腹壁缺陷,巨舌和胎盘间质发育不良在产前诊断BWS上具有更高的特异性[14]。由于BWS胎儿表型谱广且特异性不高,通过超声诊断BWS并不容易。
1.3 产前基因检测产前基因诊断用于既往有BWS病史或存在BWS相关体征的家族史或本次妊娠超声检查疑似BWS的情况下。根据BWS的遗传学机制,甲基化特异性多重连接依赖式探针扩增(methylation-specific multiplex ligation-dependent probe amplification, MS-MLPA)可检测印记中心DNA的甲基化水平,染色体核型分析可检测染色体重复、易位、倒位,荧光原位杂交(fluorescence in situ hybridization, FISH)可检测染色体的微缺失和易位[15],单核苷酸多态性微阵列(single nucleotide polymorphism, SNP array)、短串联重复序列(short tandem repeat, STR)可检测pUPD及嵌合体[16-17],染色体微阵列分析(chromosome microarray analysis, CMA)可检测拷贝数变异(copy number variation, CNV)重复或缺失的程度及性质,Sanger测序对CDKN1C基因进行突变分析等。印记中心DNA甲基化异常是BWS最常见的致病机制,因MS-MLPA可同时对IC1/IC2进行甲基化评估和CNV检测,被推荐作为BWS的一线检测方法[1],该方法可确诊产前诊断中的大多数临床病例。由于MS-MLPA对嵌合体、染色体平衡易位及印记中心基因变异等均无法检出,MS-MLPA检测结果阴性并不能排除BWS的诊断。甲基化评估和CNV阴性的患者应通过Sanger测序进行CDKN1C突变分析。由于嵌合体的存在,各种检测方法均可能出现假阴性结果。Baker et al[14]的一项研究认为低水平嵌合体的甲基化在产前BWS诊断中并不常见,由于产前诊断的组织样本来源受限,导致无法对其他组织样本进行基因检测予以确认。因此,BWS产前基因诊断检测结果阴性仍不能排除BWS的诊断,产后应进一步结合临床分析[18]。
1.4 鉴别诊断BWS是一种过度生长综合征,与Simpson-Golabi-Behmel综合征[19](Simpson-Golabi-Behmel syndrome, SGBS)、Costello综合征[20]、Perlman综合征[21]和Sotos综合征[22]在临床表型上有显著重叠,临床上应予以鉴别。现将常见的产前表型归纳如下,见表2。

表2 BWS与SGBS、Perlman综合征和Sotos综合征的产前超声表现
1.4.1SGBS SGBS是一种罕见的X连锁过度生长综合征,呈X连锁隐性遗传,临床上分为两种类型:SGBSⅠ型和SGBSⅡ型。以SGBSⅠ型更常见,与位于Xp26上的GPC3基因突变有关。SGBSⅠ型的产前超声表现为巨大儿、羊水过多、器官肿大、肾脏畸形、先天性膈疝和心脏畸形,脐膨出少见[21]。在产前筛查中可能发现母体血清AFP升高和胎儿颈项透明层增厚,但缺乏特异性[23]。SGBSⅡ型常表现为胎儿水肿和多发畸形,由位于Xp22上的PIGA基因突变引起,需要通过基因检测来区分这两种类型。产前超声检查发现胎儿过度生长、羊水过多及伴有其他系统或器官畸形,应考虑SGBS的鉴别,并应进行进一步的基因检测,如CNV和全外显子组测序(whole exome sequencing, WES),检查母亲是否具有轻度SGBS表型并进行基因验证,有助于SGBS的诊断及提供遗传咨询。
1.4.2Costello综合征 Costello综合征由HRAS基因中的新发杂合突变引起的一种罕见疾病,呈常染色体显性遗传。产前超声表现为胎儿颈项透明层增厚、羊水过多、巨大儿、巨头畸形、手腕尺侧偏斜、长骨缩短及胎儿心动过速等[20]。胎儿心律失常少见,对治疗反应较好。Costello综合征胎儿常表现为巨头和体质量增加,而长度参数在正常范围内,这可能与胎儿皮下水肿有关[24]。产前超声检查显示胎儿颈项透明层增厚、巨大儿和一些特征性异常如叠指、长骨缩短、心肌病等应考虑Costello综合征。通过WES或全基因组测序(whole genome sequencing, WGS)可识别出多数导致Costello综合征的突变。
1.4.3Perlman综合征 Perlman综合征是一种罕见的常染色体隐性遗传的先天性过度生长综合征,由染色体2q37区域的DIS3L2基因的致病变异引起。产前超声表现常见的有羊水过多、巨大儿、内脏肿大、肾肿大和胎儿腹水[21]。80%~100%的患儿可见肾脏肿大,因此,Perlman综合征的产前诊断可基于肾脏肿大[25]。因DIS3L2也可导致IGF2的过度表达,与组织过度生长和肾母细胞瘤发展密切相关[26],基因检测对Perlman综合征与BWS的鉴别诊断至关重要。
1.4.4Sotos综合征 Sotos综合征是由位于染色体5q35上的NSD1基因单倍体剂量不足导致的过度生长伴智力障碍综合征,呈常染色体显性遗传,95%的患者为NSD1基因新发变异的散发病例,5%为家族性遗传病例。Sotos综合征产前超声表现可有轻度脑室扩大、头围或身长增大、胎儿颈项透明层增厚、羊水过多等[22],妊娠晚期可能发现胎儿脑或颅骨的异常,伴或不伴过度生长。妊娠期产前检查显示胎儿过度生长、巨头畸形和羊水过多伴有其他异常,如肾脏异常、中枢神经系统异常、NT升高,应考虑鉴别Sotos综合征。产前超声检查表现不具有特异性,胎儿MRI检查和追访父母的Sotos综合征表型证据及对其他表型阳性家系成员的遗传学检查可协助诊断该病。
2 遗传咨询
2.1 复发风险评估BWS复发的风险取决于遗传学分子亚型及其亲本来源[1]。对于有阳性家族史者,即使先证者遗传学检查未发现异常,复发风险仍然较高。BWS患者中约15%是家族遗传性病例,呈常染色体显性遗传,常见的有CDKN1C突变、染色体11p15.5异常。如果变异是母源性的,子代复发风险为50%[27]。原则上,所有染色体11p15 CNVs和平衡易位都有50%的复发风险。
2.2 对妊娠的影响在BWS妊娠中,孕妇发生妊娠期糖尿病、妊娠期高血压、阴道流血的风险增加,先兆子痫发病往往更早更严重,严重者甚至进展为HELLP综合征[7]。BWS胎儿早产发生率升高,巨大儿经阴道分娩可能会发生难产、新生儿窒息、臂丛神经损伤甚至新生儿死亡,在分娩方式的选择上更倾向于剖宫产[28-29]。
2.3 ART与BWSART是指在体外对配子和胚胎进行一系列技术处理使不孕夫妇受孕的方法,包括体外受精-胚胎移植(invitrofertilization and embryo transfer, IVF-ET )、卵胞质内单精子注射(intracytoplasmic sperm injection, ICSI )和种植前遗传学检测(preimplantation genetic test, PGT)等。ART妊娠胎儿发生BWS的风险增加10倍,通过ART妊娠的BWS患儿90%以上可检测出IC2的LOM[3]。印记基因DNA甲基化对环境极其敏感,因此,ART操作中任何步骤都有可能干扰印记位点DNA甲基化的形成从而对后代产生影响。迄今为止,有许多观察结果表明ART与BWS之间存在关联。Lazaraviciute et al[30]的Meta分析结果显示,经ART受孕的儿童和自然受孕的儿童相比,发生印记障碍的风险增加。因大多数患者表观基因型为IC1/IC2甲基化改变[3],Duffy et al[31]提议将ART纳入BWS的诊断评分体系中,并指出了胚胎植入前阶段对印记建立或维持的关键作用。目前,尚不清楚ART妊娠中BWS的高发是由于ART相关操作步骤或是不孕症本身引起,还需要更多研究来进一步阐明ART、不孕症与BWS之间的联系[1]。通过ART妊娠的胎儿,产前检查显示羊水过多、巨舌、胎盘间质发育不良、腹壁缺陷等临床表型时,应格外注意BWS的诊断。
2.4 围产期及产后管理产前诊断确认胎儿为患胎时,应当充分告知孕妇及家属,并由孕妇及家属决定是否治疗性流产或引产。对于产前诊断确诊或怀疑为BWS的新生儿,应在产后几天监测血糖水平,预防并及时治疗新生儿低血糖;巨舌和腹壁缺陷可通过外科手术予以矫正;心脏病变予超声心动图监测,轻者常可自愈,重者需手术矫正;超声监测BWS相关胚胎性肿瘤至7岁,肾母细胞瘤首选超声监测,肝母细胞瘤常采用超声联合血清AFP水平筛查,但对AFP的早期筛查价值存在争议[1]。
3 总结与展望
BWS作为一个儿科疾病,具有较大的临床异质性和遗传异质性,其诊断主要根据产后新生儿的表型结合基因检测,产前诊断不易。随着超声检测仪器及技术、介入性产前诊断技术、遗传学检测技术的快速发展,提升了产前诊断BWS的可行性和准确性。产科医师尤其是产前诊断医师,应该格外注意。血清学筛查阳性结果对BWS具有提示性作用。产前超声显示羊水过多、巨大儿、巨舌、腹部缺陷及腹内脏器肿大等特征常是考虑BWS的有效线索。绒毛膜穿刺及羊膜腔穿刺可直接获取胎盘组织或胎儿细胞样本进行基因检测,产前基因检测在BWS的明确诊断、产前咨询和判断预后等方面发挥着重要作用,但存在假阴性的风险。如果有阳性的分子检测结果,即使临床表型很少,也可以明确诊断,有阳性家族史者对产前诊断更有利。产前早期诊断BWS有利于优生优育,亦为围产期管理、产后管理、肿瘤早期筛查及长期监测提供支持。

