锰掺杂低聚水飞蓟超分子网络诊疗一体平台的开发与性能分析
柯月 马志方 石强*
1(中国科学院长春应用化学研究所, 高分子物理与化学国家重点实验室, 长春 130022)2(中国科学技术大学应用化学与工程学院, 合肥 230026)
目前,癌症仍然是人类健康的主要威胁之一[1-3],早诊断、早治疗是提高癌症患者生存率的关键。传统的癌症诊断主要包括超声、磁共振成像(MRI)、CT 扫描和X 射线等成像方式,但这些方法的敏感性差、分辨率低,导致确诊不及时从而错过最佳的癌症治疗窗口;此外,疼痛和侵入性的组织活检可能会导致不良的预后[4]。因此,开发高效且患者友好的诊疗一体化纳米平台成为癌症纳米医学研究的目标[5]。
随着纳米医学的进步,治疗诊断学的创新概念和策略备受关注,具有潜在的临床转化优势。诊疗制剂旨在使用相同的纳米药物的同时提供即时诊断和治疗[6],可以监测纳米药物在肿瘤部位的积累,监测其生物分布,根据特定触发释放药物,并评估治疗效果,为个性化医疗和患者友好的医疗诊断手段开发铺平道路,有利于开发多模式肿瘤治疗策略[7]。多种纳米材料如聚合物、磁性纳米粒和量子点等已被开发用于肿瘤检测和诊断[8-9],通过靶向和智能响应等策略增强成像灵敏度和分辨率,从而实现早期诊断和及时治疗,以改善患者的预后疗效[4]。
金属-酚醛网络是基于酚类配体和金属离子之间强配位作用的组装体系,因其具有良好的生物相容性、固有的生物降解性、多功能的负载能力、可控的尺寸和肿瘤微环境刺激响应性等特性备受关注[10]。金属-酚醛网络继承了金属离子和酚类自身特性,具有药物递送[11]、生物成像诊断[12]以及治疗[13]等多种功能。锰离子(Mn2+)是一种优良的磁共振成像(MRI)造影剂,已有多种锰基纳米材料被开发用作纳米造影剂[14]。此外,Mn2+还具有化学动力学、免疫治疗和调控肿瘤微环境等生理特性,能用于肿瘤治疗材料的制备[15-16]。本研究将甲醛缩合的多酚类抗肿瘤活性药物水飞蓟低度聚合后引入锰离子源(MnCl2),形成新的配位交联点,在聚乙烯吡咯烷酮(PVP)的辅助下,采用一锅法制备了PVP-低聚水飞蓟-锰三组分组装的金属-酚醛超分子网络纳米结构(PSM)。本方法制备条件简单,可以通过控制投料比调控纳米结构的形貌尺寸,并且能够负载小分子药物;同时,PSM 在酸性环境下能发生响应性降解,因此可用于智能响应性递送系统开发[17]。基于此,本研究通过一锅法制备了PVP-低聚水飞蓟-锰三组分组装的金属-酚醛超分子网络纳米结构(PSM),采用多种方法对其结构和性能进行了表征,并着重分析了其诊断成像和抗肿瘤活性。PSM 纳米结构的制备以及用于肿瘤诊疗示意图见图1。

图1 PSM 纳米结构制备以及诊断治疗的示意图Fig.1 Schematic diagram of preparation, diagnostic and treatment of PSM nanostructure
1 实验部分
1.1 仪器与试剂
Zetasizer Nano ZS 纳米粒度分析仪(英国马尔文公司);JEOL JEM-2800 高分辨透射电子显微镜(日本日立公司);Vertex 70 傅里叶变换红外光谱仪、D8 Advance X 射线衍射仪(德国布鲁克公司);X 射线光电子能谱(日本岛津公司);TGA 400 热失重分析(美国铂金埃尔默公司);SPECTRO 电感耦合等离子体质谱仪(ICP-MS,德国斯派克公司);Nano Drop 2000 紫外-可见分光光度计(美国赛默飞科学公司);M7 小动物核磁共振成像系统(以色列生命科学初创公司);Synergy 酶标仪(美国安捷伦公司)。
MnCl2·4H2O(分析纯)、二甲基甲酰胺(DMF,分析纯)和氨水(25%)(西陇科学公司);水飞蓟宾(98%,上海源叶生物有限公司);PVP(分子量55000)和罗丹明B 6G(RB,99%)(西格玛奥德里奇试剂公司);甲醛(37%,麦克林试剂公司);噻唑蓝(MTT,98%,阿拉丁试剂公司)。
1.2 实验方法
1.2.1 PSM纳米结构的制备
利用酚醛缩合反应[18]制备PSM 纳米结构。将0.5 mL 水飞蓟DMF 溶液(200 mg/mL)加入到4.5 mL乙醇溶液中, 搅拌均匀。在持续搅拌下分别加入18.5 mL PVP 溶液(150 mg)和0.225 mL 氨水,待溶液由浅绿色变为浅黄色后,加入0.19 mL 甲醛溶液(37%),室温条件反应24 h。向上述溶液中分别加入40、50 和65 mg MnCl2·4H2O, 室温下持续匀速搅拌24 h,16000 r/min 离心30 min, 收集不同水飞蓟-MnCl2质量投料比(2.5∶1、2∶1 和1.5∶1)的沉淀并用去离子水洗涤3 次, 产物在50 ℃烘干过夜, 于阴凉处储存备用。
1.2.2 模型药物RB的负载
通过物理吸附方式负载模型药物RB。向5 mL 1 mg/mL RB 溶液中加入1 mg PSM 纳米结构,避光持续搅拌12 h,16000 r/min 离心30 min, 得到PSM@RB,用去离子水洗涤3 次,测定PSM@RB 的UV-Vis 吸收光谱。
分别配制0、1.5625、3.125、6.25 和12.5 μg/mL 的RB 溶液,测定其在525 nm 处吸光度,并绘制浓度测定标准曲线。保留离心过程中的上清液,测定其在525 nm 处吸光度,并根据浓度标准曲线计算上清液中RB 的质量,根据公式(1)和(2)分别计算载药量(DLC)和载药率(DLE):
其中,mRB为投入RB 的总量(mg),ms为上清液中RB 的质量(mg),mtotal为载药纳米粒的质量(mg)。
1.2.3 PSM纳米结构体外降解与药物释放
通过透析法评估PSM 纳米结构的酸响应降解行为。将1 mL 5 mg/mL PSM 纳米结构分散液分别在pH=7.4 和5.5 的50 mL PBS 缓冲溶液中进行透析(透析袋截留分子量为3500),置于摇床上,于37 ℃振荡(30 r/min), 在0、2、8.5、15 和24 h 时间点取样,通过ICP-MS 法测定透析液中锰元素的释放量。
通过离心法测定RB 吸光度变化评估纳米结构药物释放行为。将1 mL PSM@RB(2 mg)分散液分别加到pH=5.5 或7.4 的PBS 缓冲液(19 mL)中,置于摇床上振荡(30 r/min), 分别在0、1、5.5、13、20 和36 h 等时间点取样,16000 r/min 离心10 min, 测定上清液于525 nm 处的吸光度。
1.2.4 磁共振成像(MRI)性能测定
对体外PSM 纳米结构的酸响应条件下的MRI 成像性能进行评估,为了模拟肿瘤部位酸性环境,按照Mn2+浓度分别配制5 组浓度梯度(0、0.0125、0.025、0.05 和0.1 mmol/L)的PSM 纳米结构分散液,置于终体积为1 mL 的pH=7.4 和6.5 的PBS 缓冲体系中,摇床振荡孵育24 h(30 r/min), 通过小动物磁共振成像系统(1T MRI)分别测定溶液的T1 加权MRI 成像性能和T1 弛豫时间。
建立4T1 小鼠乳腺癌背部荷瘤模型进行体内实验[19]。当肿瘤达到约120~150 mm3时,以25 mg/kg锰剂量分别向小鼠尾静脉注射MnCl2溶液和PSM 纳米结构分散液,在注射后0、1、2、6、12 和24 h 等特定时间点采用磁共振成像仪对小鼠体内T1 MRI 成像效果进行评估。
1.2.5 体外抗癌活性测定
通过细胞实验评估PSM 纳米结构的体外抗癌活性。将小鼠乳腺癌4T1 细胞复苏,接种到96 孔细胞培养板(接种密度为每孔1.0×104个细胞),生长至完全贴壁。分别加入200 μL 不同浓度梯度(0、6.25、12.5、25、50 和100 μg/mL)的水飞蓟(S)、MnCl2(M)、水飞蓟-MnCl2混合液(SM)和PSM 纳米结构完全培养基分散液,在细胞培养箱中孵育24 h。弃去上清液,各孔分别加入MTT 试剂反应4 h, 测定其在490 nm 处的吸光度。细胞存活率(Cell viability)根据公式(3)计算。
其中,ODtest为待测样品孔的吸光度,ODcontrol为对照组仅加入细胞和空白培养基的吸光度,ODblank为未加细胞的空白孔的吸光度。
2 结果与讨论
2.1 PSM纳米结构的粒径与形貌分布
水飞蓟与MnCl2不同投料质量比得到的PSM 的透射电镜(TEM)图如图2A 所示。当水飞蓟与MnCl2投料质量比为2.5∶1 时,得到了粒径约为80 nm 的球形纳米粒子,颗粒边缘粗糙有毛刺,粒子之间有粘连。这可能是由于在碱性溶剂中,水飞蓟经甲醛缩合后的低聚物与加入的Mn2+发生配位作用,以Mn2+为交联点生长成无定型球状。当投料比为2∶1 时,纳米粒的尺寸增大,形成边缘更清晰的均一球体。投料比增至1.5∶1 时,球形纳米粒之间发生聚集,出现更大粒径的椭圆形纳米结构,粒径分布范围更广。TEM图表明,MnCl2的添加量对纳米球体形成具有重要的作用,PSM 纳米结构可能是由多个超小无定型纳米粒子聚集组装形成的。进一步对投料比为2∶1 的PSM 纳米结构进行高分辨透射电镜表征(图2B),可见碳(C)、氮(N)、氧(O)以及锰(Mn)元素均匀分布在PSM 纳米微球球体表面,进一步证实了PSM 纳米结构是通过Mn2+与低聚水飞蓟酚羟基络合交联生长成均一的球体结构。

图2 PSM 纳米结构的形貌与元素分布:(A)水飞蓟与氯化锰投料比不同时PSM 纳米结构的透射电镜图,标尺为200 nm;(B)水飞蓟与氯化锰投料比2∶1 的PSM 纳米结构元素分布Fig.2 The morphology and structure of PSM nanostucture: (A) Transmission electron microsphere (TEM)images of PSM with different feeding ratio of silymarin to MnCl2,scale bar is 200 nm;(B)Elemental distribution of PSM nanoparticles with feeding ratio of 2∶1 of silymarin to MnCl2
进一步通过纳米粒度仪测定了采用不同水飞蓟-MnCl2投料质量比制得的纳米结构的粒径与表面电势变化,结果如表1 所示。随着MnCl2质量增加,PSM 纳米结构的水合粒径逐渐增大,当投料比从2.5∶1变化到1.5∶1 时,纳米粒子粒径从78.0 nm 增至156.3 nm;纳米粒子的表面电位呈负电位,并略有降低。

表1 水飞蓟与氯化锰不同质量投料比制备的PSM纳米结构的粒径与电势Table 1 Size and Zeta potential of PSM nanoparticles prepared with different feed ratios of silymarin and MnCl2
以上结果表明,可以通过改变离子源MnCl2的比例来调整PSM 金属-酚醛超分子网络纳米微球的尺寸。制备PSM 金属-酚醛超分子网络纳米结构时,水飞蓟与MnCl2最佳质量比为2∶1。由此,通过简单的一锅法制备了PSM 纳米结构。
2.2 PSM纳米粒结构的性质表征
PSM 的傅里叶变换红外(FTIR)光谱图见图3A。红外光谱中出现水飞蓟的多酚苯环骨架伸缩振动峰(1588 和1512 cm‒1)、碳氧键C—O 的伸缩振动峰(1228 cm‒1)以及苯环指纹区C—H 键面外弯曲振动峰(820 cm‒1), 说明制备的PSM 纳米结构由低聚水飞蓟与PVP 组装[20-21]。采用UV-Vis 吸收光谱测定了PSM 的吸收峰变化(图3B),水飞蓟溶液的最大吸收峰在300 nm 处,PSM 纳米结构在240 nm 处出现了新的尖锐吸收峰,这可能是低聚水飞蓟苯环及共轭体系π-π*或n-π*跃迁导致的。同时,PSM 纳米结构在340~500 nm 之间出现宽带吸收峰,这可能是Mn2+与低聚水飞蓟配位后形成的电子迁移吸收谱带。以上结果证实水飞蓟分子经甲醛缩合低度交联后通过与Mn2+配位组装形成了金属-酚醛超分子网络纳米结构PSM。

图3 PSM 纳米结构的结构与组成表征:(A)PSM 纳米结构的红外吸收光谱;(B)紫外-可见吸收光谱;(C)X 射线衍射(XRD)谱图;(D~E)PSM 纳米结构以及Mn 2p 的X-射线光电子能谱(XPS)图;(F) 热失重(TGA)分析PSR:未掺锰的低聚水飞蓟Fig.3 Characterization of the structure and composition of PSM nanostructure: (A) Fourier transform infrared(FTIR)spectra of PSM;(B)UV-Vis absorption spectra of PSM and silymarin;(C)X-ray diffraction(XRD)spectra;(D–E)X-ray photoelectron spectroscopy(XPS)spectra of PSM and Mn 2p;(F)Thermogravimetric analysis(TGA)PSR: silymarin oligomers without manganese doping
采用XRD 测定了不同材料的晶体结构(图3C),其中,水飞蓟具有小分子晶体强烈的特征衍射峰,而在PSM 纳米结构中此特征峰消失,说明PSM 纳米结构可能是以各组分无定型的混合物形式存在的[22-23]。为了进一步探究PSM 纳米结构的元素分布,测定了物质的X-射线光电子能谱(XPS)图(图3D和图3E)。由图3D 的XPS 谱可知,PSM 纳米结构中存在C、N、O、Mn 元素,与高分辨透射电镜结果(图2B)一致。在PSM 的Mn 2p 谱(图3C)中,Mn 元素位于641.6 和653.1 eV 处的2 个峰与Mn3O4的结合能一致,表明Mn 可能是通过与O 原子配位的方式形成超分子网络配位交联点。通过ICP-MS 和热重分析(TGA)进一步测定PSM 纳米结构的成分组成(图3F)。采用ICP 测得Mn 元素含量约为25.3%,由TGA 得到Mn 组分含量约为27.1%,二者测得结果基本一致。通过未掺Mn 的低聚水飞蓟(PSR)的TGA曲线计算,PSM 纳米结构中水飞蓟组分含量约为31.8%。
2.3 PSM药物释放与降解
测定了模型药物RB 的紫外-可见吸收光谱(图4A),根据其在525 nm 处的最大吸收峰绘制浓度标准曲线(图4B)。负载RB 后的纳米结构(PSM@RB)在525 nm 处出现RB 对应的特征吸收峰(图4A),表明PSM 纳米结构成功负载模型药物RB。根据吸收峰强度以及RB 浓度标准曲线计算得到RB 的DLC 和DLE 分别为23.4%和4.7%。

图4 PSM 纳米结构的药物负载以及体外酸响应释放和降解:(A)负载RB 后紫外-可见光吸收光谱;(B)RB 的浓度标准曲线;(C)PSM@RB 在不同pH 下的药物释放曲线;(D)PSM 纳米结构在不同pH值下降解释放Mn 的曲线Fig.4 Drug loading and in vitro acid responsive release and degradation properties of PSM nanostructure:(A) UV-Vis spectra of PSM; (B) Standard concentration curve of Rhodamine B (RB); (C) Drug release curve of PSM@RB at different pH values; (D) Degradation release curves of Mn from PSM at different pH Values
通过测定PSM@RB 样品在不同pH 值下的药物释放以及Mn 释放曲线考察其酸降解性质。在酸性磷酸盐缓冲液(pH=5.5)中,RB 在36 h 内的释放量为71.5%,而在中性条件下,RB 的释放量仅为50.9%(图4C),说明PSM 纳米结构具有在酸性条件下的药物释放性质。由于肿瘤部位在代谢过程中呈现弱酸性,因此PSM 纳米结构有利于在肿瘤病灶部位释放负载药物[24]。ICP-MS 测定Mn 元素的释放结果进一步证实了酸响应性和可降解特性(图4D)。当pH 值从5.5 上升到7.4 时,Mn 在24 h 内释放量从48.5%下降至10.7%,这证明PSM 纳米结构能特定响应酸性微环境发生降解。以上结果表明,PSM 纳米结构能够通过酸响应性降解实现药物递送目的。
2.4 PSM纳米结构的MRI性能分析
将含有不同Mn2+浓度梯度的PSM 纳米结构分散在不同缓冲体系(pH=7.4 和6.5)中孵育24 h, 通过磁共振成像仪进行T1 加权成像。如图5A 所示,随着Mn2+浓度增加,T1 信号逐渐增强,证明PSM 纳米结构MRI 成像具有浓度依赖性;同时,在酸性环境中,T1 加权图像信号也较中性环境略有增强,这可能是酸性条件下纳米结构发生降解快速释放的顺磁性Mn2+引起的[25]。此外,根据不同梯度浓度的PSM 纳米粒结构的T1 弛豫时间,测定了弛豫率r1(1/T1),如图5B 所示,在酸性条件下,r1从8.8 L/(mmol·S)升至10.1 L/(mmol·S)。体外MRI 成像结果表明,制备的PSM 纳米结构具有酸响应的肿瘤诊断成像的造影剂潜能[24]。

图5 PSM 纳米结构体外和体内MRI 成像性能测定:(A~B)不同浓度梯度的PSM 分散液的T1 加权成像以及对应的弛豫率r1(缓冲体系的pH 值分别为7.4 和6.5,浓度单位为mmol/L);(C)4T1-荷瘤小鼠分别注射MnCl2 和PSM 溶液后在不同时间点的T1 加权成像Fig.5 Measurement of MRI performance of PSM nanostructure in vitro and in vivo:(A–B)T1 weighted imaging of different concentrations of PSM dispersion and corresponding T1 relaxation rate r1 (pH at 7.4 and 6.5,respectively);(C)T1 weighted imaging of 4T1-tumor bearing mice injected with MnCl2 and PSM formulations at different time points
对MnCl2和PSM 在4T1 荷瘤小鼠体内MRI 的成像能力进行评估(图5C)。静脉注射MnCl2溶液后,荷瘤小鼠体内T1 加权成像在2 h 达到最强,主要富集在肝脏及肾脏部位,在肿瘤部位信号较弱;随着时间延长,信号降低,注射24 h 后,在肾脏部位信号显著降低,这表明MnCl2在小鼠体内循环时间短,容易被肝肾清除。对比MnCl2处理的小鼠,注射PSM 溶液的小鼠肿瘤部位具有明显的T1 信号富集,并随着时间延长而逐渐增强,在12 h 强度达到最大,表明PSM 纳米粒在肿瘤部位发生了酸响应释放Mn2+,特异性增强了病灶部位成像效果。在24 h 体内的T1 信号仍然没有明显变化,说明PSM 纳米结构具有更长的体内循环时间。上述体内外MRI 结果表明,制备的PSM 纳米结构具有酸响应激活MRI 以及体内长循环的特性,有望在肿瘤诊断成像以及肿瘤治疗过程的监测中广泛应用[26]。
2.5 PSM纳米结构的体外抗肿瘤活性
利用4T 小鼠乳腺癌细胞研究PSM 纳米结构的体外抗肿瘤活性,通过细胞毒性实验(MTT 法)测定PSM 纳米结构对4T1 小鼠乳腺瘤细胞的杀伤力,结果见图6。
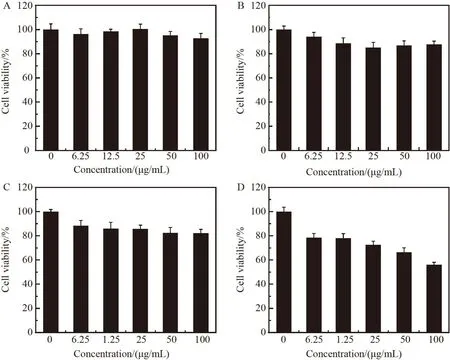
图6 不同浓度的制剂处理的4T1 细胞存活率:(A)水飞蓟;(B)MnCl2 溶液;(C)水飞蓟-MnCl2 混合溶液;(D)PSM 纳米结构各组分实际浓度按照PSM 纳米结构质量浓度对应的百分含量计算(水飞蓟:31.8%;Mn2+:27.1%)Fig.6 Cell viability of small molecules and PSM at different concentration levels: (A) Silymarin; (B) MnCl2 solution; (C) Silymarin-MnCl2 mixed solution; (D) PSM nanoparticlesThe actual concentration of each component is calculated as the percentage corresponding to the mass concentration of PSM nanostructures (Silymarin: 31.8%;Mn2+: 27.1%)
对于不同小分子药物组处理的4T1 小鼠乳腺瘤细胞,药物浓度在25 μg/mL 以下时基本没有毒性,细胞存活率均在80%以上。药物浓度升至50 μg/mL 时,MnCl2和水飞蓟-MnCl2混合溶液处理的实验组4T1小鼠乳腺瘤细胞存活率略有降低,低于80%,显示出轻微的细胞毒性,这主要是由于高浓度Mn2+的轻微抗癌活性导致的。对比其它实验组,PSM 在浓度为6.25 μg/mL 时表现出细胞毒性,而且随着浓度增大,4T1 小鼠乳腺瘤细胞存活率下降幅度增大,细胞杀伤力更强;当PSM 浓度达到100 μg/mL 时,4T1 小鼠乳腺瘤细胞存活率为56%。PSM 纳米结构的抗肿瘤活性可能来自于两方面:(1)纳米结构中水飞蓟以低聚物的形式存在,相较于小分子单体,具有更强的抗癌活性[27];(2)来自于PSM 纳米结构的Mn2+能够通过多种抗肿瘤通路激活诱导产生更强的抗癌活性[28]。
3 结论
通过简单的一锅法制备了PVP-低聚水飞蓟-锰3 种组分组装的金属-酚醛超分子网络纳米结构PSM,其锰含量达25.3%,并且具有酸性响应降解性质,可在模拟肿瘤微酸性环境中发生降解释放Mn2+,并实现模拟药物的高效递送,具有潜在的载体应用价值。实验结果表明,此材料在体外实验中表现出良好的MRI 性能。对于荷瘤小鼠,制备的PSM 纳米结构在体内具有较长的循环时间(>24 h)。此外,4T1 小鼠乳腺瘤细胞毒性实验表明,PSM 纳米结构具有抗肿瘤活性,100 μg/mL 时4T1 小鼠乳腺瘤细胞存活率低至56%。本工作对于肿瘤治疗和肿瘤监测具有参考价值,为构建诊疗一体纳米材料的研究工作提供了思路。

