铜胁迫对苹果幼苗生长及生理特性的影响
王佳乐 步凡 何佳丽 吕德国

摘要:通过研究不同供铜(Cu)水平对苹果幼苗生长、光合作用、Cu富集情况和氧化应激反应的影响,探究苹果苗Cu胁迫阈值,旨在为苹果抗逆栽培提供理论指导。以寒富苹果为试材,设置不同浓度(60、180、300、600、900 mg/kg)Cu处理,处理后60 d取样,测定幼苗各组织生物量、根系形态、光合特性、各器官Cu含量以及总Cu含量、活性氧、抗氧化物含量和抗氧化物酶活性。结果表明,当Cu胁迫浓度超过300 mg/kg时,幼苗各器官生物量显著降低,根系形态指标(总根长、根总表面积、根总体积)、叶片净光合速率、气孔导度、PSⅡ最大光化学效率、光合性能指数均呈下降趋势。各组织Cu含量为根>叶>茎。随着Cu浓度提高,幼苗各组织中活性氧物质积累,总硫醇、可溶性酚、抗坏血酸等物质含量及超氧化物歧化酶、过氧化氢酶等酶活性以300 mg/kg为临界点,呈先增高后降低趋势。
关键词:铜;苹果;胁迫;幼苗生长;生理响应
中图分类号:S661.101文献标志码:A
文章编号:1002-1302(2023)16-0105-08
收稿日期:2022-05-15
基金项目:辽宁省兴辽英才计划-青年拔尖人才项目(编号:XLYC1907105);辽宁省教育厅科学研究经费项目(编号:LSNQN201916);国家现代农业产业技术体系建设专项(编号:CARS-28)。
作者简介:王佳乐(1998—),男,甘肃平凉人,硕士研究生,主要从事果树栽培与生理生态研究。E-mail:wjl1655294867@163.com。
通信作者:何佳丽,博士,副教授,主要从事果树栽培与生理生态研究。E-mail:hejiali1017@163.com。
近年来由于工业废料排放,化肥、农药的过量施用导致果园铜(Cu)污染问题日益严重。相关研究表明,我国环渤海湾优势苹果产区因临近工矿业,且存在严重的盲目施用化肥、农药现象,导致土壤中Cu过量积累[1]。单正军等对江苏徐州大沙园30处苹果园及山东即墨12处苹果园的铜含量进行测定,发现分别有6.7%和8.3%的土壤Cu含量远超果园土壤Cu含量的二级标准[2]。因此,果园土壤Cu污染已成为果树生产中亟需解决的重要问题。
Cu是自然界中广泛存在的重金属元素,是植物体内的微量营养元素之一,参与光合电子传递作用、碳同化和氮代谢等多种生理反应[3]。但土壤Cu含量超标会影响植物根系正常发育、抑制光合呼吸作用、减少叶片色素含量,进而导致植株生长受损[4-5]。过量Cu还能导致活性氧(ROS)的产生,使细胞膜脂过氧化,从而破坏细胞膜结构与功能。为了缓解Cu胁迫引起的氧化损伤,植物会通过激活抗氧化防御系统来抵御毒害。其中游离脯氨酸、可溶性酚、抗坏血酸等抗氧化物质与超氧化物歧化酶、过氧化氢酶等酶类物质,在ROS清除过程中发挥重要作用[6-7]。目前,关于Cu胁迫对植物生长发育及生理特性的影响已在许多农作物如小麦、玉米、辣椒上开展[8-10],但Cu胁迫对苹果影响的研究较少,其耐Cu胁迫阈值尚不明确。鉴于此,本研究以东北冷凉气候区广泛栽植的寒富苹果幼苗为试材,通过设置不同浓度Cu处理,来探索Cu胁迫对苹果幼苗生长发育及生理特性的影响。旨在为明确寒富幼苗的耐Cu阈值提供理论基础,为农户合理施用含Cu肥料及相关制剂提供科学指导。
1 材料与方法
1.1 试材及取样
本试验于沈阳农业大学果树科研基地(123°341′E,41°491′N)进行。以一年生寒富苹果(Malus domestica Borkh.)枝条为接穗,山定子(Malus baccata Borkh.)为砧木,于2018年4月采用芽接的方式进行嫁接。培养期间每天浇Hoagland营养液(Cu浓度为0.5 μmol/L)50 mL[11],以满足试材的正常生长需要,待其长到15~20 cm时进行Cu处理。选取长势一致的幼苗,移栽至20 cm×20 cm 的营养钵内进行沙培,每个营养钵装有4 kg沙子[Cu浓度背景值为(1.03±0.2) mg/kg]。以Hoagland营养液中的基础Cu浓度为对照(CK),额外添加不同浓度的CuSO4溶液为处理,分别为T1,60 mg/kg;T2,180 mg/kg;T3,300 mg/kg;T4,600 mg/kg;T5,900 mg/kg。共计6个处理,每个处理设6次重复,培养60 d后收获试材,用于指标测定。试材收获前,用蒸馏水冲洗各株幼苗,除去根系表面的Cu2+及植株上的杂质。然后将各组织分别收取,记录鲜质量。取好的样品放入液氮中,于超低温冰箱保存,以便进行后续试验。
1.2 测定项目
1.2.1 生物量、根系构型 称取100 mg左右的各组织鲜样于60 ℃下烘干,测定其干质量、干湿比与生物量。将幼苗根洗净后,利用WinRHIZO根系掃描系统(WinRHIZO 2012,Regent Instruments Canada INC.,Montreal,Canada)测定各个植株的根系构型。
1.2.2 光合参数及荧光参数的测定 在试材收获之前对幼苗成熟叶(LPI=7~9)进行测定,利用CIRAS-2光合仪测定叶片的净光合速率、气孔导度、蒸腾速率及胞间CO2浓度。利用Handy-PEA连续激发式荧光仪测定叶片的PSⅡ最大化学效率及光合性能指数。
1.2.3 Cu含量、总Cu量、富集系数及转运系数的测定 称取各组织鲜样(根取0.5 g左右,茎和叶各取0.7 g左右)进行消煮(温度100 ℃,稳定于 200 ℃),利用火焰原子吸收分光光度计(Hitachi 180-80,HitachiLtd,Tokyo,Japan)测定各组织Cu含量和总Cu量[12]。根据各组分的Cu含量与土壤中Cu含量的比值,来计算富集系数(BCF)。用幼苗地上部分Cu含量与根系部分Cu含量的比值,计算样品的转运系数(Tf)。
1.2.4 O-2·、H2O2和MDA含量测定 超氧阴离子(O-2·)、过氧化氢(H2O2)的测定分别参照Zhou等[13]、He等[14]的方法。丙二醛(MDA)含量测定采用硫代巴比妥酸法,取上清液利用分光光度计测定待测溶液450、532、600 nm处的吸光度。
1.2.5 抗氧化物的测定 总硫醇(T-SH)含量的测定参照Zhou等的方法[11],可溶性酚、谷胱甘肽(TG)、还原型谷胱甘肽(GSH)及氧化型谷胱甘肽(GSSG)含量的测定参照He等的方法[12]。总抗坏血酸(TA)、抗坏血酸(ASC)和脱氢抗坏血酸(DHA)含量的测定分别使用抗坏血酸含量测定试剂盒(微板法)和脱氢抗坏血酸含量测定试剂盒(微板法)2种试剂盒(苏州格锐思生物科技有限公司)测定。超氧化物歧化酶(SOD)、抗坏血酸过氧化物酶(APX)、谷胱甘肽还原酶(GR)、过氧化物酶(POD)及过氧化氢酶(CAT)的活性测量方法参照Wang等的方法[15]。
1.3 数据分析
采用SPSS Statistics软件对本试验中所得的数据进行统计与分析。所有数据在统计与分析前会进行正态分布检测。方差分析F检验当P<0.05时认为差异显著。
2 结果与分析
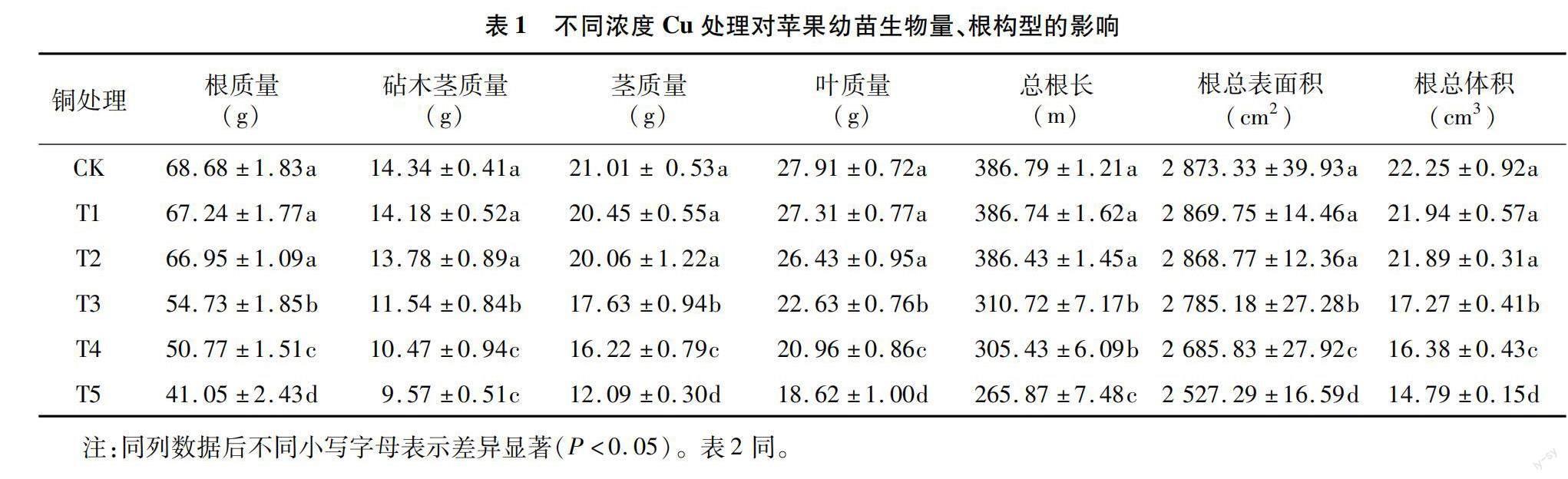
2.1 Cu胁迫对苹果幼苗生长的影响
由图1所示,当Cu浓度超过300 mg/kg,幼苗表现出明显的Cu胁迫现象。表现为株高降低,根系整体褐色加深、主根变短、侧根与白根数量减少,并且出现叶片变小且叶片边缘发生卷曲现象。
由表1可知,当Cu胁迫浓度为60、180 mg/kg时,幼苗生物量和根构型相关参数与对照相比无显著差异。但当Cu胁迫浓度超过300 mg/kg,植株生物量、根构型均有显著降低趋势,并且这种不利影响随Cu胁迫浓度的增加而增大。最高浓度处理(T5)与对照相比,根质量、茎质量以及叶质量分别降低了40.23%、42.46%和33.29%;总根长、根总表面积和根总体积分别降低了31.26%、12.04%和33.53%,这与试材生长状况表现一致。
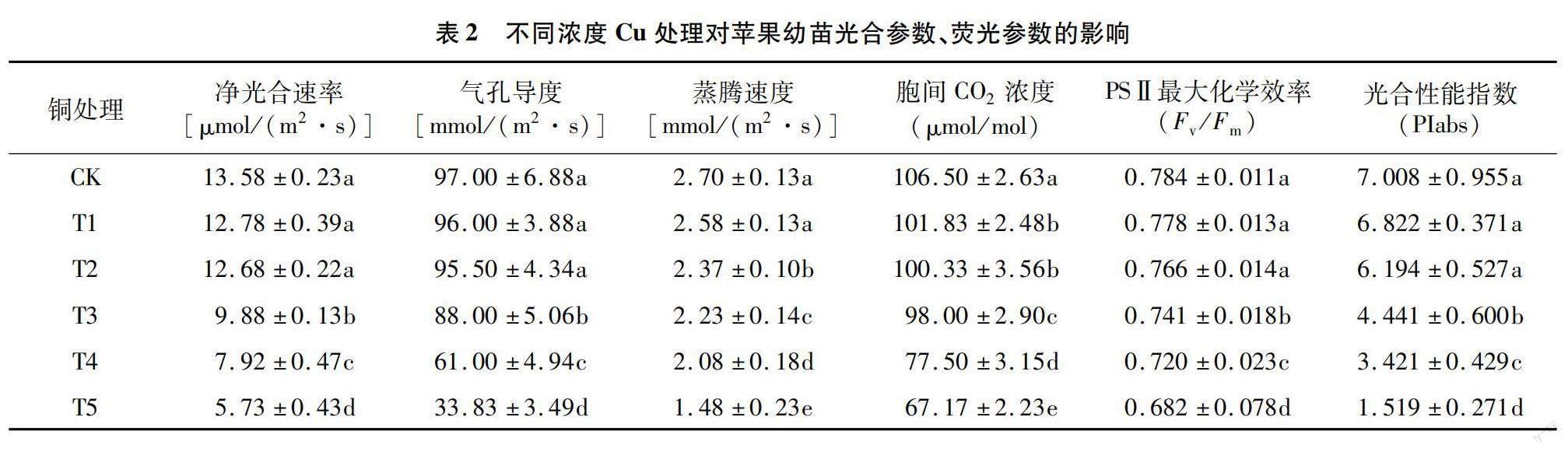
由表2可知,苹果幼苗的净光合速率与气孔导度在Cu处理浓度超过300 mg/kg后呈显著下降趋势,最高处理(T5)与对照相比,分别下降57.81%和65.12%。胞间CO2浓度在Cu胁迫浓度为 180 mg/kg后逐渐下降。PSⅡ最大化学效率和光合性能指数在Cu浓度≥300 mg/kg后显著下降。最高浓度下叶片的PSⅡ最大化学效率和光合性能指数与对照相比分别下降了13.01%和78.32%。
2.2 Cu胁迫对苹果幼苗中Cu含量的影响
由图2可知,苹果幼苗各组织Cu含量为根>砧木茎>叶>茎,其中地下部(根)的Cu含量远大于地上部。各组织的Cu含量随着Cu处理浓度的增加而逐渐增大,当Cu处理浓度超过300 mg/kg后,根中的Cu含量大幅提高。
由图3-a可知,根中总Cu量整体最多,其次是砧木茎,接穗茎、叶组织相对较少。各组织的总Cu量随着Cu处理浓度的增加而逐渐增大,当Cu浓度高于300 mg/kg,根系中总Cu量急剧增加。BCF以180 mg/kg的Cu处理浓度为临界点,表现出先降低后升高的趋势(图3-b)。无论在多少浓度的环境下,幼苗地上部分的Tf都是砧木茎>叶>茎,且随着Cu浓度提高,砧木茎和叶的Tf呈下降趋势(图3-c)。
2.3 Cu胁迫对苹果幼苗O-2·、H2O2和MDA含量的影响
如图4所示,随着Cu浓度提高,寒富苹果幼苗根、茎和叶中O-2·含量逐渐增加,并在Cu胁迫浓度为900 mg/kg时达到最大值。与对照相比,各组织的H2O2含量在低浓度(60、180 mg/kg)Cu胁迫下有小幅增加,但当Cu浓度超过300 mg/kg时,其含量显著增加(图4-b)。MDA含量的变化趋势与O-2·和H2O2含量类似(图4-c)。
2.4 Cu胁迫对苹果幼苗抗氧化系统的影响
由图5可知,Cu胁迫诱导了幼苗各组织中游离脯氨酸的积累。当Cu浓度超过300 mg/kg,根和叶中游离脯氨酸的含量急剧增加(图5-a1~图5-a3)。最高浓度Cu处理与对照相比,根、茎、叶中游离脯氨酸的含量分别提高了77.94%、34.11%和71.57%。與对照相比,根中总硫醇含量随着Cu浓度的提高显著下降,其中根系下降幅度最大,最高浓度处理时较CK下降了43.29%,而茎则以 300 mg/kg 的Cu浓度为临界点呈先上升后下降的趋势(图5-b1~图5-b3)。由图5-c1~图5-c3可知,随着Cu浓度提高,根系可溶性酚含量逐渐降低。茎中的可溶性酚含量以300 mg/kg Cu处理浓度为临界点,表现出先上升后下降的趋势。而各组织中GSH含量以300 mg/kg的Cu浓度为临界点,呈先增多后减少的趋势(图5-d1~图5-d3)。
由图6可知,随着Cu浓度提高,幼苗各组织中SOD活性变化各不相同,其中根和茎部分以 300 mg/kg 的Cu浓度为临界点,随Cu浓度提高,呈先上升后下降的变化趋势。叶片部分则随着Cu浓度的升高,SOD活性显著下降,并且叶片中SOD活性明显低于茎和根(图6-a1~图6-a3)中。与对照相比,除茎中T5浓度以外,根与茎中CAT活性均随着Cu浓度提高而显著降低,叶片部分则是以 300 mg/kg 的Cu浓度为临界点表现出先升高后降低的趋势(图6-b1~图6-b3)。对于APX活性而言,与对照相比,根系和叶片部分的APX活性均以300 mg/kg为临界点表现出先升高后降低的趋势,而茎中则逐渐下降,其中根系部分APX活性最高(图6-c1~图6-c3)。各组织中的POD活性变化与SOD活性变化趋势一致,茎中POD活性最高,叶片中POD活性远低于根、茎(图6-d1~图6-d3)。对于GR活性来说,与对照相比,当Cu浓度低于300 mg/kg时幼苗根系的GR活性显著提高,高于这个浓度之后呈显著降低的趋势。而茎和叶部分的GR活性随着Cu浓度的提高表现出下降趋势(图6-e1~图6-e3)。
3 讨论
Cu在植物生理代谢过程中发挥重要作用,一般认为植物组织中Cu含量以5~30 mg/kg为宜[16-17]。当植物中的Cu浓度超过临界限值时会对植物细胞产生毒性,抑制植物生长[18-19]。黎建玲等发现当Cu浓度大于50 mg/L 时,南瓜种子萌发和幼苗根系的生长会被顯著抑制[20];韩承华等在五月慢油菜上发现当Cu浓度大于90 mg/L 时,试材根系发育受损,植株会有死亡现象发生[21]。本研究表明,苹果幼苗对Cu的耐受浓度为300 mg/kg,当Cu浓度过高,幼苗总根长、根总表面积和根总体积均显著下降。这可能与高Cu浓度引起气孔导度下降、CO2供应受阻,致使净光合速率降低、光合底物减少有关。对叶绿素荧光参数的分析可知,高浓度Cu处理下,叶片PSⅡ最大化学效率和PIabs均呈下降趋势,进一步说明Cu胁迫会显著抑制幼苗叶片的光合作用,影响根系生长,降低幼苗生物量。
植物通过将重金属滞留在根中来减弱其毒害作用。本研究通过对各组织中Cu含量和总Cu量进行测定,表明苹果幼苗可以将大部分的Cu滞留在根中,从而抑制Cu向地上部分转运,生物富集系数也明确了这一现象,这与前人研究结果[22]类似。在本试验中,苹果幼苗的Cu转运系数以180 mg/kg为临界点,呈先升高再降低的变化趋势,这可能是因为当Cu浓度达到300 mg/kg时,其根系受损,导致向地上部分的转运能力降低。
Cu胁迫会诱导ROS产生与MDA的积累,对植物造成氧化胁迫,从而对植物生长产生抑制,严重时甚至引起细胞死亡[23]。这一现象在甘蔗、粉葛、菠菜等植物中已经被证实[24-26]。虽然低浓度的ROS可作为信号分子参与调节植物生长发育和逆境胁迫响应[27],但当浓度高于细胞所能承受的限度时,会以极强的氧化性造成细胞膜脂过氧化,影响蛋白质、脂质甚至核酸的功能,最终导致细胞损伤乃至死亡[28]。本试验表明,随着Cu浓度提高,幼苗各组织中O-2·与 H2O2含量均有增加趋势。当Cu浓度超过300 mg/kg时,各组织中的MDA含量显著增加,这可能是活性氧的积累促进MDA的产生,膜透性增加受损[29]。进一步说明随着Cu浓度增大,苹果幼苗细胞膜受到的伤害越严重。由此可以判断此时幼苗已经开始受到Cu胁迫伤害,且随着细胞膜脂过氧化程度加深,幼苗生理代谢受到影响,最终表现为生长受到抑制。
为了免受ROS侵害,植物进化出一系列复杂的防御机制来避免或减少氧化损伤[30-32],游离脯氨酸为其中重要的物质之一。在植物组织中广泛积累的游离脯氨酸一方面能协调原生质体内外的渗透平衡,提高植物的抗氧化能力[33];另一方面可与总硫醇、可溶性酚共同作为非酶类抗氧化剂参与活性氧清除。蒋英等研究指出,Cu胁迫条件下,丝瓜中游离脯氨酸含量呈显著上升趋势,且随Cu 浓度的提高而提高[34]。本研究同样发现,当Cu浓度超过300 mg/kg,各组织中脯氨酸含量急剧上升,而总硫醇和可溶性酚含量并未随着Cu浓度提高而逐渐增加,这可能说明总硫醇和可溶性酚不是苹果幼苗抵抗Cu胁迫的关键ROS清除物质。
谷胱甘肽-抗坏血酸循环是保护植物细胞免受氧化胁迫的重要途径[35]。GSH的提高有助于清除活性氧。阚世红等研究发现,外源硫酸钠可以通过维持高水平的GSH来降低膜脂过氧化程度,缓解Cu胁迫对生菜幼苗生长的抑制[36]。本试验中,当Cu浓度低于300 mg/kg时,幼苗根中GSH的含量呈上升趋势,这使GSH被积累,有利于清除由Cu胁迫导致的过量ROS。此外,植物体内的抗氧化酶系统也在遭受氧化胁迫时发挥关键作用。本研究表明,当苹果幼苗受到Cu胁迫时,根中的SOD、APX、POD、GR,茎中SOD、POD以及叶中CAT、APX的活性均显著升高。但当Cu浓度高于300 mg/kg,这些酶的活性均出现下降趋势,这可能是由于此时的Cu浓度已超过了植物的调节能力范围,导致酶活性降低[37],这与李晓梅等的研究结果[38-39]一致。
综上,本研究分析比较了不同供Cu水平下幼苗生长发育情况及对活性氧和抗氧化物的影响,表明300 mg/kg的Cu浓度是寒富幼苗能忍耐的最高限度,有助于探明苹果对Cu胁迫的抵御机制,为明确寒富幼苗受Cu毒害的阈值提供理论基础。
4 结论
供Cu量过高(超过300 mg/kg)会抑制苹果幼苗的正常生长,降低叶片光合作用,抑制根系发育。过量的Cu主要在根系中积累。Cu胁迫会导致ROS与MDA过量积累,造成氧化胁迫。虽然苹果幼苗可通过提高抗氧化物含量及抗氧化酶活性来抵御Cu毒害,但当Cu浓度超过300 mg/kg时抗氧化系统受到显著抑制,这说明苹果幼苗能忍耐的最高环境Cu浓度为300 mg/kg。
参考文献:
[1]许延娜. 胶东半岛苹果园重金属污染评价[J]. 中国果树,2009,51(2):40-44.
[2]单正军,王连生,蔡道基,等. 果园土壤铜污染状况及其对作物生长的影响[J]. 农业环境保护,2002,22(2):119-121.
[3]Zeng Q Y,Ling Q P,Wu J Y,et al. Excess copper-induced changes in antioxidative enzyme activity,mineral nutrient uptake and translocation in sugarcane seedlings[J]. Bulletin of Environmental Contamination and Toxicology,2019,103(6):834-840.
[4]Chaoui A,Jarrar B,Ferjani E E. Effects of cadmium and copper on peroxidase,NADH oxidase and IAA oxidase activities in cell wall,soluble and microsomal membrane fractions of pea roots[J]. Journal of Plant Physiology,2004,161(11):1225-1234.
[5]Morse N,Walter M T,Osmond D,et al. Roadside soils show low plant available zinc and copper concentrations[J]. Environmental Pollution,2016,209:30-37.
[6]Lange B,Ent A V D,Baker A J M,et al. Copper and cobalt accumulation in plants:a critical assessment of the current state of knowledge[J]. New Phytologist,2017,213(2):537-551.
[7]Nair P M G,Chung I M. Study on the correlation between copper oxide nanoparticles induced growth suppression and enhanced lignification in Indian mustard (Brassica juncea L.)[J]. Ecotoxicology and Environmental Safety,2015,113(4):302-313.
[8]林 泮,那日蘇,徐妍妍,等. 铜胁迫对小麦种子萌发的影响[J]. 天津农业科学,2015,21(11):123-125.
[9]刘 帅,高永光. 铜胁迫下玉米叶绿素质量比与光谱反射率关系[J]. 辽宁工程技术大学学报(自然科学版),2008,30(1):125-128.
[10]盛积贵,李晓梅,窦三丰. 铜胁迫对辣椒种子发芽及其幼苗生长的影响[J]. 北方园艺,2013(7):22-24.
[11]Zhou J T,Wan H X,He J L,et al. Integration of cadmium accumulation,subcellular distribution,and physiological responses to understand cadmium tolerance in apple rootstocks[J]. Frontiers in Plant Science,2017,8:966.
[12]He J L,Ma C F,Ma Y L,et al. Cadmium tolerance in six poplar species[J]. Environmental Science and Pollution Research,2013,20(1):163-174.
[13]Zhou J T,Wan H X,Qin S J,et al. Net cadmium flux and gene expression in relation to differences in cadmium accumulation and translocation in four apple rootstocks[J]. Environmental and Experimental Botany,2016,130:95-105.
[14]He J L,Li H,Ma C F,et al. Overexpression of bacterial gamma-glutamylcysteine synthetase mediates changes in cadmium influx,allocation and detoxification in poplar[J]. New Phytologist,2015,205(1):240-254.
[15]Wang P,Sun X,Li C,et al. Long-term exogenous application of melatonin delays drought-induced leaf senescence in apple[J]. Journal of Pineal Research,2013,54(3):292-302.
[16]Adrees M,Ali S,Rizwan M,et al. The effect of excess copper on growth and physiology of important food crops:a review[J]. Environmental Science and Pollution Research,2015,22(11):8148-8162.
[17]Sharma A,Kapoor D,Wang J,et al. Chromium bioaccumulation and its impacts on plants:an overview[J]. Plants,2020,10(9):1-17.
[18]Liu J J,Wei Z,Li J H. Effects of copper on leaf membrane structure and root activity of maize seedling[J]. Botanical Studies,2014,55(1):1-6.
[19]Zhang J,Zeng L,Sun H,et al. Adversity stress-related responses at physiological attributes,transcriptional and enzymatic levels after exposure to Cu in Lycopersicum esculentm seedlings[J]. Scientia Horticulturae,2017,222:213-220.
[20]黎建玲,梁慧灵,黄肇宇. Cu2+胁迫对南瓜种子萌发和幼苗初期生长的影响[J]. 玉林师范学院学报,2017,38(2):63-69.
[21]韩承华,潘瑞瑞,刘 野,等. Cu、Zn对水蕹菜生长的影响及Se的缓解作用[J]. 生态学杂志,2016,35(2):470-477.
[22]Hippler F W R,Cipriano D O,Boaretto R M,et al. Citrus rootstocks regulate the nutritional status and antioxidant system of trees under copper stress[J]. Environmental and Experimental Botany,2016,130:42-52.
[23]Chen F,Wang F,Wu F B,et al. Modulation of exogenous glutathione in antioxidant defense system against Cd stress in the two barley genotypes differing in Cd tolerance[J]. Plant Physiology and Biochemistry,2010,48(8):663-672.
[24]曾巧英,凌秋平,杨湛端,等. 铜胁迫对甘蔗生长及抗氧化酶活性的影响[J]. 广西植物,2019,39(7):951-958.
[25]高 昆,冀中英. 铜胁迫对粉葛幼苗生长及生理指标的影响[J]. 陕西农业科学,2021,67(10):1-8.
[26]公 勤,車 勇,王 玲,等. 铜处理对菠菜幼苗体内氧化应激反应和矿质元素吸收的影响[J].新疆农业科学,2021,43(11):2111-2121.
[27]Bailey-Serres J,Mittler R. The roles of reactive oxygen species in plant cells[J]. Plant Physiology,2006,141(2):311.
[28]Li L,Zhang K N,Gill R A,et al. Ecotoxicological and interactive effects of copper and chromium on physiochemical,ultrastructural,and molecular profiling in Brassica napus L.[J]. Biomed Research International,2018,130:1-17.
[29]刘 欢,田晓璇,宋 红. 铜胁迫对玉蝉花幼苗生长及生理指标的影响[J]. 北方园艺,2021(10):71-79.
[30]Borisova M M,Kozuleva M A,Rudenko N N,et al. Photosynthetic electron flow to oxygen and diffusion of hydrogen peroxide through the chloroplast envelope via aquaporins[J]. Biochimica et Biophysica Acta-Bioenergetics,2012,1817(8):1314-1321.
[31]Azooz M M,Abou-Elhamd M F,Al-Fredan M A. Biphasic effect ofcopperongrowth,proline,lipidperoxidationandantioxidant enzyme activities of wheat (Triticum aestivum cv. Hasaawi) at early growing stage[J]. Australian Journal of Crop Science,2012,6(4):688-694.
[32]Hamed S M,Selim S,Kloeck G,et al. Sensitivity of two green microalgae to copper stress:growth,oxidative and antioxidants analyses[J]. Ecotoxicology and Environmental Safety,2017,144:19-25.
[33]Vijendra P D,Huchappa K M,Lingappa R,et al. Physiological and biochemical changes in moth bean (Vigna aconitifolia L.) under cadmium stress[J]. Journal of Botany,2016(2):1-13.
[34]蒋 英,郭红伟. 铜胁迫对丝瓜幼苗色素含量、光合特性及渗透调节系统的影响[J]. 天津农业科学,2021,27 (7):9-12.
[35]Foyer,H C,Noctor G. Ascorbate and glutathione:the heart of the redox hub[J]. Plant Physiology,2011,155(1):2-18.
[36]阚世红,刘春香,杨 超,等. 硫酸钠对铜胁迫下生菜幼苗谷胱甘肽及代謝相关酶的影响[J]. 北方园艺,2020(8):44-49.
[37]Sgherri C,Quartacci M F,Navari-Izzo F. Early production of activated oxygen species in root apoplast of wheat following copper excess[J]. Journal of Plant Physiology,2007,164(9):1152-1160.
[38]李晓梅. 铜胁迫对花生种子萌发、幼苗生长和生理特性的影响[J]. 江苏农业科学,2010,38(4):80-82.
[39]周娜娜,武耀廷,高华援,等. 铜胁迫对花生幼苗生长及生理代谢的影响[J]. 东北农业科学,2019,44(6):6-9.

