PLXNA1 在肝癌中高表达并影响患者的生存预后及其免疫微环境
苏莉莉,梁晚晴,吕振宇,韩啸
蚌埠医学院第一附属医院肿瘤科,安徽 蚌埠233000
肝细胞癌(HCC)是癌症相关死亡的第二大原因,其发病率在全球范围内呈上升趋势[1]。尽管手术和局部治疗在世界范围内得到了广泛的应用[2],但估计50%~60%的肝细胞癌患者最终将接受系统治疗[3,4]。由于肝癌具有高度的异质性,具有相似疾病表型的患者可能有不同的分子病因学,从而导致治疗反应不同。因此在分子水平上对患者进行分层将有助于开发更为有效的治疗方案[5]。
丛状蛋白是一种较大的1型跨膜蛋白,通常在其胞外片段中包含十个结构域,一个被预测为螺旋的跨膜区和一个保守的细胞质区域,该区域包含一个带有Rho GTP酶结合结构域的GTP酶激活蛋白(GAP)结构域。根据序列相似性,丛状蛋白被细分为4类(A到D)。A类神经丛蛋白(PLXNA)是特征最明确的,是分泌的3类(SEMA3S)以及跨膜型5类和6 类(SEMA5S 和SEMA6S)信号素的神经元受体[6]。
神经丛素A1(PLXNA1)是丛状蛋白A 家族的成员,其是脑信号导向蛋白3A 和6D(SEMA3A 和SEMA6D)的受体。PLXNA1在神经元的轴突形成、细胞骨架的形成、细胞运动调控和神经细胞的轴突导向与排斥等方面发挥着重要的作用[7],并且与癌细胞的生长调节[8]以及肿瘤侵袭表型相关[9]。研究发现在食管鳞状细胞癌中,PLXNA1下调可以阻断MAPK通路从而影响细胞的增殖、生长及转移[10]。在前列腺癌中,PLXNA1的扩增可以促进癌症的生长[11]并且可以激活下游MAPK 的信号传导[12]。在胶质母细胞瘤中,PLXNA1的高表达会促进其血管的生成[13]。胃癌中,在异丙肾上腺素刺激血管生成因子的分泌下,会引起细胞中PLXNA1和血管内皮生长因子R2的表达上调,从而促进肿瘤血管的生成[14]。在肺癌中,PLXNA1介导了自分泌SEMA3A信号诱导的恶性表型获得[15]。在胰腺癌中,突变的PLXNA1信号与Rho-GTPase和p42/p44 MAPK信号活性和细胞骨架扩张相关,但与E-钙粘蛋白、波形蛋白或金属蛋白酶9表达水平的变化无关[16]。在乳腺癌中,随着癌症的进展,PLXNA1的表达在发生浸润癌时显著降低[17]。在肾透明细胞癌中,通过对TCGA数据库的分析得到PLXNA1可能是独立的预后因子[18]。然而,PLXNA1在肝癌中的作用尚未见研究报道。因此,本研究利用TCGA和ImmPort数据库筛选出在肝癌中高表达的免疫相关基因PLXNA1,并采用qPCR、WB、免疫组化、CCK8、Transwell实验以及生物信息学等方法深入探讨了其对肝癌的生存预后、生物学恶性行为以及免疫微环境所产生的影响。本研究结果表明PLXNA1有望成为HCC诊断、免疫治疗及预后评价的新靶标,可以为肝癌的临床治疗提供一个新的思路。
1 材料和方法
1.1 细胞株与试剂
HL-7702,SMMC-7721细胞均由蚌埠医学院第一附属医院中心实验室保存,分别使用DMEM与1640培养基进行常规培养。PLXNA1 抗体(Affinity:DF12510)。PLXNA1及GAPDH引物来自于上海生物工程有限公司。CCK-8试剂、柠檬酸抗原修复液、内源性过氧化物酶阻断剂、山羊血清(碧云天)。中性树胶(biosharp)。
1.2 组织标本
本实验收集了蚌埠医学院第一附属医院2018年1月~2019年12月收至入院的50例肝癌组织蜡块和48例癌旁组织蜡块。已获得患者及家属知情同意,蚌埠医学院第一附属医院伦理委员会已批准(伦理批准号:2022KY040)。本实验自患者确诊时间至2022年6月截止计算生存时间。
1.3 实验方法
1.3.1 免疫组化 组织蜡块经过切片漂片后,将载有组织的玻片置于65 ℃恒温烤片箱中1~3 h,观察到石蜡基本融化后,将载有组织的玻片置于梯度浓度的二甲苯和乙醇中进行脱蜡,按照1∶10的配比配制柠檬酸抗原修复液,将脱蜡完成的玻片用TBST清洗5 min后放于修复液中,100 ℃修复30 min。完成修复后取出玻片静置恢复至室温,用PBS清洗3次之后加入内源性过氧化物酶阻断剂完全覆盖组织15 min,经PBS清洗3次后加入10%的山羊血清室温封闭30 min,弃去血清后加入一抗至于4 ℃内过夜孵育。孵育完成后取出玻片恢复室温。弃去一抗,TBST 清洗3 次后加入二抗室温孵育30 min,弃去二抗TBST 清洗3 次后加入新鲜配置的DAB显色液,切片变黄时即立即终止。加入苏木素染液13 min,自来水中冲洗10 min,脱水透明后滴加中性树胶进行封片及拍摄。由两位病理科医生进行阅片评分,以染色强度和阳性范围百分比的评分乘积作为染色指数,染色指数≥4则认为PLXNA1高表达,<4则认为PLXNA1低表达。
1.3.2 qRT-PCR 实验 细胞使用Trizol 法提取RNA后,按cDNA 反转录试剂盒说明书的步骤将RNA 反转录为cDNA,使用qPCR 试剂盒通过PCR 仪进行扩增,以GAPDH 为内参检测PLXNA1 的表达,最终Ct值采用2-ΔΔCt方法分析。其中PLXNA1 的引物序列为:Forward primer:ACCCACCTAGTGGTGCATGA,Revise primer:CGGTTAGCGGCATAGTCCA;GAPDH的引物序列为:Forward primer:CACCCACTCCTCCA CCTTTG,Revise primer:CCACCACCCTGTTGCTG TAG。
1.3.3 细胞转染 将细胞按照1.5×105/孔接种于六孔板中,细胞融合达到60%~80%时加入siRNA 与LipofectamineTM2000的混合物到无血清培养基中,孵育6 h后更换为完全培养基,48 h后进行后续实验操作。
1.3.4 CCK-8实验 将转染后的细胞消化离心,加入培养液重悬细胞。以3×103/孔的细胞量加入96孔板中,在细胞贴壁后的24、48、72、96 h时加入10 μL CCK-8试剂继续培养90 min后,用酶标仪检测吸光度A450nm。
1.3.5 Transwell实验 取出转染后的细胞消化离心后加入无血清培养基重悬,以2×104/孔的细胞量,加入小室上层。24孔板中加入完全培养基600 μL,将含有细胞的小室轻轻叠放入24孔板中。继续培养24 h后固染色拍照。
1.3.6 Western blot实验 将转染48 h后的细胞提取蛋白后制备电泳凝胶,蛋白上样后电泳仪以80 V电泳30 min后更换为120V电泳45 min。电泳完成后以200 mA恒流转至PVDF膜后,使用5%的封闭液进行封闭。封闭完成后加入一抗4 ℃过夜。隔天回收一抗,TBST洗膜5 min共3次后加入二抗孵育1 h。孵育完成后,TBST洗膜5 min共3次后加入显影液进行曝光显影。
1.4 统计学分析
采用SPSS24.0软件对实验数据进行统计分析。计量数据均以均数±标准差表示。两组间差异采用t检验,多组间比较采用单因素方差分析及两因素方差分析。计数数据使用校正后的皮尔逊卡方检验。所有实验重复3次,P<0.05时认为差异有统计学意义。
2 结果
2.1 筛选在HCC中高表达并且与患者生存预后相关的免疫基因
使用R 包“DESeq2”筛选来自TCGA 数据库中的HCC组织和正常组织之间存在的差异表达基因,以|log fold change(logFC)|>1 为阈值,其中padj<0.01,得到3146个在肝癌中高表达的基因(图1A)。从ImmPort数据库中得到1793个免疫相关基因。基于以上得到的基因集进行韦恩图分析得到224个在肝癌中高表达的免疫相关基因(DEGs)(图1B)。为了进一步得到在DEG中与生存预后相关的基因,利用R 包“survival”“glmnet”对这224个基因进行单变量COX回归分析得到了44个与预后相关的免疫基因(图2)。通过GEPIA网站以及Kaplan-Meier Plotter网站筛选出在与肝癌患者的生存相关的7个基因(图2),其中logrankP<0.01。
2.2 PLXNA1在肝癌中的表达水平
利用R 包“limma”计算得到:与正常组相比,PLXNA1 的表达量在肝癌组织中较高(P<0.0001,图3A)。qRT-PCR实验结果显示,肝癌细胞SMMC-7721的mRNA相对表达量为4.72±0.50,高于正常肝上皮细胞HL-7702(P<0.01,图3B)。免疫组化实验结果显示,PLXNA1定位于胞浆中,其在人肝癌组织中有40%高表达,但在癌旁组织中仅有2%高表达。PLXNA1在肝癌组织中的表达量高于癌旁组织(χ2=18.720,P<0.001,图3C)。
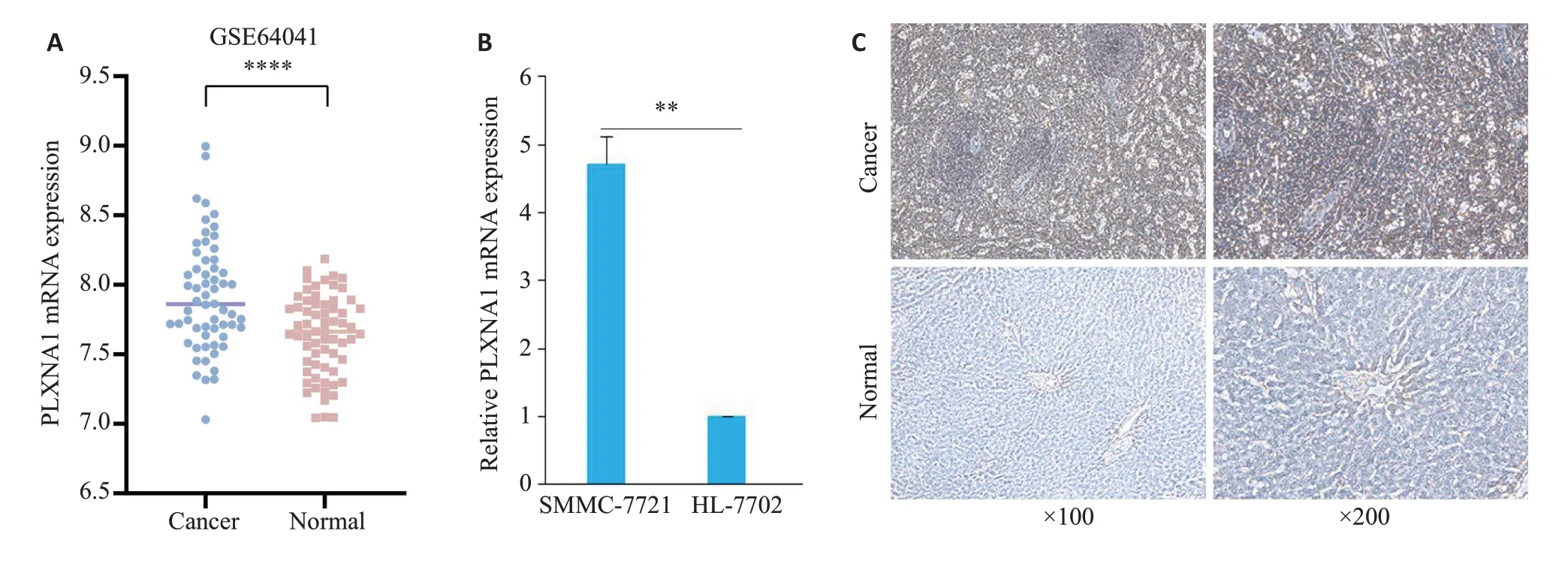
图3 PLXNA1在肝癌中的表达水平Fig.3 PLXNA1 expression levels in hepatocellular carcinoma.A: Expression level of PLXNA1 is higher in HCC than in normal tissue from GSE64041 dataset.****P<0.0001.B:Expression level of PLXNA1 is higher in SMMC-7721 cells than in HL-7702 cells.**P<0.01.C: PLXNA1 expression in hepatocellular carcinoma tissues and paracarcinoma tissues determined by immunohistochemical experiments.
2.3 一致性聚类
从UCSC Xena网站中下载了TCGA-LIHC数据,基于PLXNA1 在其中的表达谱,使用R 包“ConsensusClusterPlus”对样本进行无监督聚类,将样本分为组1:PLXNA1高表达组,组2:PLXNA1低表达组。使用R包“pheatmap”进行可视化(图4A)。
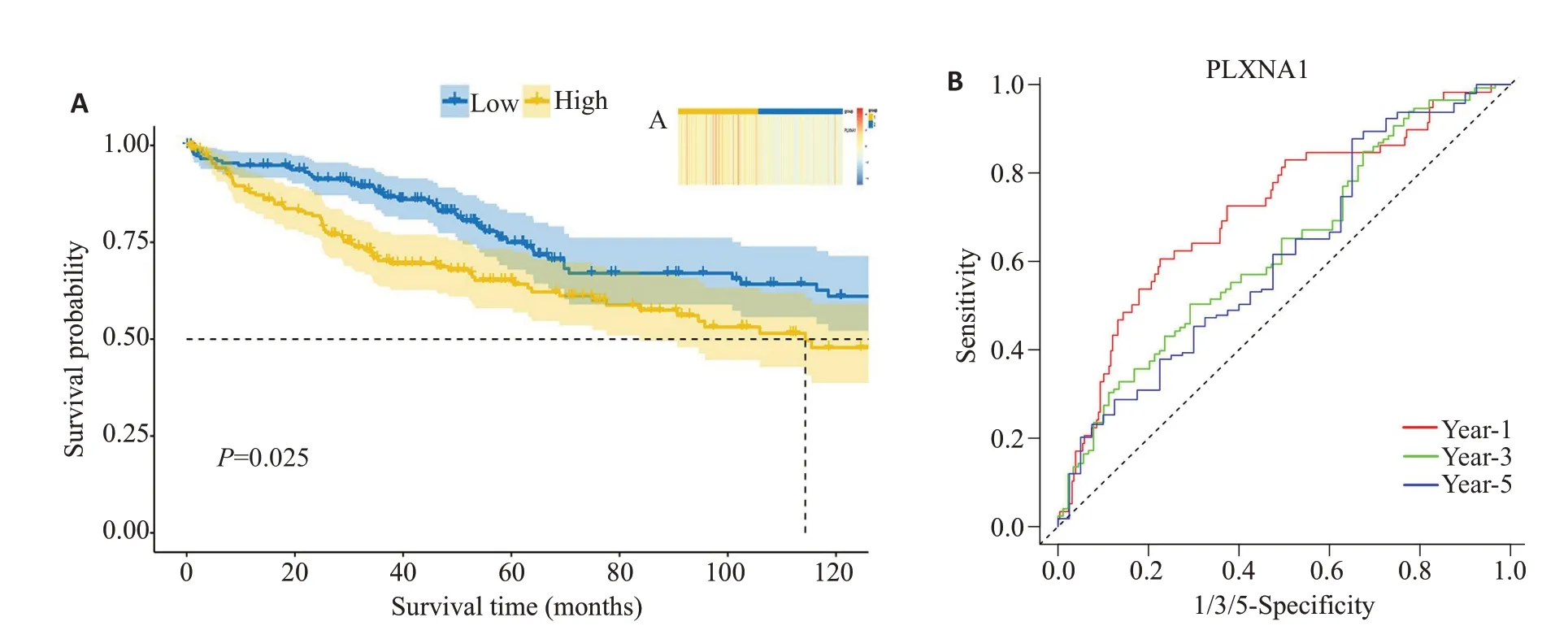
图4 PLXNA1的表达水平与患者生存预后之间的关系,基于TCGA数据库Fig.4 Relationship between PLXNA1 expression levels and HCC patients' survival prognosis based on the TCGA database.A:Unsupervised clustering groups samples in TCGA according to PLXNA1 expression level.B:Kaplan-Meier survival curve of overall survival(OS)for patients stratified by PLXNA1 expression levels based on the TCGA database.C:ROC curve of OS for patients stratified by PLXNA1 expression levels based on the TCGAdatabase.
2.4 PLXNA1的表达与生存预后的关系
从UCSC Xena 数据库中下载TCGA-LIHCsurvival data 数据与HTSeq-FPKM数据,通过R 包“survival”“timeROC”计 算Kaplan-Meier 曲线以 及timeROC曲线得到:PLXNA1高表达时HCC患者生存率较低(Log-rankP=0.025,图4B),timeROC曲线表明PLXNA1对HCC患者短期及长期的生存状态具有较好的预测效果(其中1 年、3 年、5 年的ROC 曲线下面积AUC 分别为0.7139、0.6287、0.6111,图4C)。此外,通过IHC实验检测证实PLXNA1在人肝癌组织中的表达与生存预后的关系,结果显示:高表达PLXNA1的肝癌患者生存较差(Log-rankP=0.0042,HR=4.091,图5A),PLXNA1 可以较好的预测肝癌患者的预后(AUC=0.9346,图5B)。
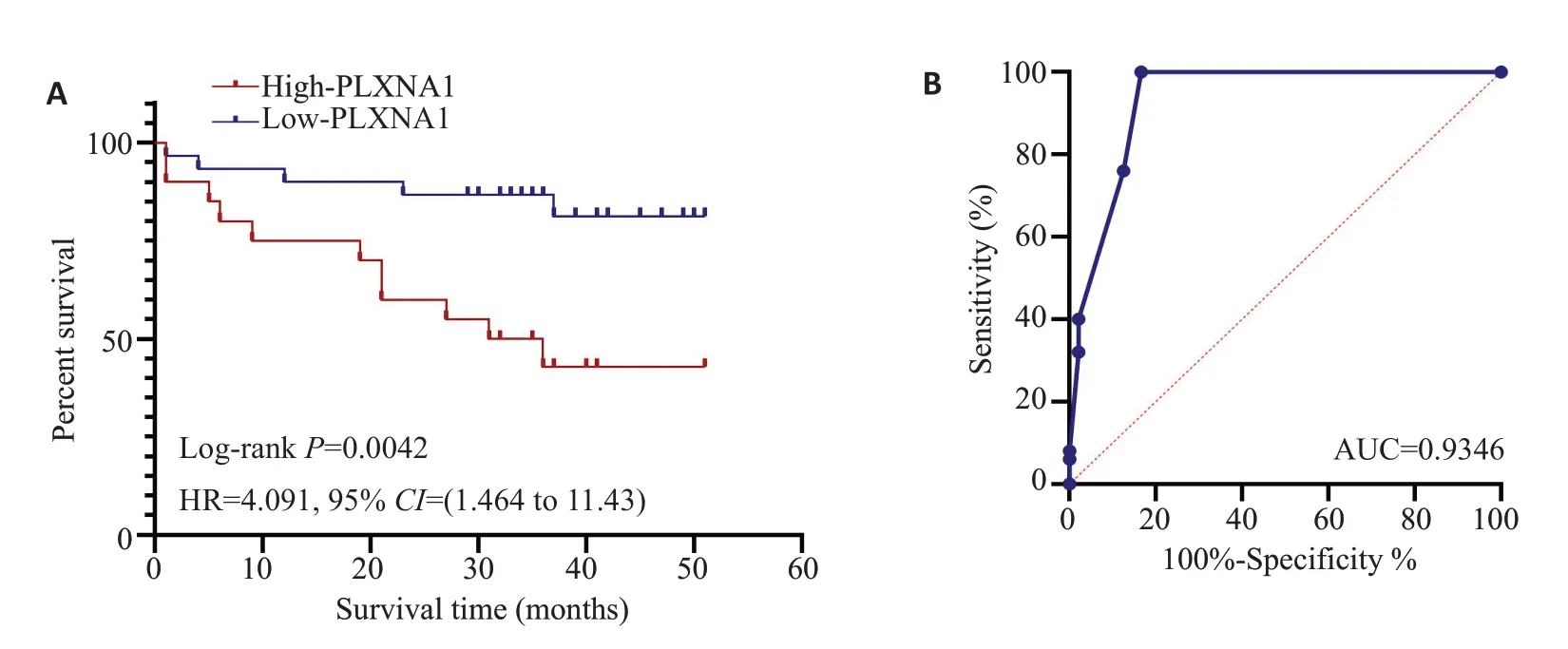
图5 PLXNA1的表达水平与患者生存预后之间的关系(基于IHC实验)Fig.5 Relationship between PLXNA1 expression level and HCC patients'survival based on results of immunohistochemistry.A:Kaplan-Meier survival curve of OS for patients stratified by PLXNA1 expression levels based on immunohistochemistry.B:ROC curve of patients stratified by PLXNA1 expression levels based on immunohistochemistry.
2.5 PLXNA1的表达与临床病理特征之间的关系
利用UALCAN网站计算得到:位于Grade1-4、I-IV期和21~100岁的肝癌患者,PLXNA1的表达水平均高于正常组;淋巴结转移N0期的HCC患者PLXNA1的表达水平较高(P<0.01,图6)。

图6 肝癌中PLXNA1的表达与患者临床病理特征之间的关系Fig.6 Relationship between PLXNA1 expression in HCC and clinicopathologic features of the patients.A: Relationship between tumor grade and PLXNA1 expression level in HCC.B:Relationship between patients'age and PLXNA1 expression level in HCC.C:Relationship between nodal metastasis status and PLXNA1 expression level in HCC.D:Relationship between individual cancer stages and PLXNA1 expression level in HCC.**P<0.01,***P<0.001.
2.6 LIHC中PLXNA1共表达网络的富集分析
在GEPIA网站(包括有TCGA数据库中的369例肝癌组织,50例正常组织)中检索PLXNA1基因,选择“Similar Genes”模块,TCGA tumor选择“LIHC Tumor、TCGA normal选择“LIHC Normal”,Top#similar Genes选择“100”,得到与PLXNA1 共表达的PIP5K1C、METTL9、KCTD10、ARHGAPP1、CBL、MKL1、YEATS2、FBXL19、PRMT2、SLC37A3、MTMR2、ADAM17、TMEM43、TGFBRAP1、PPP1R9B、LIMK1、MAP7D1、BTBD10、PACS1、IQGAP1、TMX2P1、ZNF532”等100 个基因,使用R 包“clusterProfiler”,“org.Hs.eg.db”进行京都基因与基因组百科全书(KEGG)通路富集分析(图7A)和基因本体论(GO)功能富集分析(图7B),数据可视化通过”ggplot2”软件包进行。KEGG和GO富集结果发现PLXNA1与上述共表达的100个基因主要参与的通路和生物学过程有:内吞作用、肌动蛋白细胞骨架的调控、微管结合的调控、细胞生长、非运动纤毛组装的负性调节、细胞底物黏附的调节、底物黏附调控依赖的细胞扩散、表皮生长因子受体信号通路、RAS蛋白信号转导、非活动纤毛组件、ErbB信号通路等。

图7 PLXNA1与其共表达的Top100个基因的KEGG、GO富集分析Fig.7 KEGG(A)and GO(B)enrichment analysis of PLXNA1 with its co-expressed Top 100 genes.
2.7 PLXNA1的表达对SMMC-7721细胞迁移、增殖能力的影响
在SMMC-7721细胞中瞬转了靶向PLXNA1的小干扰RNA及对照序列,通过qRT-PCR实验(图8A)以及Western blot 实验(图8B)验证了si-PLXNA1-1 和si-PLXNA1-2可以有效的敲低PLXNA1在SMMC-7721细胞中的表达量(P<0.01)。转染24~48 h 后进行Transwell实验、CCK-8实验,检测PLXNA1的表达对HCC造成的生物学功能影响。

图8 敲低PLXNA1在SMMC-7721细胞中的表达量后对其增殖、迁移能力的影响Fig.8 Effect of PLXNA1 knockdown on proliferation and migration of SMMC-7721 cells.A:Knockdown effects of si-PLXNA1-1 and si-PLXNA1-2 detected by qRT-PCR.B:Knockdown effects of si-PLXNA1-1 and si-PLXNA1-2 detected by Western blotting.C:Effect of PLXNA1 knockdown on proliferation of SMMC-7721 cells detected by CCK8 assay.D1/D2:Effect of PLXNA1 knockdown on migration ability of SMMC-7721 cells detected by Transwell assay.*P<0.05,**P<0.01,***P<0.001,****P<0.0001 vs si-NC group(crystal violet staining,original specification:×40).
在CCK-8 实验中,si-NC 组的A450 值高于si-PLXNA1-1组和si-PLXNA1-2组(P<0.05,图8C)。在Transwell 实验中,si-NC 组迁移细胞数均高于si-PLXNA1-1组和si-PLXNA1-2组(P<0.01,图8D1/D2)。
2.8 免疫浸润分析
使用TIMER网站预测了PLXNA1表达与免疫浸润细胞:B细胞、中性粒细胞、CD4+T细胞、巨噬细胞、CD8+T 细胞和树突状细胞之间的相关性。利用CiberSort与ssGSEA 算法进一步探究免疫细胞的浸润情况。CiberSort是一种基于基因表达谱算计细胞组成的办法。这种去卷积算法可以用来计算每个HCC患者22个免疫细胞的比例,其中每个样本的22种免疫细胞类型占比之和为1。R包“GSVA”中的单样本基因集富集分析(ssGSEA)是根据已发表的28个免疫细胞基因集中基因的表达水平,计算28种免疫细胞类型的浸润程度。
通过TIMER网站得到:PLXNA1的表达与B细胞、CD8+T细胞、CD4+T细胞、巨噬细胞、中性粒细胞、树突状细胞的浸润程度呈正比(P<0.05,图9A)。通过CIBERSORT算法得到:PLXNA1高表达组中的记忆B细胞、激活的CD4+记忆T细胞、调节性T细胞、M0期的巨噬细胞浸润程度高于低表达组(P<0.05,图9B)。使用ssGSEA算法得到:在PLXNA1高表达组中激活的CD4 T细胞、激活的树突状细胞、中央记忆型CD4 T细胞、效应记忆型CD4 T细胞、γδ T细胞、髓源性抑制细胞、自然杀伤T细胞、浆细胞样树突状细胞、调节性T细胞、滤泡辅助性T细胞的浸润程度高于PLXNA1低表达组(P<0.05,图9C)。

图9 PLXNA1的表达与免疫细胞浸润程度之间的关系Fig.9 Relationship between PLXNA1 expression and immune cell infiltration in HCC.A:Correlation of PLXNA1 expression with immune-infiltrating cells predicted by GEPIA website.B,C: Relationship between PLXNA1 expression and the degree of immune cell infiltration obtained by CIBERSORT and ssGSEA algorithms based on TCGAdatabase(P<0.05).
3 讨论
由于肝癌往往在晚期被发现,手术切除肿瘤后的复发率较高,肝移植的成功率较低,并且患者在治疗期间易产生耐药和频繁的复发转移,因此肝癌成为了预后最差的肿瘤之一[19,20]。在肿瘤的微环境中,癌症细胞和宿主免疫反应的相互作用可以促进或抑制癌症的病理进展[21]。肝脏的免疫微环境主要由免疫抑制细胞和信号主导,这些细胞和信号促进了自然的、生理上必要的耐受性生态位[22]。在肝癌免疫逃逸中具有免疫抑制作用的关键细胞包括组织残留巨噬细胞(主要是Kupffer细胞)[23]以及单核细胞来源的巨噬细胞、调节性T(Treg)细胞[24,25]和髓系来源的抑制细胞(MDSCs)[22]。近年来,肿瘤免疫抑制治疗等新的治疗策略延长了患者的生命,免疫检查点抑制剂(ICI)和血管内皮生长因子(VEGF)抑制剂的联合治疗已成为晚期肝癌的一线治疗方法[20]。免疫治疗在肝细胞癌的发展中起着至关重要的作用。
本研究通过TCGA数据库和ImmPort数据库筛选出了在HCC 中高表达的免疫相关基因,利用单变量COX回归和GEPIA、Kaplan-Meier Plotter网站对这些基因进行生存分析得到了CXCL5、S100A10、BIRC5、CKLF、PLXNA1、SPP1、STC2七个与HCC患者生存率显著相关的基因。神经丛状蛋白(PLXNS)是具有不同特异性和多功能的跨膜受体,其包括丛状蛋白A-D的四个亚家族中的九个成员。它们参与了细胞的运动和黏附、新生血管和器官形成,以及癌症的进展[26,27]。此外,已有研究发现一些丛状蛋白可以通过调节免疫细胞的激活、分化和迁移来影响免疫功能[28]。例如,已有研究发现PLXNA1参与了树突状细胞(DC)激活T细胞的过程[29]。PLXNB1已被证明其可以影响肿瘤相关巨噬细胞的迁移能力以及诱导肿瘤血管生成的能力[30]。当PLXND1 与其配体结合时,树突状细胞上表达的PLXND1可以促进抑制趋化因子诱导的迁移[31]。其中,PLXNA1 是SEMA3A 受体,已有研究报道其在胰腺癌[8]、前列腺癌[11]中高表达,在乳腺癌中具有潜在的肿瘤抑制活性[17]。我们通过GSE64041 数据集、SMMC-7721细胞、人HCC组织验证了PLXNA1在HCC中的表达情况。通过TCGA数据库分析得到:在PLXNA1高表达时,HCC患者生存率较低;timeROC曲线分析得到PLXNA1对HCC的长期及短期预后均有较好的预测效果,并且通过IHC实验验证了以上结果。PLXNA1在前列腺癌[11]、胰腺癌[8]、胶质母细胞瘤[13]中的高表达水平与患者生存率较差显著相关,PLXNA1是影响肾透明细胞癌患者总生存期的独立预后因素[18]。UALCAN网站分析得到PLXNA1的表达与HCC的肿瘤分级、临床分期、淋巴结N0期转移、年龄因素显著相关。GO富集分析显示PLXNA1在HCC中的共表达基因主要集中于细胞生长、细胞-底物黏附的调节等功能,KEGG通路富集分析主要在肌动蛋白细胞骨架的调控等通路上显著。Yamada等[15]研究证实PLXNA1在肺癌中的表达可以正向调节细胞的增殖和糖酵解过程,SEMA3A信号通过调节PLXNA1 的表达影响细胞对EGFR-TKI的抗性。通过Wang等[10]的研究发现:在食管鳞癌中,miR-134可以通过下调PLXNA1来阻断MAPK信号通路。Li等[18]通过生物信息学方法得到PLXNA1可以通过多种癌症相关信号通路、肿瘤免疫和血管生成促进肾细胞癌进展。Zhao等[14]发现异丙肾上腺素等应激信号可以通过激活胃癌中的PLXNA1/VEGFR2信号通路来增强血管生成及肿瘤的生长。因此我们利用Transwell、CCK-8实验探究了PLXNA1的表达对HCC细胞的迁移和增殖能力的影响,实验得到敲低PLXNA1在HCC中的表达会抑制细胞的增殖以及迁移能力。通过利用R包分析TCGA数据库以及TIMER网站我们得到:PLXNA1的表达与免疫细胞浸润程度均呈正比。然后进一步通过CIBERSORT和ssGSEA算法计算肿瘤组织中各类免疫细胞浸润的程度,并进行相关性分析发现:PLXNA1的表达可以显著影响调节性T细胞、髓源性抑制细胞等免疫细胞的浸润程度。
综上所述,本研究通过生信分析筛选出在HCC中高表达并且与生存预后相关的免疫基因PLXNA1,其可能通过调节HCC周围免疫细胞的浸润程度来抑制免疫反应,加速了HCC的生长及发展。本研究为HCC的临床诊断、生存预后以及免疫治疗提供了一个新的依据和方向,然而PLXNA1在HCC免疫微环境中产生的作用还需进一步进行体内外的验证,PLXNA1调控HCC细胞增殖迁移的分子机制仍需进一步深入研究。