肌肽对糖尿病肾病大鼠肾组织AKT/mTOR通路及自噬的影响
任 毅,卢金莹,于露,李宗泽,王高,杨菁
锦州医科大学基础医学院生物化学与分子生物学教研室,辽宁 锦州121001
糖尿病肾脏疾病(DKD)是糖尿病的常见并发症,其发病人数占全球糖尿病患者的20%~40%[1],已成为终末期肾病的第一病因[2,3]。DKD患者在中国的住院率从2010年的3.58%上升到2017年的4.95%,上升趋势明显[4],同时DKD患者发生不良心血管病、感染和死亡的风险明显升高,给患者及家庭带来巨大经济和精神压力[5]。DKD发病机制十分复杂,现研究主要聚焦在氧化应激、炎症和自噬等方面[3,6]。DKD治疗方法有限,主要通过控制血压和血糖,降低白蛋白尿来延缓DKD的进展,但效果并不理想[7-9]。因此广泛探索DKD发病机制,并在此基础上开展相关药物研究显得尤为迫切[8-10]。
肌肽是一种天然的、广泛存在于各种脏器的水溶性内源性二肽,具有抗氧化应激、抗炎、抑制蛋白质非酶糖基化等诸多生理功能[11-13]。本团队前期研究表明,肌肽对DKD大鼠具有保护作用,其机制可能与其抑制氧化应激和NF-κB 信号通路异常激活有关[14]。但肌肽对DKD大鼠Akt/mTOR信号通路及自噬的影响却未见报道。本实验利用高糖高脂饲料喂养结合STZ腹腔注射制备糖尿病(DM)大鼠模型,通过观察大鼠的体质量和血糖的变化,比较血肌酐(Scr)、尿蛋白、24 h尿量及组织学变化,探讨肌肽对DKD的保护作用,同时进一步观察肾脏组织中AKT、mTOR、LC3、p62蛋白表达的趋势变化,探讨肌肽的作用机制,为DKD的治疗提供理论依据。
1 材料和方法
1.1 实验动物
70只健康雄性SD大鼠,体质量150~160 g,购自辽宁长生生物技术股份有限公司。实验动物合格证号:SCXK(辽)2020-0001。动物饲养室温度22±2 ℃,湿度(55±2)%。动物实验通过锦州医科大学伦理学审批(No.2022032101)。
1.2 主要试剂和仪器
肌肽,纯度99.9%以上(苏州富士莱医药);高糖高脂饲料、普通饲料(北京博爱港生物技术);链脲佐菌素(Sigma);Akt、p-AKT、mTOR、p-mTOR、LC3、p62、βactin抗体(武汉爱博泰克生物科技);HE染色试剂盒、SOD、MDA试剂盒、BCA试剂盒(北京索莱宝科技);肌酐和尿蛋白定量试剂盒(南京建成生物)。显影液、RIPA裂解液(沈阳万类生物);快速制胶试剂盒(苏州新赛美生物科技)。倒置显微镜(Olympus);石蜡切片机,德国莱卡;电泳仪、凝胶成像仪、转膜机(Bio-Rad)。MK3酶标分析仪(上海赛默飞世尔)。
1.3 实验方法
1.3.1 动物分组和大鼠DM模型建立 将70只大鼠适应性喂养1周后随机分为对照组(CON,n=14)和高糖高脂组(n=56)。CON组普通饲料喂养,高糖高脂组高糖高脂饲料喂养。高糖高脂喂养4周后禁食不禁水12 h,一次性注射30 mg/kg STZ,72 h后Onetouch血糖仪测血糖,共有51只大鼠血糖≥16.7 mmol/L,视为造模成功。将造模成功大鼠随机进一步分为DM组(n=12只)及肌肽低(Car-L,n=13)、中(Car-M,n=13)、高剂量组(Car-H,n=13),各组分别按照每日0 mg/kg、100 mg/kg、300 mg/kg和900 mg/kg肌肽灌胃,各组依然高糖高脂饲料喂养继续喂养12周直到取材。
1.3.2 样本采集 饲养大鼠期间,7 d/次测定体质量,定期测量血糖值。实验结束前,收集24 h尿液。收集血清后,处死大鼠后取肾脏,一侧肾脏储存于-80℃冰箱中,另一侧肾脏擦干水分放入10%多聚甲醛中进行固定。
1.3.3 血肌酐(Scr)、24 h尿蛋白含量测定 随机取8个样品,采用肌氨酸氧化酶法测定血肌酐。CBB法,测定尿蛋白。具体按试剂盒说明书操作。
1.3.4 HE染色检测大鼠肾脏组织病理形态变化 将浸泡在4%多聚甲醛中进行固定的肾组织取出,经过脱水、二甲苯透明后进行液体石蜡包埋,等待石蜡冷却至室温后进行修剪蜡块、制作切片,石蜡切片厚度约为4 μm。将准备进行染色的蜡块进行二甲苯常规脱蜡和梯度酒精水化后,进行染色。染色后的切片经梯度乙醇脱水,二甲苯透明,中性树胶封片。光学显微镜观察并拍照。
1.3.5 试剂盒检测大鼠肾脏组织SOD、MDA 严格按照说明书操作,随机取冻存8个肾脏组织,破碎后取上清液,记录实验数据;将数据按照公式进行计算,检测大鼠肾脏组织SOD活性、MDA含量。
1.3.6 Western blot 检测大鼠肾脏组织中T-AKT、p-AKT、T-mTOR、p-mTOR、p62、LC3蛋白的表达 取冻存肾脏组织,提取蛋白,测定浓度,经SDS-PAGE凝胶电泳、转膜、封闭后分别用T-AKT、p-AKT、T-mTOR、pmTOR、p62、LC3、β-actin抗体孵育过夜,洗膜后加入二抗,ECL成像。Image J 软件分析并计算相应的蛋白条带与β-actin的灰度比值。
1.4 统计学处理
运用SPSS 20.0软件对数据进行处理,实验数据以均数±标准差表示,组间比较采用单因素方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 肌肽对DM大鼠状态、血糖和体质量的影响
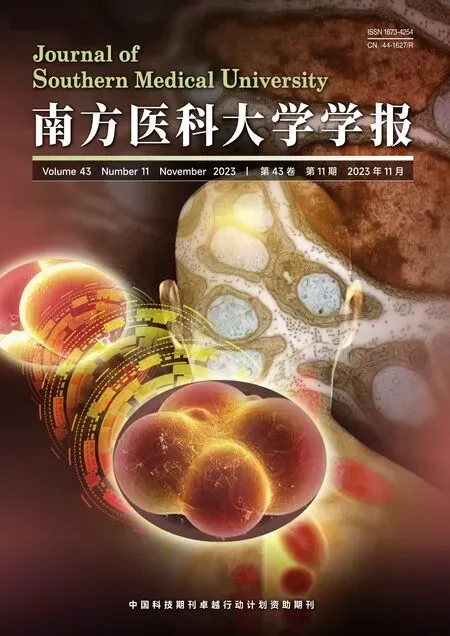
实验结果显示,与CON组相比,DM组大鼠的反应较为迟钝、不喜运动、弓背卷体、多饮多尿明显、毛色发黄光泽差。与DM组相比,Car各组大鼠毛发清洁程度有改善,精神状态恢复。与CON组相比,DM组注射STZ后血糖水平显著升高,体质量显著降低,该趋势一直维持到实验结束,差异有统计学意义(P<0.01)。与DM组相比,Car各组血糖略有下降,体质量升高,但只有Car-H组体质量具有统计学意义(P<0.05,图1)。
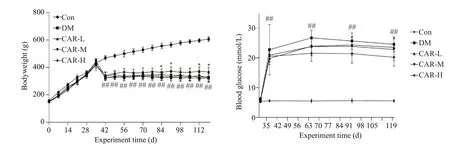
图1 肌肽对DM大鼠血糖和体质量的影响Fig.1 Effects of carnosine on blood glucose and body weight of the diabetic rats(Mean±SD,n=12-14).##P<0.01 vs CON group;*P<0.05 vs DM group.
2.2 肌肽对DM大鼠Scr、尿蛋白、24h尿量和肾脏质量的影响
与CON 组相比,DM 组的大鼠Scr、尿蛋白含量、24 h尿量和肾脏质量均有所升高(P<0.01)。与DM组相比,CAR-M和Car-H组大鼠的尿蛋白含量、24 h尿量均显著降低(P<0.05),肾脏质量与Scr下降有下降趋势,但差异无统计学意义(图2)。
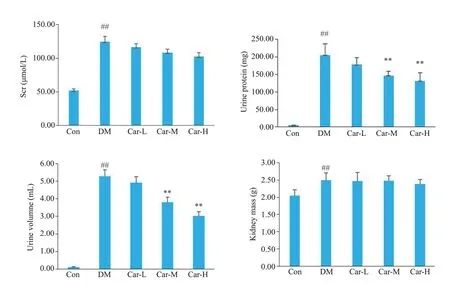
图2 肌肽对DM大鼠的生理指标的影响Fig.2 Effect of carnosine on renal indexes of DM rats(Mean±SD,n=8-14).##P<0.01 vs CON group;**P<0.01 vs DM group.
2.3 肌肽对DM大鼠肾脏组织形态的影响
CON组大鼠肾脏细胞均匀分布,肾小球形态圆润饱满,肾小管结构正常,基底膜系膜形态规则无增生。DM组大鼠肾脏组织细胞紊乱,肾小球肿胀变形,形状不规则,伴随基底膜增厚,系膜增生,肾小管出现狭窄现象。CAR组肾小球内系膜增生和基底膜增厚程度略有降低,肾小球形状逐渐圆润规整,空泡状肾小管上皮细胞有所恢复,尤其以高浓度组效果更佳(图3)。
图3 各组大鼠的肾脏HE染色结果Fig.3 HE staining of renal tissue in each group(Original magnification:×400).A:CON group.B:DM group.C:Car-L group.D:Car-M group.E:Car-H group.
2.4 肌肽对DM大鼠肾脏组织SOD和MDA的影响
与CON组相比,DM组的大鼠的肾脏组织SOD活性下降,MDA含量上升(P<0.05)。与DM组相比,Car各组大鼠肾脏组织中的SOD含量上升,MDA含量下降(P<0.05),并且呈现剂量依赖性(图4)。

图4 肌肽对DM大鼠肾脏中氧化应激的影响Fig.4 Effect of carnosine on SOD activity and MDA content in the kidney of the rats with DM.##P<0.01 vs CON group;**P<0.01 vs DM group.
2.5 肌肽对DM大鼠肾脏组织AKT、mTOR、P-AKT、pmTOR、LC3 I、LC3 II、p62的影响
与CON组相比较,DM组的大鼠肾脏组织中AKT和mTOR 蛋白总量无明显差异,但p-AKT/AKT、pmTOR/mTOR的比值明显降低(P<0.05),p62蛋白表达及LC3-II/LC3-I比值明显升高(P<0.01)。与DM组进行比较,Car各组p-AKT/AKT与p-mTOR/mTOR比值均有所上升,p62蛋白表达及LC3-II/LC3-I比值均下降,尤其以Car-M和Car-H组更明显(P<0.01,图5)。

图5 Western blot检测AKT、mTOR、P-AKT、p-mTOR、LC3、p62蛋白的表达水平Fig.5 Renal expression of AKT,mTOR,P-AKT,LC3,and p62 proteins in the rats detected by Western blotting.A:Representative image of AKT,mTOR,P-AKT,LC3,p62 proteins detected by Western blots.B:The ratio of p-AKT/AKT protein expression.C:The ratio of p-mTOR/mTOR protein expression.D: The ratio of LC3 II/I protein expression.E: Relative expressions of P62 protein.##P<0.01 vs CON group;**P<0.01 vs DM group.
3 讨论
DKD是目前糖尿病最为常见也是最为严重的一种慢性微血管并发症,30%~40%的糖尿病患者会发展成DKD。采用高糖高脂饲养同时配合STZ腹腔注射建立了DM大鼠模型,实验结果表明,与CON组相比较,DM组的大鼠体质量明显的减轻(P<0.05)、血糖、Scr、尿蛋白及24 h尿量升高明显(P<0.05),肾小球出现基底膜增生、系膜增厚和肾小球肿胀变形等,说明DKD模型制备成功,与文献报道一致[15]。与DM组相比,肌肽各组可见以上各指标不同程度的减轻,其中肌肽高剂量组的效果最为明显,说明肌肽对DM肾脏病变具有保护作用。
血糖升高可产生过量自由基,同时清除能力下降,其导致的氧化应激失衡在DKD 中起重要作用[16,17]。SOD的主要功能是清除体内产生的氧自由基。MDA是脂质发生过氧化反应最终产物,其含量可以反映机体过氧化的程度,是常用的过氧化损伤的指标。实验结果显示,与CON组相比,DM组的大鼠血清中SOD活性下降,MDA含量上升,说明DM组大鼠氧化应激损伤明显。灌胃肌肽后,肌肽提高DM组大鼠SOD活性及降低MDA含量,因此推断肌肽可通过提升大鼠机体的抗氧化能力,从而对DM肾脏病变产生保护作用。
氧化应激与AKT/mTOR 途径密切相关[18,19],而AKT/mTOR 途径又在DKD 中发挥重要作用[20,21]。AKT的苏氨酸和丝氨酸残基发生磷酸化后,直接或间接通过结节性硬化复合体激活mTOR 蛋白,调节下游效应分子S6K1 和4E-BP1的表达,从而调节细胞的增殖、分化、凋亡和自噬等生理活动[18,22]。在肾脏中,mTOR活性的生理水平是支持肾细胞生长和分化、维持肾细胞完整性和正常肾单位功能,包括电解质、水和葡萄糖的运输所必需的,其活性失调会导致肾脏疾病[21]。结果显示,与CON 组相比,DM 组p-AKT/AKT 和pmTOR/mTOR比值降低,与文献结果一致[23]。同时也应该注意到不同种属、模型制备方法和时间不同的DM模型,p-AKT/AKT和p-mTOR/mTOR比值的变化趋势并不一致[24,25],具体原因仍需进一步研究。灌胃肌肽后p-AKT/AKT和p-mTOR/mTOR比值升高,而以高浓度肌肽效果更明显,推测肌肽可通过激活AKT/mTOR途径发挥其保护作用。
Akt/mTOR信号通路对自噬过程具有重要调节作用[26,27],可以抑制自噬体的合成[28,29]。自噬是一种高度保守的溶酶体降解途径,对于维持细胞的稳态发挥重要作用[30],其调节失控在DKD的进展中起着重要作用[6,31,32]。微管相关轻链蛋白3(LC3)是一种可溶性蛋白质,通过对其C末端切割产生LC3-I,进一步与磷脂酰乙醇胺结合产生LC3-II。LC3-II反映细胞自噬体相对数量,可作为自噬活性和DKD 进展的标志物[33]。P62是自噬受体蛋白,与可作为自噬降解指标,与自噬活性呈负相关。本实验结果显示,与CON组相比,DM组p62蛋白表达及LC3-II/I比值明显均明显升高(P<0.05),而肌肽灌胃后,随着肌肽浓度增加,p62蛋白表达及LC3-II/I比值逐渐降低,以上结果说明DM大鼠肾脏自噬过程受到干扰,而肌肽可以调节DM大鼠自噬恢复正常。
综上所述,肌肽可通过激活AKT/mTOR 信号通路,改善自噬发挥对DM肾脏病变的保护作用。