基于HMGCR 及PPARα信号通路探究雪莲果浸膏对高脂血症大鼠脂质代谢的影响
龚顺航,杨杰,张金涛,吴兴林,江山,张誉麟,龚广斌,吴宁,孙见飞,吴遵秋
贵州医科大学基础医学院化学与生物化学实验室,贵州 贵阳550025
高脂血症(HLP)是机体脂质代谢紊乱、脂肪转运异常引起的代谢性疾病,表现为血清中的总甘油三酯(TG)、总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)水平过高或高密度脂蛋白胆固醇(HDL-C)水平过低[1],由于起病缓慢、隐匿,难以早发现、早干预、早治疗,易导致动脉粥样硬化、心脑血管疾病等[2,3]。目前,治疗高脂血症的药物主要是他汀类和贝特类,但长期服用会导致横纹肌溶解,肝肾功能损害等严重不良反应[4]。中药治疗高脂血症疗效显著且无明显机体损害,在血脂代谢异常方面的调控作用越来越突出,逐渐成为新的研究热点。
研究表明,雪莲果(Yacon)具有降血脂、降血糖、抗氧化等作用,但其药理学研究甚少[5,6]。研究发现雪莲果中糖类成分对高脂饮食所致小鼠血脂升高有明显抑制作用[7]。一定剂量的雪莲果汁能上调大鼠肝脏组织中腺苷酸活化蛋白激酶mRNA 和蛋白质表达,下调乙酰辅酶A 羧化酶mRNA和蛋白质表达,从而达到降脂作用[8]。本课题组研究发现Yacon浸膏能抑制大鼠胰腺中胰脂肪酶、辅脂酶的合成,减少大鼠肠道对小分子脂质的外源性吸收[9]。虽然近几年基于雪莲果叶和块根的研究逐渐深入,但对于雪莲果如何纠正脂代谢异常的具体机制尚未见文献报道。而过氧化物酶增殖物激活受体α(PPARα)已被证实参与脂质代谢的各个方面,包括脂肪摄取、转运、合成、线粒体氧化等[10];3-羟基-3-甲基戊二酰辅酶A还原酶(HMGCR)是催化胆固醇合成步骤中的关键限速酶,逐渐成为治疗肥胖、高脂血症等代谢性疾病的研究重点[11]。故本课题组通过建立高脂血症大鼠模型,观察肝脏系数、肝脏病理、血脂水平变化以及肝组织中HMGCR、PPARα及其下游分子mRNA和蛋白的表达,探究Yacon浸膏影响高脂血症大鼠脂质代谢的分子机制,为中医药治疗肥胖、高脂血症等代谢性疾病提供实验数据和新的方向,也为“药食同源”果类的开发提供一定理论依据。
1 材料和方法
1.1 实验动物
实验动物:60只7周龄雄性SD大鼠,洁净级,体质量为180~220 g,由贵州医科大学实验动物中心提供,实验设施合格证编号:[SYXF(黔)2018-0001],环境温度22±2 ℃,相对湿度(55±15)%,正常光照12 h,自由摄食饮水。高脂饲料由重庆腾鑫生物技术有限公司提供,主要成分:普通饲料(72.8%)、猪油(15%)、蔗糖(10%)、胆固醇(2%)及三号胆盐(0.2%)。
1.2 伦理审查
本动物实验方案获得贵州医科大学实验动物伦理委员会审核(NO.1900041)。
1.3 药物及试剂
总甘油三酯(TG)、总胆固醇(TC)试剂盒(深圳子科生物科技有限公司);低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)试剂盒(安徽巧伊生物科技有限公司);一抗HMGCR、PPARα、β-actin(Bioworld);CYP7A1、CPT-1(Baijia);二抗(Bioworld);超敏ECL化学发光试剂盒(上海碧云天生物技术有限公司);PCR逆转录试剂盒(南京诺唯赞生物科技有限公司);Yacon种类:云南天山Yacon;非诺贝特片(0.1 g/片,信宜万象药业)。
1.4 主要仪器
ABI StepOnePlus™实时荧光定量PCR仪(Thermo Fisher),AceQ qPCR SYBR Green Master Mix,由Vazyme Biotech Co.Ltd.提供,Trizol由Invitrogen提供,PrimeScriptRT reagent Kit with gDNA Eraser(Perfect Real Time),购于TaKaRa Biomedical Technology(Beijing)。全功能酶标仪(美国伯乐公司);4 ℃低温高速离心机(Thermo Fisher);凝胶成像系统(Synoptics);DYY-5型稳压稳流电泳仪(北京六一仪器厂)。
1.5 动物分组及高脂模型的建立
60只SD大鼠适应性喂养7 d后,随机数表法分为空白组(10只)和高脂模型组(50只),空白组(Normal)用基础饲料喂养,高脂模型组采用高脂饲料造模喂养8 周,尾静脉取血,分离血清进行TG、TC水平检测,随后按照体质量梯度分为:Yacon浸膏高剂量组(Yacon 5 g/kg)、浸膏中剂量组(Yacon 2.5 g/kg)、浸膏低剂量组(Yacon 1.25 g/kg),非诺贝特阳性对照组(Fenofibrate)、模型组(Model),10只/组,每周固定时间测量并记录各组大鼠体质量变化并定量调整用药情况。(本文后续以FEN组、Mod组、Normal组分别简称阳性对照组、模型组、空白组)。
1.6 Yacon浸膏的制备
取2.5 kg新鲜Yacon,洗净、切片、漂洗0.5 h,于电磁炉连续浸提3次,1 h/次,合并浸提液,收集滤液后,经蒸发、浓缩、干燥、分装、灭菌等步骤后,保存至4 ℃冰箱,实验时备用。
1.7 给药方案
Yacon浸膏高、中、低剂量组分别以5、2.5、1.25 g/kg剂量给药(按生药量计)[9],加蒸馏水稀释至4.5 mL进行灌胃,1次/d,持续8周,给药剂量参考人与大鼠之间体表面积折算方法,最终基于前期优选实验结果确定;FEN组以每天27 mg/kg的剂量进行灌胃(人的每日临床用量300 mg/d,大鼠非诺贝特等效剂量=300×0.018×5=27 mg/kg)[12],Normal组和Mod组每天定时用等量生理盐水灌胃1次,连续给药8周。
1.8 标本采集
末次给药后各组大鼠禁食不禁水12 h,称重后腹腔注射水合氯醛溶液(3 mL/kg)麻醉,腹主动脉取血5 mL,4 ℃静置后3000 r/min离心10 min,血清分离后分装于无菌EP管内,-20 ℃冷藏以备后期生化检测。大鼠颈椎脱臼法处死,解剖取肝脏组织,去除脏器周围结缔组织,生理盐水洗净后滤纸吸尽表面液体,置于电子天平上称重并记录,组织分为两部分,一部分于4%多聚甲醛溶液中固定;另一部分置于-80 ℃低温冰箱内储存备用。
1.9 测定肝脏系数
大鼠肝脏完整取出后生理盐水洗净并用滤纸吸干液体成分,于电子天平上称重并记录脏器湿重数值,计算脏器系数。计算公式如下:
1.10 ELISA 法检测血清中TG、TC、LDL-C、HDL-C水平
根据ELISA试剂盒说明书步骤测定各组大鼠血清中TG、TC、LDL-C、HDL-C水平含量。
1.11 肝脏组织病理学观察
大鼠麻醉后充分暴露肝脏,观察脂肪附着、质地软硬等;另取4%多聚甲醛已固定的肝脏,经脱水、石蜡包埋、切片(厚度4 μm)后,进行HE染色,中性树脂封片,光学显微镜下观察各组大鼠肝脏组织病理变化并采集图像。
1.12 qPCR检测肝脏组织中HMGCR、PPARα、CYP7A1、CPT-1 mRNA表达水平
将实验器材进行高压蒸汽灭菌,Trizol法提取大鼠肝脏组织总RNA,实验样本RNA溶解于DEPC水,检测其纯度后保存于-80 ℃的冰箱。逆转录后合成cDNA,各引物序列见表1。按照试剂盒的说明书进行qPCR反应,按以下条件进行基因扩增:95 ℃预变性5 min,循环1 次;95 ℃10 s,60 ℃30 s,共循环40 次;95 ℃15 s,60 ℃60 s,95 ℃15 s,溶解曲线分析。
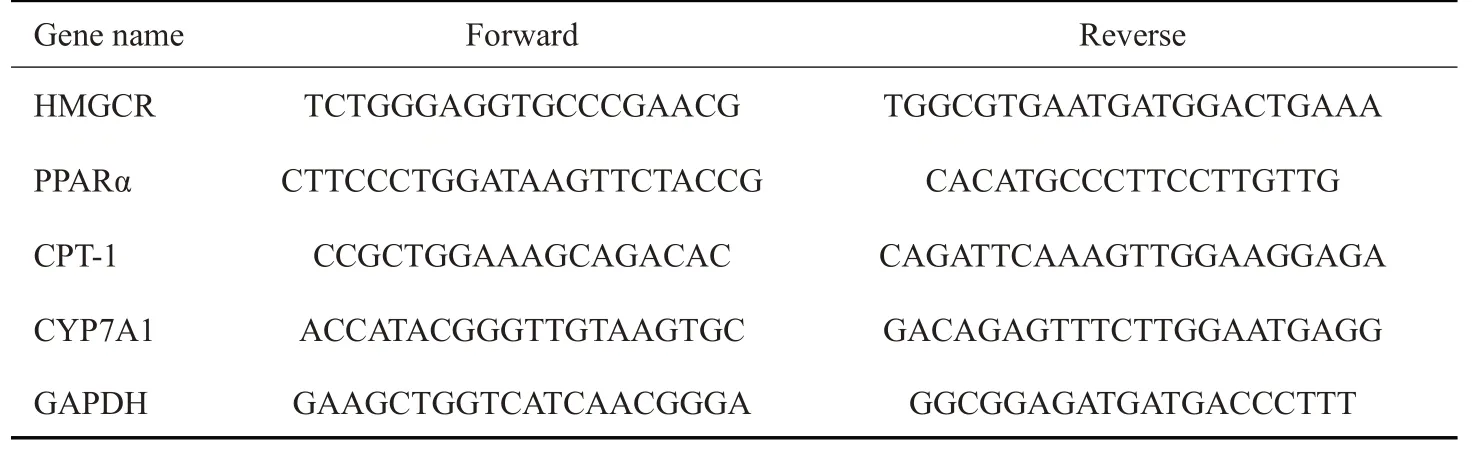
表1 各基因的引物序列Tab.1 Oligonucleotide primers used for real-time PCR
1.13 Western blot法检测肝脏组织中HMGCR、PPARα、CYP7A1、CPT-1蛋白表达水平
取20 mg肝脏组织于200 μL裂解液提取总蛋白,BCA法检测蛋白浓度,配置分离胶和浓缩胶后,用SDSPAGE样品缓冲液1∶4稀释样品,95 ℃加热变性5 min。20 μL上样量电泳分离,目的蛋白转膜,该膜为聚偏二氟乙烯膜(PVDF)。5%的TBST脱脂奶粉封闭,加入一抗后4 ℃冰孵育1晚。再洗膜3次,用辣根过氧化物酶标记二抗,摇动60 min。用ECL混合液浸湿PVDF膜后通过凝胶成像系统显影、定影、分析,得出其相对表达量。
1.14 统计学分析
采用SPSS 22.0 软件进行分析,正态分布计量资料采用均数±标准差表示,两组间比较采用t检验,两两比较采用SNK(Student-Newman-Keuls)法。检验水准α=0.05,P<0.05时认为差异具有统计学意义,所有实验均独立重复3次。
2 结果
2.1 Yacon浸膏对高脂血症大鼠体质量和肝脏系数的影响
造模结束后(第8周),与Normal组相比,Mod组大鼠体质量升高(P<0.05),出现脂肪异常蓄积的情况;与Mod组相比,各剂量组体质量无显著性差异(P>0.05)。给药结束后(第16周),与Normal组相比,Mod组大鼠体质量、肝脏系数显著升高(P<0.05),脂肪异常蓄积更为严重;与Mod组相比,FEN组、Yacon 5 g/kg组、Yacon 2.5 g/kg组体质量增加、肝脏系数均降低(P<0.05,图1、表2)。
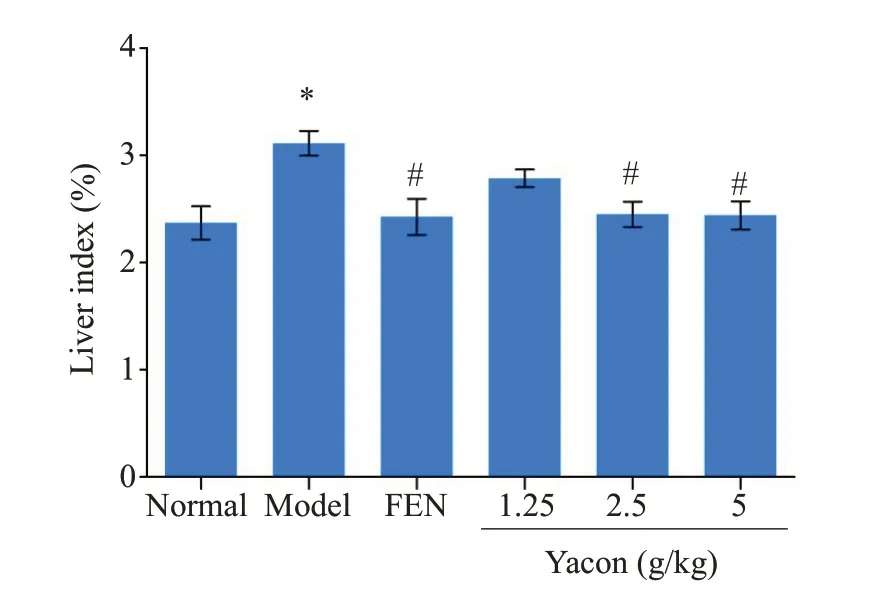
图1 Yacon浸膏对高脂血症大鼠肝脏系数的影响Fig.1 Effect of yacon root extract on liver index of hyperlipidemic rats.*P<0.05 vs Normal group;#P<0.05 vs Mod group.
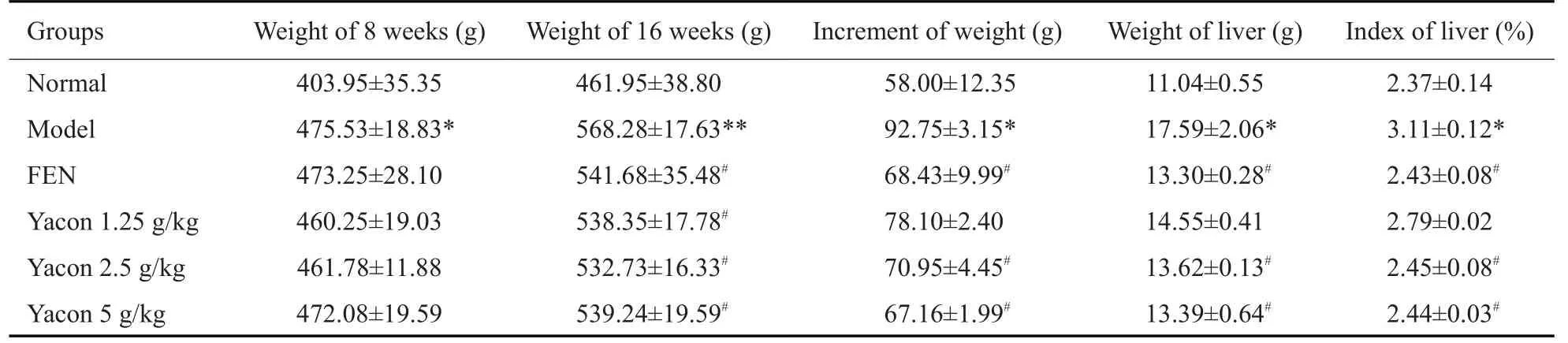
表2 Yacon浸膏对高脂血症大鼠体质量和肝脏系数的影响Tab.2 Effect of yacon root extract on body weight and liver index of hyperlipidemic rats(Mean±SD,n=10)
2.2 Yacon浸膏对大鼠血清中TC、TG、LDL-C、HDL-C水平的影响
2.2.1 第8周空白组和高脂模型组大鼠血清TG、TC水平 造模喂养8周后,随机从高脂模型组(50只)中抽取10只大鼠,测定空白组、高脂模型组大鼠TG、TC含量,与空白组相比,高脂模型组血清TG、TC水平明显升高(P<0.05,表3)。

表3 造模第8周各组大鼠的血脂指标(TG和TC)Tab.3 TG and TC levels of the rats in each group at 8 weeks of modeling(Mean±SD,mmol/L,n=10)
2.2.2 第16周各组大鼠血清中TG、TC、LDL-C、HDL-C水平 给药8周后,取各组大鼠血清进行ELISA实验,与Normal组相比,Mod组血清中TG、TC、LDL-C水平显著升高,HDL-C水平显著降低(P<0.05);与Mod组相比,Yacon 5 g/kg组血清TG、TC、LDL-C水平降低最显著,HDL-C水平升高最显著(P<0.05);与FEN组相比,Yacon 1.25 g/kg组降血脂效果则更有限(表4)。
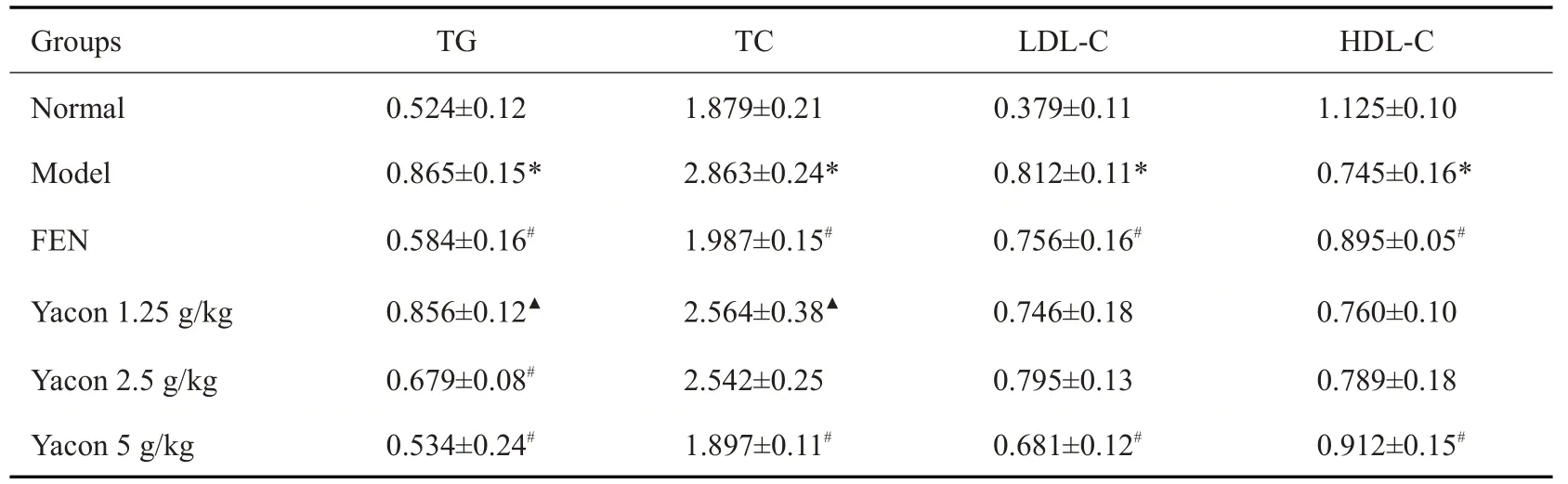
表4 Yacon浸膏对各组大鼠血清中TG,TC,LDL-C 和HDL-C的影响Tab.4 Effect of yacon root extract on serum TG,TC,LDL-C and HDL-C levels of the rats(Mean±SD,mmol/L,n=10)
2.3 Yacon浸膏对高脂血症大鼠肝脏组织病理学的影响
光镜下观察大鼠肝脏组织病理变化,给药8周后,Normal组大鼠肝细胞围绕中央静脉呈放射状排列,肝索排列较为整齐,未见明显炎性浸润和变性坏死等,肝窦结构正常;Mod组大鼠肝细胞呈放射状排列,肝索排列不整齐,细胞间隙增大,可见部分肝细胞胞质内含不着色、边缘光滑的圆形脂滴,具有炎性浸润和病理改变。与Mod组相比,各给药组大鼠肝细胞脂肪沉积、病变程度均有不同程度减轻,FEN组和Yacon 5 g/kg组肝细胞呈放射状排列,分叶不明显,肝索排列整齐;中央静脉内皮完整,肝窦结构正常,未见明显淤血扩张及炎性浸润;门管区小叶间动静脉及小叶间胆管结构均完整;Yacon 2.5 g/kg组、Yacon 1.25 g/kg组发现部分轻微脂肪变性伴空泡样改变(图2)。
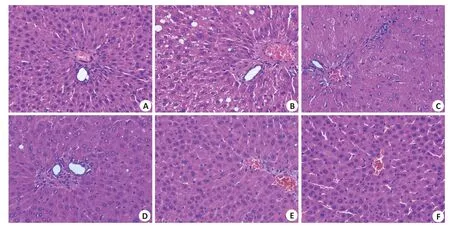
图2 Yacon浸膏对高脂血症大鼠肝脏组织病理变化的影响Fig.2 Effect of yacon root extract on pathological changes of the liver tissue in hyperlipidemic rats(HE staining,original magnification:×400).A-F:Normal control group,Model group,FEN group,Yacon 1.25 g/kg,Yacon 2.5 g/kg,Yacon 5 g/kg,respectively.
2.4 Yacon 浸膏对高脂血症大鼠肝脏中HMGCR、PPARα、CYP7A1、CPT-1 mRNA表达的影响
qPCR检测结果显示,与Normal组相比,Mod组中PPARα、CYP7A1、CPT-1 mRNA 表达水平均降低(P<0.01),HMGCR mRNA表达水平升高(P<0.01);与Mod组相比,经Yacon 浸膏治疗8 周后,Yacon 5 g/kg 组PPARα、CYP7A1、CPT-1mRNA 表达水平升高最显著(P<0.001),HMGCR mRNA表达水平降低(P<0.001);与FEN 组相比,Yacon 1.25 g/kg 组PPARα、CYP7A1、CPT-1 mRNA 表达水平均降低(P<0.01),HMGCR mRNA表达水平升高(P<0.05,图3)。

图3 Yacon浸膏对高脂血症大鼠肝脏中PPARα、CYP7A1、CPT-1、HMGCR mRNA表达水平的影响Fig.3 Effect of yacon root extract on mRNA expression levels of PPARα,CYP7A1,CPT-1 and HMGCR in the liver of hyperlipidemic rats.**P<0.01 vs Normal group;#P<0.05,##P<0.01,###P<0.001 vs Mod group;▲P<0.05,▲▲P<0.01 vs FEN group.
2.5 Yacon 浸膏对高脂血症大鼠肝脏中HMGCR、PPARα、CYP7A1、CPT-1蛋白表达的影响
Western blot法检测结果显示,与Normal组相比,Mod组中PPARα、CYP7A1、CPT-1 蛋白表达水平降低(P<0.05),HMGCR 蛋白表达水平升高(P<0.001);与Mod组相比,经Yacon浸膏治疗8周后,Yacon 5 g/kg组PPARα、CYP7A1、CPT-1 蛋白表达升高最显著(P<0.001),HMGCR蛋白表达水平降低(P<0.001);与FEN组相比,Yacon 1.25 g/kg组PPARα、CYP7A1、CPT-1 蛋白表达水平降低(P<0.05),HMGCR蛋白表达水平升高(P<0.001,图4)。
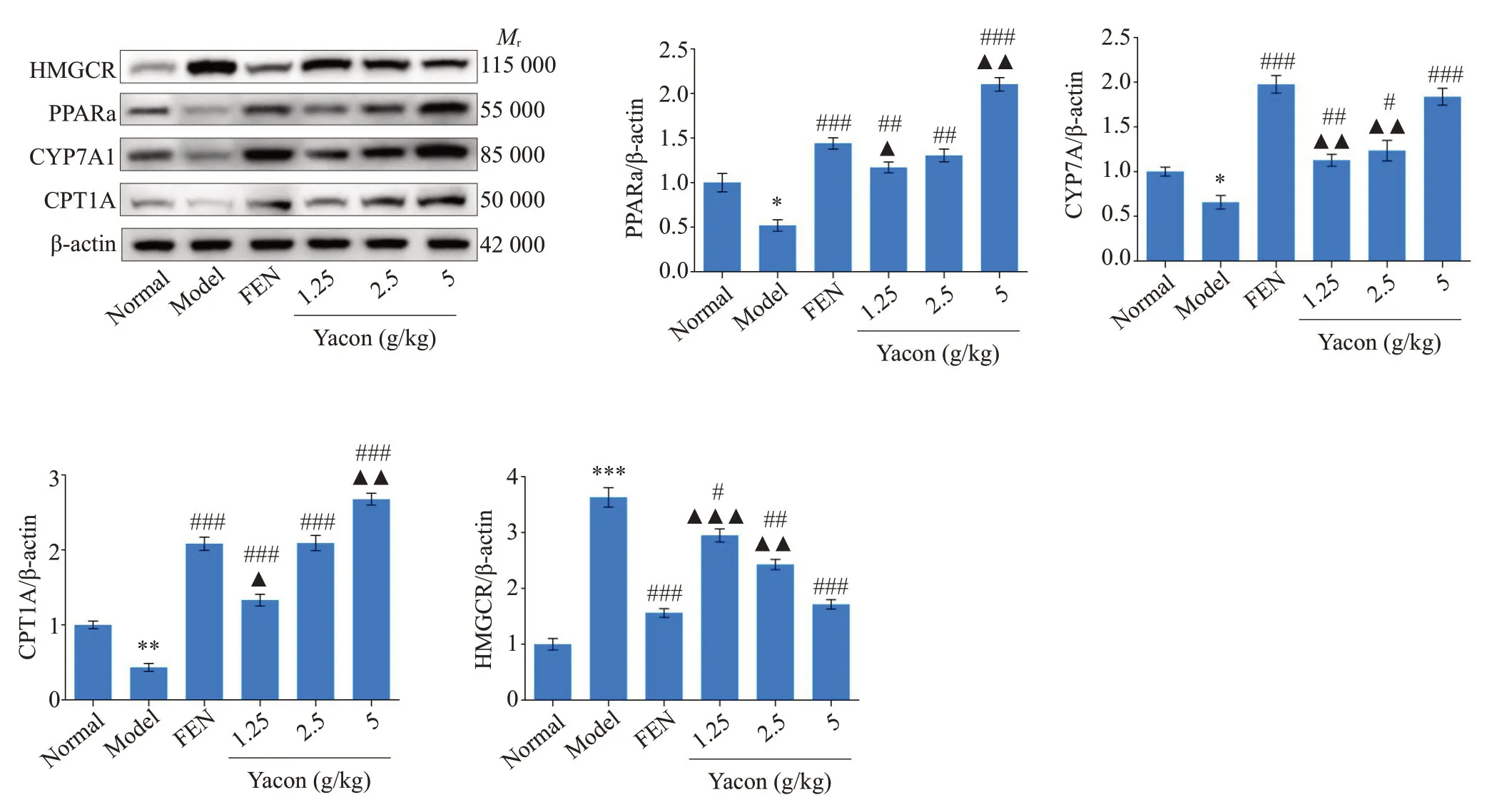
图4 Yacon浸膏对高脂血症大鼠肝脏中PPARα、CYP7A1、CPT-1、HMGCR蛋白表达水平的影响Fig.4 Effect of yacon root extract on expression levels of PPARα,CYP7A1,CPT-1 and HMGCRproteins in the liver of the hyperlipidemic rats.*P<0.05,**P<0.01,***P<0.001 vs Normal group;#P<0.05,##P<0.01,###P<0.001 vs Mod group;▲P<0.05,▲▲P<0.01,▲▲▲P<0.001 vs FEN group.
3 讨论
机体血浆中的脂质来源包括外源性小肠消化吸收和内源性脂质合成,脂肪代谢紊乱、降解通路障碍等均会引起HLP[13,14],临床上评价其发生发展的主要指标为:血清中TG、TC、LDL-C水平过高或HDL-C水平过低[15],目前调脂一线药物为他汀类、贝特类等,其作用耙点明确,但长期服用会导致肝肾损害、横纹肌溶解等严重不良反应,而中医药因其多成分、多耙点、多效应的优势,可预防和治疗HLP[16]。Yacon作为常见药食同源型水果,因国内外药理研究尚不充分而限制其开发利用,研究表明,Yacon块根和叶中含有酚酸、黄酮、倍半萜内酯类等化合物,具有降血脂、抗氧化、抗动脉粥样硬化等作用,但具体机制不清[17]。安磊等[18]发现Yacon 低聚果糖可改善氧化所致的神经退行性疾病,国外学者研究发现Yacon中有效成分参与机体清除超氧自由基和改善肠道黏膜愈合等过程[19,20]。本课题组前期经生物信息学分析后,从肠道外源性脂质吸收途径探究Yacon浸膏影响大鼠肠道脂质吸收的机制,本研究拟从内源性脂代谢信号通路探究其降脂机制。
中药干预高脂血症涉及肝脏多种信号通路[21],PPARα是脂质代谢中承上启下的关键靶点[22];HMGCR是胆固醇生物合成途径的限速酶,也是临床上他汀类药物的主要作用靶点之一[23]。PPARα可调节其下游脂肪酸转位酶(CD36)、肉碱棕榈酰转移酶1(CPT-1)、胆固醇7α-羟化酶(CYP7A1)等,促进脂肪酸β氧化和胆汁酸代谢过程,新型PPARα激动剂已被证实可以改善非酒精性脂肪肝患者的糖脂代谢并延缓高脂血症的发展[24-26]。本研究结果显示:HLP 大鼠较Normal 组肝脏PPARα、CPT-1、CYP7A1表达明显减少,脂肪酸β氧化、胆汁酸代谢水平降低,导致TG、TC代谢异常,经Yacon浸膏干预后,随着浓度增加,PPARα、CPT-1、CYP7A1表达水平升高,脂肪酸β氧化、胆汁酸代谢过程加快,TG、TC水平降低,提示Yacon浸膏通过促进肝脏PPARα的表达,上调CPT-1和CYP7A1水平,加快脂肪酸β氧化、胆汁酸代谢过程来调控TG、TC代谢。内源性胆固醇的合成增加是引起高脂血症的原因之一,关键步骤为3-羟基-3-甲基戊二酰辅酶A转化为甲羟戊酸的过程,HMGCR作为该步骤的限速酶起到重要调控作用[27,28]。研究表明,腺苷酸活化蛋白激酶可直接磷酸化甾醇调控元件结合蛋白-2下调HMGCR的转录,为治疗HLP的重要途径[29],本研究结果显示:HLP大鼠较Normal组肝脏HMGCR的表达明显升高,加快TC 的合成过程致其异常蓄积,经Yacon浸膏干预后,HMGCR表达水平明显降低,TC水平降低,提示Yacon浸膏通过抑制HMGCR的表达,减少了TC的合成过程。
综上所述,Yacon浸膏可通过调节血脂水平来预防HLP,也能通过其多种有效成分,作用于HMGCR靶点和PPARα信号通路调控TG、TC代谢,减轻肝脏脂肪变性程度并延缓HLP的发生发展。另外,本课题组偶然发现Yacon浸提液空气中久置易被氧化成深绿色,这可能与酚酸类物质的抗氧化作用相关,而抗氧化作用对于减轻脂质过氧化,改善糖脂代谢也有着重要作用,在趋化性促炎信号启动后,核因子κB可磷酸化胰岛素受体底物1(IRS1)导致胰岛素抵抗和过量活性氧生成,而转录因子核因子κB的活化能诱导抗氧化基因的表达从而降低活性氧水平和缓解炎症反应[30,31],Yacon和二甲双胍的水提取物在诱导型糖尿病实验大鼠中表现为相似的降血糖作用[32],Yacon块根能够使糖尿病大鼠肝肾组织中的谷胱甘肽水平升高[33]。因此我们推测,Yacon也可能通过改善氧化应激水平和降低炎症反应来预防或治疗HLP、糖尿病等疾病,课题组后续也将进一步研究。本实验结果不仅揭示了Yacon浸膏通过机体多靶点、多途径调节脂质代谢的特点,还为其通过抗氧化、抗炎作用干预代谢性疾病提供了指导方向,为该方临床应用提供理论依据。