没食子酸改性竹粉的制备及抑菌性能
叶金枝,徐 涓,杨 静,杨海艳,王大伟,史正军,
(1.西南林业大学 国家林业和草原局丛生竹工程技术研究中心,云南 昆明 650224;2.西南林业大学 西南地区林业生物质资源高效利用国家林业和草原局重点实验室,云南 昆明 650224)
竹材因孔隙层次多,含有丰富的多糖、蛋白质和水分等营养物质,极易受微生物侵染[1-2]。因此,通过技术手段改良竹材以增强竹材的抑菌性能尤为重要[3]。目前常用的木材、竹材抑菌改性剂有无机抑菌剂和有机抑菌剂2 类[4]。无机抑菌剂与纤维之间是物理吸附,相互作用力弱,容易流失;有机抑菌剂虽能与纤维形成化学联接,却容易对环境造成污染,使微生物产生抗药性。植物多酚是天然植物原料中的有效成分,因其种类繁多、生产量大、能抗炎抑菌而备受关注[5]。天然多酚类化合物没食子酸能通过接触微生物造成细胞膜局部破裂成孔,破坏细胞膜完整性,使得细胞膜内物质泄漏,进而杀死细胞[6],因此,近年来被广泛应用于改良材料的抑菌性能。ZHANG 等[7]和ZARANDONA 等[8]使用没食子酸制备的乙酰化果胶和壳聚糖膜均表现出优异的抑菌效果。龙竹Dendrocalamusgiganteus是滇东南地区广泛分布的特色大型丛生竹材,常被应用于西南少数民族建筑和家具制品,但其抗生物侵害能力不足的特性严重影响了其使用周期和产品质量[9]。本研究基于竹材细胞壁组分多羟基特性和没食子酸的天然抑菌活性,用没食子酸改性龙竹竹粉,并对改性竹粉的结构特性和抑菌性能进行分析表征,可为发展植物源竹材绿色防护技术提供方法借鉴和理论支撑。
1 材料与方法
1.1 材料
供试竹材为云南省临沧市沧源县3 年生无腐朽无霉变龙竹。供试菌种大肠埃希菌Escherichiacoli(革兰氏阴性细菌)和金黄色葡萄球菌Staphylococcusaureus(革兰氏阳性细菌)购自北京保藏生物科技有限公司。
1.2 方法
1.2.1 龙竹预处理 将龙竹去节,去除竹青竹黄,劈成竹片,用粉碎机粉碎后过40~60 目筛,将该原料记作DG;用苯醇抽提(体积比为2∶1) 6 h 做脱蜡处理,放在60 ℃的烘箱内干燥备用,抽提物料记作DG-E;称取DG-E 物料10.00 g,加入质量浓度为5%的氢氧化钠溶液,固液比为1∶20,在80 ℃的恒温水浴锅内磁力搅拌回流2 h,用蒸馏水洗涤至中性,冷冻干燥,制备得到碱处理的竹粉,碱处理物料记作DG-A。
1.2.2 龙竹改性处理 龙竹改性方法在文献[10]的基础上略有改动:称取10.00 g 没食子酸(GA)于烧杯中,加入100 mL N, N-二甲基甲酰胺(DMF),搅拌完全溶解;加入DG-A 3.50 g、1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐(EDC) 12.00 g 和4-二甲氨基吡啶(DMAP) 1.45 g;水浴搅拌反应48 h,反应温度为60 ℃,待反应结束后用蒸馏水和乙醇反复洗涤烘干备用,得到的物料标记为DG-GA。
1.2.3 菌液浓度测定及配制 参考GB/T 20944.3—2008[11]略有改动制备菌液。将第3 代菌液采用10 倍稀释法稀释到合适倍数后,取50 μL 涂布,培养24 h 观察,确定菌液浓度达1×1012~5×1012CFU·L-1,菌液分别记作SA-1 和EC-1。将SA-1 和EC-1 菌液用10 倍稀释法稀释4 次,使菌液浓度达3×108~4×108CFU·L-1,分别记作SA-2 和EC-2,作为预接种菌液。
1.3 预处理前后及改性后的性能表征
1.3.1 可及度测定 使用直接红染料(Direct red 28, DR28)对DG、DG-E、DG-A 进行可及度测定[12]。称取0.1 g 待测样品与10 mL 不同质量浓度的染液(0、0.13、0.30、0.60、0.90、1.20、1.80、2.40、2.80 和3.00 mg·mL-1)混合。放置于恒温振荡器中,50 ℃,150 r·min-1保持24 h,收集上清液并用紫外可见分光光度计(UV-210 PC)在498 nm 条件下测定其吸光度,使用标准曲线计算残液浓度。根据Langmuir 吸附等温线拟合分析几种物料对染料的吸附能力,对龙竹竹粉的可及范围做出评估。
1.3.2 化学组分测定 参照美国能源再生实验室NREL 法[13]对DG、DG-E、DG-A 和DG-GA 的化学成分进行分析。用体积分数为72%的硫酸对物料进行酸水解,使用高效液相色谱仪(Agilent 1200S)对4 种物料中的碳水化合物成分进行分析;使用紫外可见分光光度计在205 nm 处对酸溶木质素进行分析,将剩余固体残渣用G3 砂芯漏斗洗净,65 ℃烘干,木质素总量为酸溶木质素与固体残渣的总和。
1.3.3 结构特性分析 分析DG、DG-E、DG-A 和DG-GA 等4 种样品的化学结构,使用傅里叶红外光谱仪(Nexus 670,FTIR)进行扫描,扫描范围为4 000~500 cm-1,分辨率为2 cm-1,扫描次数32 次的模式下采集数据。采用X 射线衍射分析仪(X Pert Powder,XRD)分析样品的结晶结构,使用铜靶波长为0.154 18 nm,2θ扫描区间为5°~40°,电压40 kV,电流40 mA。其中结晶指数可以根据Segal 公式进行计算:。其中,Icr为结晶指数,Iamorph指2θ为18°时无定形区衍射峰的强度,I002为主结晶峰002 的最大衍射强度。
使用扫描电子显微镜(Hitachi Regulus 8100,SEM)观察样品的表面形貌,加速电压为2~5 kV,物料表面喷金处理。采用热重分析仪(TG),分别称取4 种样品约3.0 mg 于陶瓷坩埚中,利用高纯度氮气作为保护气(气体流量为20 mL·min-1)和吹扫气(气体流量为50 mL·min-1),样品升温速率为10 ℃·min-1,温度为35~600 ℃。
1.3.4 抑菌活性的测试 参照GB/T 20944.3—2008[11],探究DG-A 和DG-GA 对大肠埃希菌和金黄色葡萄球菌的抑菌性能。在三角烧瓶中称取上述2 种样品各(0.75±0.05) g,然后在烧瓶中各加入(70.00±0.03)mL 0.03 mol·L-1的PBS 缓冲溶液,再加入5.0 mL SA-2 菌液,每种样品制备3 个平行样,另准备3 个不加样品的空白对照;将每个烧瓶盖好透气封口膜,置于恒温振荡器上,在(24±1) ℃,以150 r·min-1,振荡18 h。到规定时间后,将烧瓶中的试液稀释至合适的倍数,取(50.0±0.1) μL 移入固体培养基中,每个试液及不同的稀释浓度制作3 个平行样,倒置平板,在(37±1) ℃,培养24~48 h。选择30~300 CFU 的平板进行计数,对DG-A 和DG-GA 的活菌浓度进行计数。按下式计算抑菌率(Y):。其中,Wt为空白对照组3 组平行样菌液浓度的平均值;Qt为每种试样3 组平行样菌液浓度的平均值。
2 结果与分析
2.1 龙竹预处理前后及改性后的表征
2.1.1 可及度分析 图1 表明:经过苯醇抽提处理后的竹粉(DG-E)对染料的吸附量从44.92 mg·g-1增加到78.66 mg·g-1;碱处理竹粉(DG-A)对染料的吸附量从78.66 mg·g-1增加到174.39 mg·g-1,增加了121.7%。可能是由于碱液进入竹纤维束内部,将细胞壁内的部分木质素和半纤维素溶解,同时润胀纤维,增大了竹粉的可及度。选择最大可及度的条件下制备的竹粉样品进行后续酯化改性。

图1 竹粉样品DG、DG-E 和DG-A 的Langmuir等温吸附曲线Figure 1 Langmuir isothermal adsorption curves of bamboo powder samples DG, DG-E and DG-A
2.1.2 化学组分分析 由图2 可见:经过苯醇抽提脱蜡处理的竹粉(DG-E)的木质纤维化学成分无明显变化;碱处理竹粉(DG-A)的纤维素相对含量从48.63%增加到61.24%,半纤维素相对含量从15.29%减少到11.39%,木质素相对含量从30.36 %减少到18.81%。该结果表明:碱处理去除了部分碳水化合物和木质素,使得没食子酸与竹材内部的羟基接触反应的可能性变大[14]。DG-A 与DG-GA 的化学组分比较结果显示:纤维素、木质素和半纤维素的相对含量几乎不变,可见没食子酸与竹粉的酯化反应对其纤维素、木质素和半纤维素的相对含量影响不大。

图2 竹粉样品DG、DG-E、DG-A 和DGGA 的化学组分Figure 2 Chemical composition of bamboo powder samples DG, DGE, DG-A and DG-GA
2.1.3 FTIR 分析 由图3 可知:3 401 和2 900 cm-1处分别出现O—H 和C—H 的伸缩振动峰,在1 592和1 511 cm-1处的苯环伸缩振动峰是木质素的基本特征吸收峰[15],在1 052 cm-1处是醚键(C—O—C)的吸收峰,894 cm-1是木糖单元之间的β-糖苷键的特征吸收[16];对比DG-E 和DG-A,在1 724 cm-1处的酯键(C=O)消失,这是由于木质素结构单元之间和木质素与碳水化合物之间的联接键是酯键,该键在碱性条件下非常容易被水解[14],所以在碱处理之后,该峰位置的信号明显减弱;经过GA 改性后,1 724 cm-1处的C=O 的吸收峰又显著增强,并且在1 150~1 200 cm-1处C—O 的伸缩振动也增强,说明竹粉表面可能生成酯键[17]。LIU 等[18]用GA 改性果胶,证实了在1 749 cm-1处,果胶的羟基基团与GA 末端的羧基形成酯键,该结果与GA 改性DG 的结果相符。
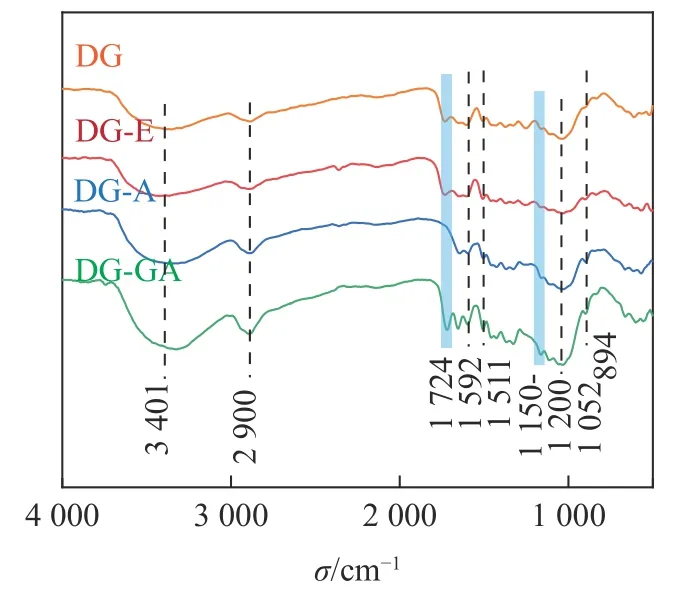
图3 竹粉样品DG、DG-E、DG-A 和DG-GA的FTIR 图Figure 3 FTIR spectra of bamboo powder samples DG, DG-E, DG-A and DG-GA
2.1.4 XRD 分析 由图4 可以看出:DG、DG-E、DG-A 和DG-GA 等4 种物料的峰形相似,均表现出纤维素Ⅰ型衍射峰。在2θ为16.0°的峰对应为纤维素(101)晶面衍射峰,在2θ为22.0°的峰对应为纤维素(002)晶面衍射峰[14]。与原竹粉相比较,随着抽提、碱处理和酯化反应的进行,纤维素的结晶度逐渐降低,这是由于碱的润胀作用会在一定程度上破坏纤维素的结晶结构,从而降低结晶度[19]。经过酯化反应后,结晶度由54.93%降至50.73%,这一变化可能是酯基的引入将相对松散的区域破坏,使得结晶度下降。ZHU 等[20]在松香酸改性木质纤维素的研究中,也证实了酯化之后的纤维素结晶度有所降低。
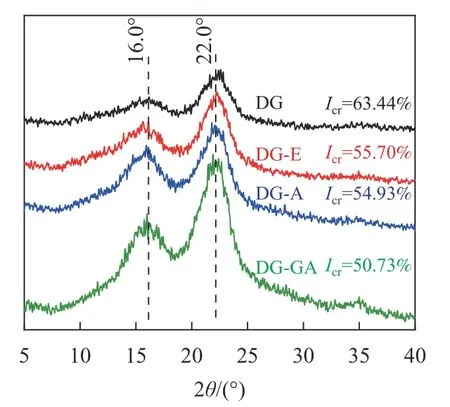
图4 竹粉样品DG、DG-E、DG-A 和DG-GA的XRD 图Figure 4 XRD spectra of bamboo powder samples DG, DG-E, DG-A and DG-GA
2.1.5 SEM 分析 如图5 所示:天然DG 表面有细微颗粒,纤维束之间黏结紧密;经过抽提后,DGE 表面呈鳞状较为粗糙,是因为解除了蜡质的包裹作用;在碱处理后,竹纤维经过润胀,原本连接紧密的竹纤维束变得更加松散,说明碱液有效的浸透到竹材中,DG-A 细胞之间的连接物质如木质素和半纤维素等减少,这一现象与龙竹化学组分分析结果一致。由于部分低聚物溶出,让原本致密的竹材变得松散,使得GA 更容易浸入到竹材内部发生反应。改性后的物料DG-GA 更加光滑,无明显的层次结构,表明纤维素与GA 酯化形成的产物可能形成了包裹物包裹在纤维上。

图5 竹粉样品DG、DG-E、DG-A 和DG-GA 的SEM 图Figure 5 SEM images of bamboo powder samples DG, DG-E, DG-A and DG-GA
2.1.6 TG 分析 由图6 所示:在初始升温阶段(30~200 ℃),所有物料均无明显降解,其质量损失主要是由物料中的水等小分子挥发所导致。180~360 ℃阶段为纤维素、半纤维素和部分木质素的降解阶段[21]。对比可知,DG 和DG-E 的初始降解温度为190 ℃,DG-A 的初始降解温度为280 ℃,说明碱处理竹材热稳定性明显增强,这是由于DG-A 脱除了部分相对易热解的半纤维素和木质素所致。据报道[22],GA 在260 ℃附近有明显的热化学转变,但本研究在该温度附近并未出现转变,说明GA 并非简单吸附在竹粉表面,而是通过与酯键与竹粉形成紧密结合。在纤维热降解最剧烈阶段(320~360 ℃),DG-GA 的初始热解温度和最大降解速率温度均高于DG,说明本研究中所采用的没食子酸改性有助于提高竹材热稳定性。原因可能是由于酯化反应主要发生在竹纤维最外层,包裹在竹纤维表面的酯化产物可以有效地充当物理屏障,进而赋予竹粉较高的热稳定性。

图6 竹粉样品DG、DG-E、DG-A 和DG-GA 的TG 和DTG 曲线Figure 6 TG and DTG curves of bamboo powder samples DG, DG-E, DG-A and DG-GA
2.2 DG-GA 的抑菌活性结果
由图7 可见:改性前物料(DG-A)对大肠埃希菌抑菌率为30.70%,改性后的物料(DG-GA)对大肠埃希菌抑菌率为93.24%,抑菌率提高了62.54%;DG-A 对金黄色葡萄球菌抑菌率为32.18%,DG-GA 对金黄色葡萄球菌抑菌率为75.29%,抑菌率提高了43.11%,抑菌效果明显提升。改性后的竹粉的菌落变得稀少,这是由于没食子酸与竹粉成功接枝,赋予了龙竹没食子酸的抑菌能力。ZHANG 等[7]将天然果胶用没食子酸酶法酰化,提高了对大肠杆菌和金黄色葡萄球菌的抑制率,这与本研究结果相似。
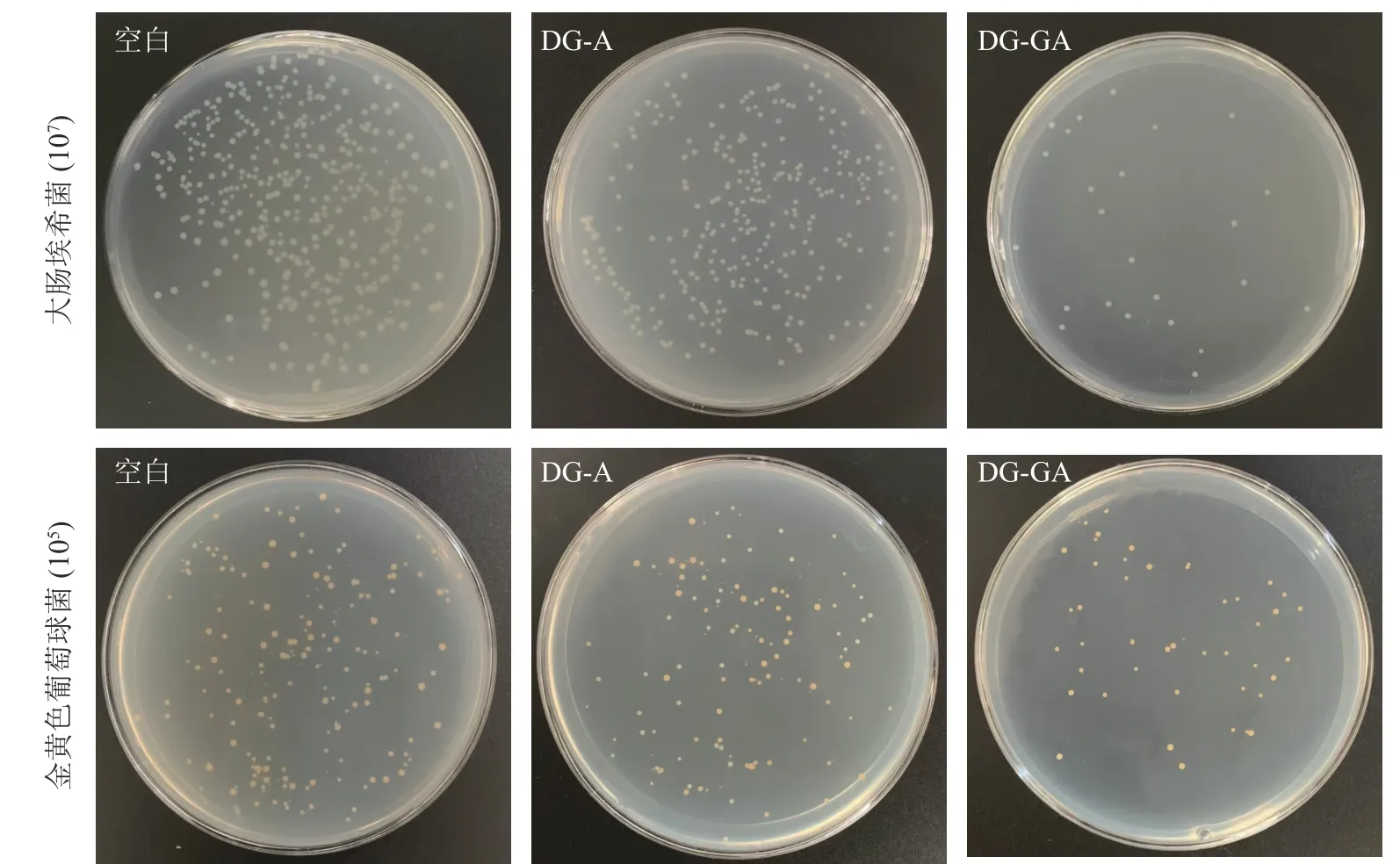
图7 竹粉样品DG-A 和DG-GA 对大肠埃希菌和金黄色葡萄球菌的抑菌效果Figure 7 Antibacterial effect of bamboo powder samples DG-A and DG-GA on E.coli and S.ureus
由图8 发现:DG-GA 对大肠埃希菌的抑制作用优于金黄色葡萄球菌,这可能与革兰氏阳性菌有较厚的肽聚糖层结构有关[23],对比革兰氏阴性菌的双膜结构,这种肽聚糖层结构具有更高级的保护屏障,因此改性竹材表现出对大肠埃希菌的抑菌效果优于金黄色葡萄球菌。改性得到的产物对革兰氏阴性菌和革兰氏阳性菌均表现出优异的抑制效果,可能是因为竹粉和没食子酸酯化后,其酚羟基能与细菌细胞上的金属离子螯合,影响细胞膜的通透性,使细菌代谢紊乱而不能正常生长,从而起到抑菌作用[24]。

图8 竹粉样品DG-A 和DG-GA 对大肠埃希菌和金黄色葡萄球菌的抑菌率图Figure 8 Antibacterial rate of bamboo powder samples DG-A and DGGA on E.coli and S.ureus
3 讨论与结论
竹材由于含有营养物质易被微生物感染,现存抑菌剂存在易流失和污染环境等问题,本研究使用没食子酸对竹粉进行改性,结果发现竹粉的抑菌效果有明显提升。通过振荡法对改性前后竹材抑菌活性的测试可知:竹材对大肠埃希菌抑菌率为93.24%,对金黄色葡萄球菌抑菌率75.29%。该研究与已有研究结果相似,如HUANG 等[25]将没食子酸改性果胶,对大肠埃希菌有11.41 mm 的抑菌圈,对金黄色葡萄球菌有12.52 mm 的抑菌圈,该产品作为涂层能有效地延长中国鲈鱼Lateolabraxmuculatus鱼片的整体质量。ZHANG 等[7]用酶法酰化天然果胶,制备得到的样品对大肠埃希菌和金黄色葡萄球菌的抑制率也分别从2.93%和8.92%提高到26.95%和42.18%。改性后物料红外分析表现出新的吸收峰,结晶度下降,纤维束表面变光滑,最大降解温度增加,抑菌效力显著增强,均表明没食子酸与竹粉成功接枝。近些年,没食子酸及其衍生物与竹材反应机制复杂,反应过程受多因素影响[26]。在后续研究中,可进一步阐明没食子酸与竹材的反应及抑菌机制。
在处理显著提高了龙竹粉可及度的基础上,没食子酸可以与竹粉组分之间通过酯化反应形成接枝共聚物,在竹纤维束表面形成一层包裹物,使其表面变得更加光滑;没食子酸改性后,竹粉的热稳定性不仅没有降低,反而提高约40 ℃;没食子酸改性竹粉的抑菌效力明显提高。

