应用于RPA nfo反应产物结果可视化的胶体金试纸条制备与评价
杨晨,薛俊欣,林雅娟,王小妹,蒋蔚,张曼玉,王权*,孙卫东
(1. 南京农业大学动物医学院,江苏 南京 210095;2. 中国农业科学院上海兽医研究所,上海 200241;3. 中华人民共和国上海海关,上海 200002)
胶体金侧向免疫层析试纸条(GICS)是以胶体金为示踪标记物、基于抗原抗体免疫反应的侧流层析技术,它在病原微生物抗原检测、药物残留监测等领域已得到广泛应用。通过在核酸扩增时将不同的标签引入核酸链的两端,基于相应抗体或配体与标签的相互作用,对核酸扩增产物产生可视化的现象,GICS便可应用于核酸检测[1]。杨贤等[2]使用异硫氰酸荧光素标签修饰的上游引物和生物素标签修饰的下游引物进行聚合酶链式反应(PCR),在扩增产物上引入的2个标签能分别被抗荧光素抗体和金标链霉亲和素(streptavidin,SA)识别并结合,进而在60 min内实现乙肝病毒核酸的GICS检测。PCR-GICS方法的检测速度明显快于常规的琼脂糖凝胶电泳(AGE)和实时荧光 PCR,无需借助电泳仪或荧光定量系统就能在短时间内实现结果的可视化,庞璐等[3]还指出该方法可提高检测的灵敏度。但PCR需要专业的仪器和操作人员,不能运用PCR-GICS方法进行现场检测。
恒温扩增技术则弥补了PCR、荧光定量PCR等热循环扩增技术的不足,降低了设备要求,具有简便、快速、特异等优点。目前常用的恒温扩增技术包括环介导等温扩增(LAMP)、重组酶-聚合酶扩增(RPA)、滚环核酸扩增 (RCA)、链替代扩增(SDA)等[4]。RPA是发展最快的方法之一,该方法能在低温(37~42 ℃恒温下)、短时间内(≤30 min)获得可检出水平的扩增产物,目前已实现较为成熟的市场化[5]。英国TwistDxTM公司开发了TwistAmp®Basic、TwistAmp®exo、TwistAmp®nfo等商品化RPA反应试剂盒,其中RPA nfo试剂盒及其配套的侧流试纸条Milenia HybriDetect 1/2是最常用的RPA-GICS技术,能在10~35 min内完成核酸扩增及试纸条检测[6],然而该试纸条价格昂贵、成本较高。本研究基于金标6-羧基荧光素(6-FAM)单克隆抗体及生物素-链霉亲和素系统,自主研发了用于RPA nfo反应产物结果可视化的胶体金免疫层析试纸条,降低了检测成本,为实现RPA-GICS技术的国产化,建立核酸快速检测方法奠定了基础。
1 材料与方法
1.1 材料
6-FAM、链霉亲和素购自阿拉丁公司;卵白蛋白(OVA)、聚乙二醇购自西格玛奥德里奇(上海)贸易有限公司;牛血清白蛋白(BSA)购自北京威莱博生物技术有限公司;1,2-双(2-氨基乙氧基)乙烷购自梯希爱(上海)化工贸易有限公司;氯金酸购自国药集团化学试剂有限公司;羊抗鼠IgG购自武汉博士德生物工程有限公司;RPA nfo反应所用的引物及探针,F-B探针(6-FAM,Biotin双标记的寡核苷酸探针,其序列为5′-(6-FAM)-TTTTTT-Biotin-3′,它们均由生工生物工程股份有限公司合成;BALB/c雌鼠购于斯贝福(北京)生物技术有限公司;SBA Clonotyping System-HRP购自美国Southern Biotech公司;Protein G Agarose (Fast Flow,抗体纯化用)和BCA蛋白浓度测定试剂盒(增强型)购自上海碧云天生物技术有限公司;TwistAmp®nfo和Milenia HybriDetect 2(Milenia Biotec-MGHD1)购自英国TwistDxTM公司;PVC底板、吸水垫、加样垫、硝酸纤维膜(Sartorius CN95,孔径15 μm)均购自上海捷宁生物科技有限科技公司。
1.2 抗6-羧基荧光素(6-FAM)单克隆抗体的制备
1.2.1 抗6-FAM完全抗原的制备与鉴定
参考Wang等[7]的文献,采用活性酯法制备完全免疫原(6-FAM-1-BSA)和完全包被原(6-FAM-1-OVA)。取20 mg BSA/OVA溶于3.5 mL 0.05 mol/L 2-(N-吗啉代)乙磺酸缓冲液(MES)中(pH值4.5~7.2),加入0.5 mL碳二亚胺溶液(EDC)(7.52 mg/mL MES缓冲液溶解)和0.5 mL N-羟基琥珀酰亚胺溶液(NHS)(6 mg/mL MES缓冲液溶解)并混匀;加入15 μL 1,2-双(2-氨基乙氧基)乙烷,冰浴搅拌4 h,1×磷酸盐缓冲液(PBS)透析3 d,作为A液。取15 mg 6-FAM溶于400 μL DMF中,各加入100 μL EDC溶液和NHS溶液,均为100 mg/mL N,N-二甲基甲酰胺(DMF)溶解,冰浴振荡过夜,作为B液。将B液缓慢滴加至A液中,4 ℃搅拌12 h,1×PBS透析 7 d。运用紫外-可见光(UV-Vis)扫描对所制备的完全抗原进行鉴定,并对成功偶联的完全抗原液进行分装、冷冻干燥。
1.2.2 小鼠免疫与血清6-FAM多克隆抗体效价测定
将偶联成功的完全免疫原6-FAM-1-BSA与佐剂1∶1混合、震荡乳化,免疫8周龄SPF级BALB/c雌鼠,具体程序如表1。在二免、三免和四免后10 d分别对免疫鼠进行眼眶后静脉丛采血,血凝后离心取上层血清,运用间接ELISA方法测定效价:使用包被抗原6-FAM-1-OVA包被酶标板(设置5、2.5、1.25、0.625及0.312 5 μg/mL 5个浓度),4 ℃过夜,洗板;1%明胶37 ℃封闭2 h,洗板;在相同抗原包被浓度下加入梯度稀释的血清作为一抗,37 ℃孵育1.5 h,洗板;加入1∶20 000稀释的HRP-羊抗鼠IgG作为二抗,37 ℃孵育1 h,洗板;TMB显色液37 ℃孵育15 min,2 mol/L H2SO4终止显色,测定OD450。在四免后第14天选择血清效价最高的免疫鼠进行腹腔冲击免疫。

表1 完全免疫原(6-FAM-1-BSA)的小鼠免疫程序
1.2.3 诱生腹水瘤法单克隆抗体的制备及评价
腹腔冲击免疫后第3天,使用PEG诱导免疫鼠的脾细胞与SP2/0细胞融合,再用HAT选择性培养基培养。融合后第7天,观察并标记96孔板中细胞团的个数,待细胞团长到占孔大小1/16~1/8时,酶标板包被1.25 μg/mL 6-FAM-1-OVA,吸取细胞上清液作为一抗,运用间接ELISA筛选阳性孔,对OD450值较高的阳性孔先后进行3次亚克隆,筛选能稳定分泌抗体的单克隆杂交瘤细胞株,再进行扩大培养。
运用诱生腹水法,将扩大培养后的细胞用生理盐水重悬,腹腔注射至已预先注射石蜡油的BALB/c雌鼠。待小鼠腹部膨大且处于濒死状态时,收集腹水,离心弃去上层石蜡油及下层细胞沉淀后,置于-80 ℃长期保存。同1.2.2,运用间接ELISA方法测定腹水6-FAM单抗的效价。依照SBA Clonotyping System-HRP试剂盒说明书,分别对单抗腹水及单抗细胞上清液进行抗体分型检测。
单抗腹水使用Protein G琼脂糖抗体纯化柱纯化,收集的洗脱液经4 ℃透析(0.005 mol/L PB,pH值7.2)、浓缩后,使用BCA蛋白浓度测定试剂盒测定浓度。参考非竞争ELISA单克隆抗体亲和力测定方法[8-9],以2、1、0.5、0.25 μg/mL 6-FAM-1-OVA包被酶标板,以倍比稀释的不同浓度梯度的纯化抗体为一抗,以1∶1×104稀释的羊抗鼠IgG为二抗,进行间接ELISA测定。再以OD450值为纵坐标,以纯化抗体浓度(mol/L)的对数为横坐标,绘制曲线,计算在抗原抗体50%结合时,即50%ODmax值(每条曲线的最大OD450值)所对应的抗体浓度,最后根据以下公式计算出亲和力常数(Ka)。
其中n、[Ab′]t和[Ab]t分别为每组中2个包被浓度的倍数及各自对应的50%ODmax值。
1.3 胶体金标记6-FAM单克隆抗体与胶体金免疫层析试纸条的制备
1.3.1 试纸条的组装
在PVP底板中间贴上硝酸纤维素(NC)膜,并在NC膜上、下分别覆盖吸水垫、加样垫,与NC膜重叠0.3 mm左右。每条试纸条宽度4 mm。
1.3.2 胶体金的烧制及其与6-FAM单抗最佳标记条件的优化
采用柠檬酸钠还原法烧制粒径15 nm的胶体金,取100 mL 0.01%氯金酸加热至沸腾,迅速加入2 mL 1%柠檬酸钠,继续搅拌加热,反应液由黄色依次变为灰紫、酒红,待颜色不再变化时停止加热,冷却后即制得透亮的胶体金溶液,经紫外全波长扫描测得溶液的最大吸收峰为519 nm。
通过高浓度NaCl破坏试验,优化制备金标6-FAM单抗的标记pH值和抗体标记量:在1 mL胶体金溶液中,设置0.1 mol/L K2CO3投入量分别为0、10、20、30、40、50 μL,混匀后测得pH值分别为6.0、6.5、7.0、8.0、8.5、9.0,各加入10 μg 6-FAM纯化抗体,混匀静置10 min,再加入100 μL 10% NaCl,混匀静置2 h后观察颜色变化;在最佳标记pH值下,分别加入抗体终浓度为0、2.5、5、10、15、20 μg/mL的胶体金,同样加入10% NaCl并观察颜色变化。若标记效果不佳,加入高浓度NaCl后破坏胶体金的负电斥力,改变其疏水胶体的状态,形成死金的情况,表现为胶体金变浅、变紫、甚至变黑沉淀。
确定最佳pH值和最佳抗体标记量后,在最低标记量10 μg/mL胶体金的基础上增加20%[10],向胶体金溶液中加入6-FAM纯化单抗,边搅拌边逐滴加入,室温避光反应30 min,再逐滴加入10% BSA至终浓度1%,搅拌20 min后再静置1 h,4 ℃下9 200g离心30 min,慢慢吸去上清液,下层松散沉淀用重悬液重悬至原胶体金溶液的1/10。
1.3.3 胶体金免疫层析试纸条链霉亲和素线包被缓冲液的优化
蛋白质主要通过静电荷力、疏水力、氢键等包被于NC膜上,考虑到pH值及离子强度对链霉亲和素与NC膜之间吸附作用的影响,分别测试表2中4种溶液对包被效果的影响,控制检测(T)线链霉亲和素的包被浓度均为1 mg/mL,质控(C)线包被1 mg/mL羊抗鼠IgG,37 ℃烘干。如图2,DNA模板使用RPA nfo试剂盒扩增后,产生带有6-FAM和Biotin标签的扩增产物,可用6-FAM和Biotin双标记的F-B探针代替该扩增产物进行试纸条的性能优化。向100 μL 0.01 mol/L pH值7.0 PB层析液中加入终浓度为50 nmol/L的F-B探针模拟阳性样本,不含F-B探针的层析液模拟阴性样本,在阳性样本和阴性样本中各加入3 μL金标抗体,混匀后上样,观察条带颜色深浅。
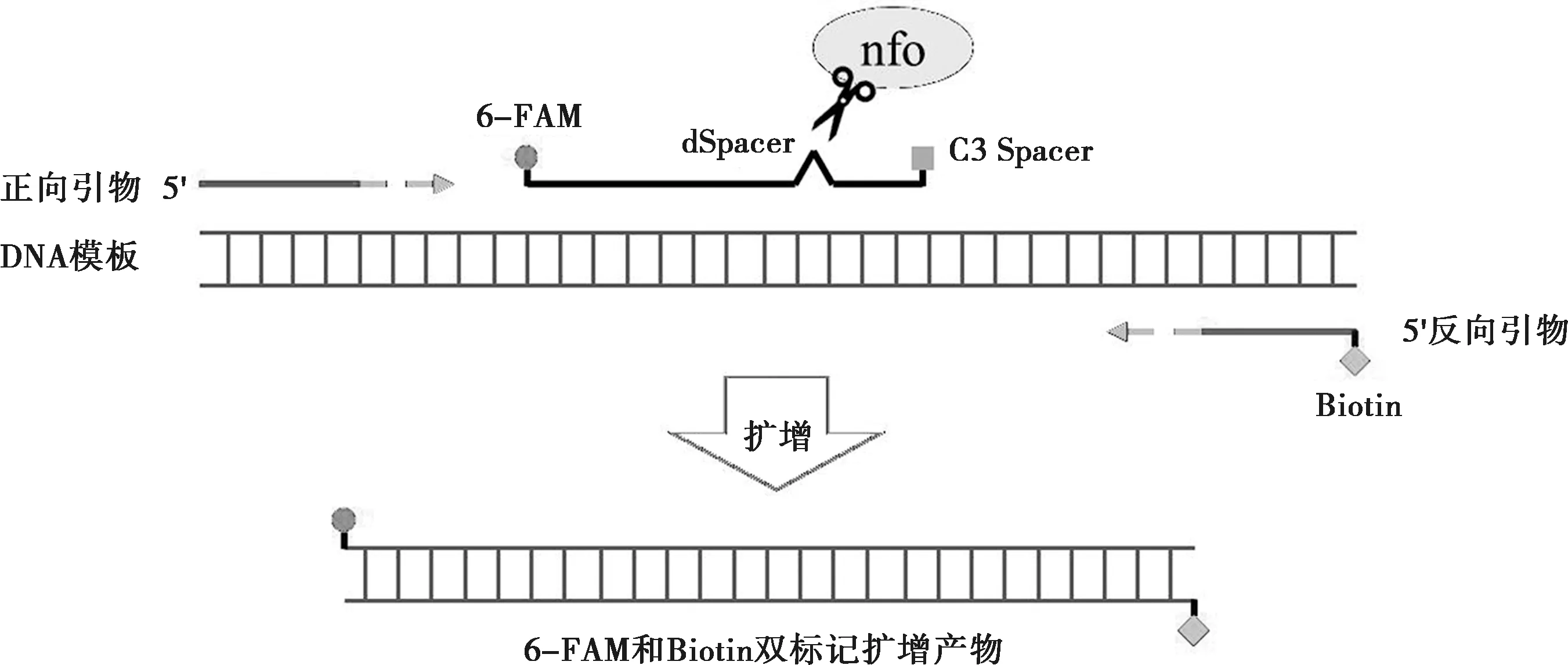
图2 RPA nfo试剂盒进行DNA扩增的示意图
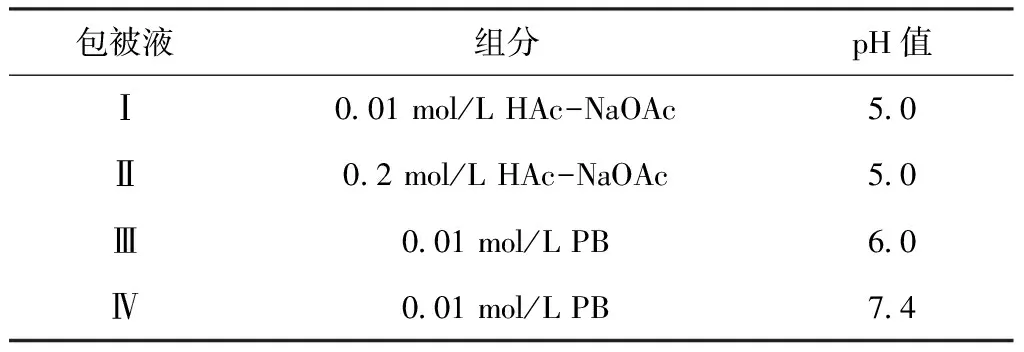
表2 T线包被缓冲液
1.4 胶体金免疫层析试纸条RPA nfo反应产物可用性试验
1.4.1 胶体金免疫层析试纸条最佳层析液的优化
使用所设计的派氏异尖线虫RPA引物及探针,以1 μL派氏异尖线虫质粒(1 copy/μL)模板进行RPA nfo扩增,反应产物作为阳性样本;以UP水为空白对照,进行RPA nfo扩增,反应产物作为阴性样本。在相同T线和C线包被浓度下(均为1 mg/mL),分别使用3种层析液(表3),将5 μL反应产物稀释至100 μL,再加入10 μL金标6-FAM单抗充分混合,上述混合液全部加至试纸条加样垫上,5 min后观察使用不同层析液所对应的条带深浅。

表3 GICS层析液
1.4.2 胶体金免疫层析试纸条T线最佳包被浓度的优化
设置T线SA包被浓度为0.5、0.75、1、1.5 mg/mL,使用最佳层析液将5 μL阳性样本与10 μL金标6-FAM单抗充分混合,加至试纸条加样垫,5 min后观察不同T线包被浓度所对应的条带深浅。
1.4.3 胶体金免疫层析试纸条最佳反应产物用量及金标抗体用量优化
采用控制变量法:先设置反应产物用量为2、5、8 μL,金标抗体用量为10 μL,摸索最佳反应产物用量;再在最佳反应产物用量下,金标抗体用量设为5、10、15 μL,测得最佳金标抗体用量。
1.4.4 自主研发的胶体金免疫层析试纸条与商品化试纸条性能对比
确立最佳条件后,分别使用自主研发的胶体金免疫层析试纸条与商品化试纸条Milenia HybriDetect 2,检测以1 μL不同浓度(0.5×106~1×106copies/μL)质粒为模板的阳性样本和以1 μL超纯水为模板的阴性样本,5 min后对比条带有无及颜色深浅。
2 结果
2.1 完全抗原紫外-可见光吸收光谱鉴定
在275~575 nm波长范围内分别对6-FAM、BSA、OVA以及制备的完全抗原6-FAM-1-BSA和6-FAM-1-OVA进行紫外-可见光扫描,结果见图3。6-FAM、BSA、OVA分别在497、285、284 nm处有最大吸收峰。偶联后,6-FAM-1-BSA在284 nm和497 nm存在吸收峰,6-FAM-1-OVA在283 nm和496 nm存在吸收峰,充分透析的完全抗原的紫外-可见光吸收光谱出现了6-FAM的特征吸收峰,初步说明偶联成功。
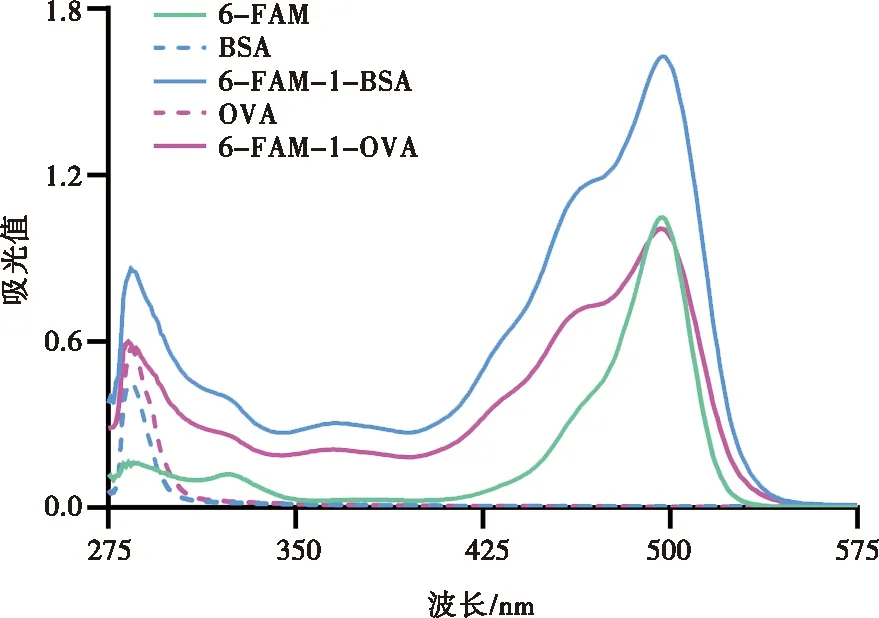
图3 6-FAM-1-BSA与6-FAM-1-OVA的紫外-可见光吸收光谱
2.2 免疫鼠血清6-FAM多克隆抗体效价
运用间接ELISA测定小鼠血清多抗效价,结果如图4和表4所示。随着免疫次数的增多,小鼠血清效价逐步提高,四免后4只小鼠的6-FAM多抗效价均高于1∶80 000。选择效价最高的4号小鼠进行腹腔冲击免疫,冲击后第3天测定该鼠的血清效价比四免时更高,已达到1∶320 000。
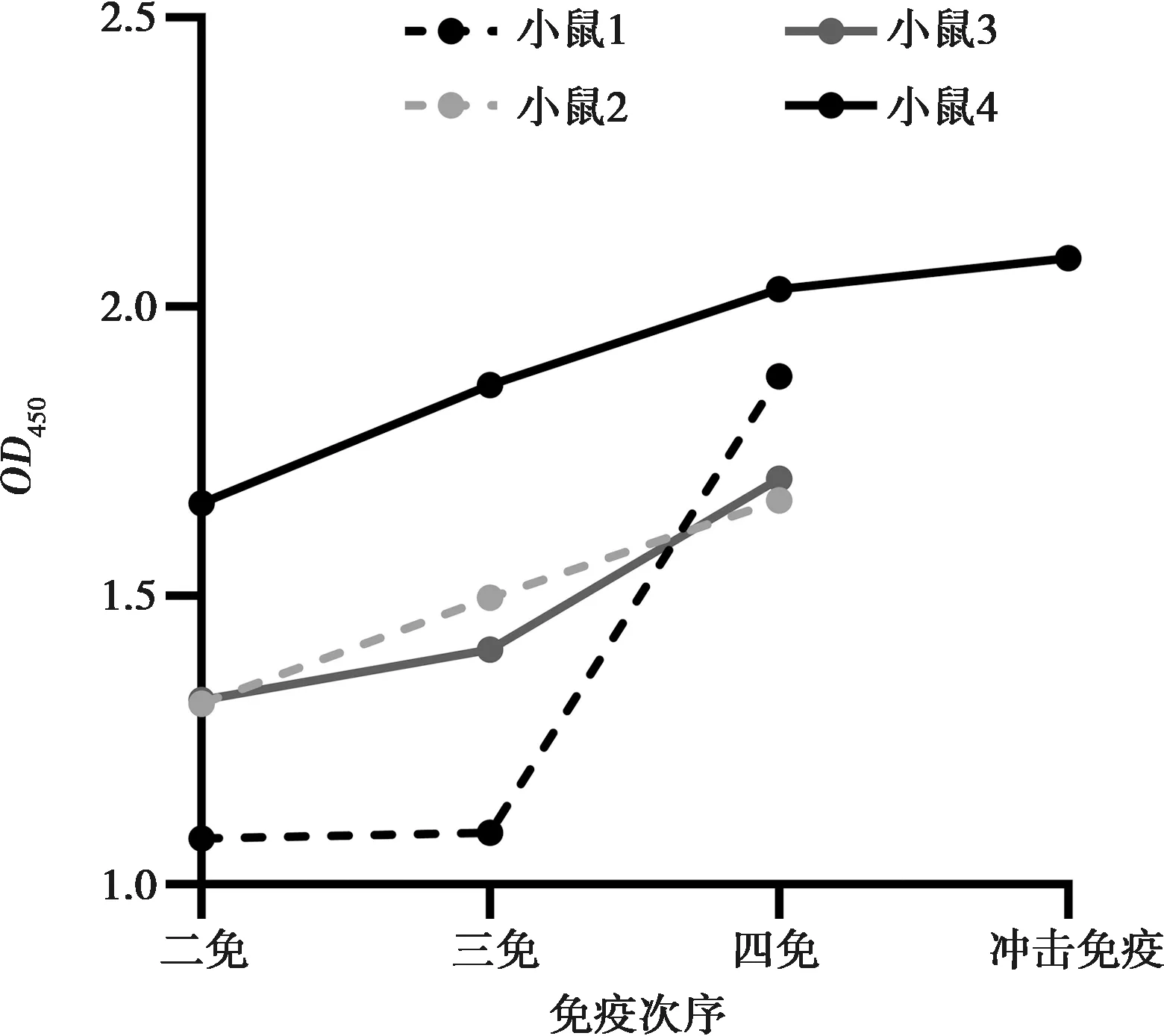
图4 免疫鼠血清(1∶80 000稀释)6-FAM多克隆抗体效价

表4 4号免疫鼠在冲击免疫后第3天的血清效价
2.3 免疫鼠腹水6-FAM单克隆抗体评价
4号免疫鼠的脾细胞与SP2/0融合后经阳性孔鉴定、3次亚克隆后,筛选出阳性率100%、生长状态良好且效价最高的细胞株2d-3 F12株,将该株细胞扩大培养后腹腔注射小鼠、收集单抗腹水。运用间接ELISA测定腹水中6-FAM单克隆抗体的效价,结果见表5,效价达到1∶1 280 000。

表5 免疫鼠腹水6-FAM单克隆抗体效价
抗体亚型测定的结果见表6。鉴定结果表明:6-FAM单克隆抗体的重链为IgG2a型,轻链为Kappa型。
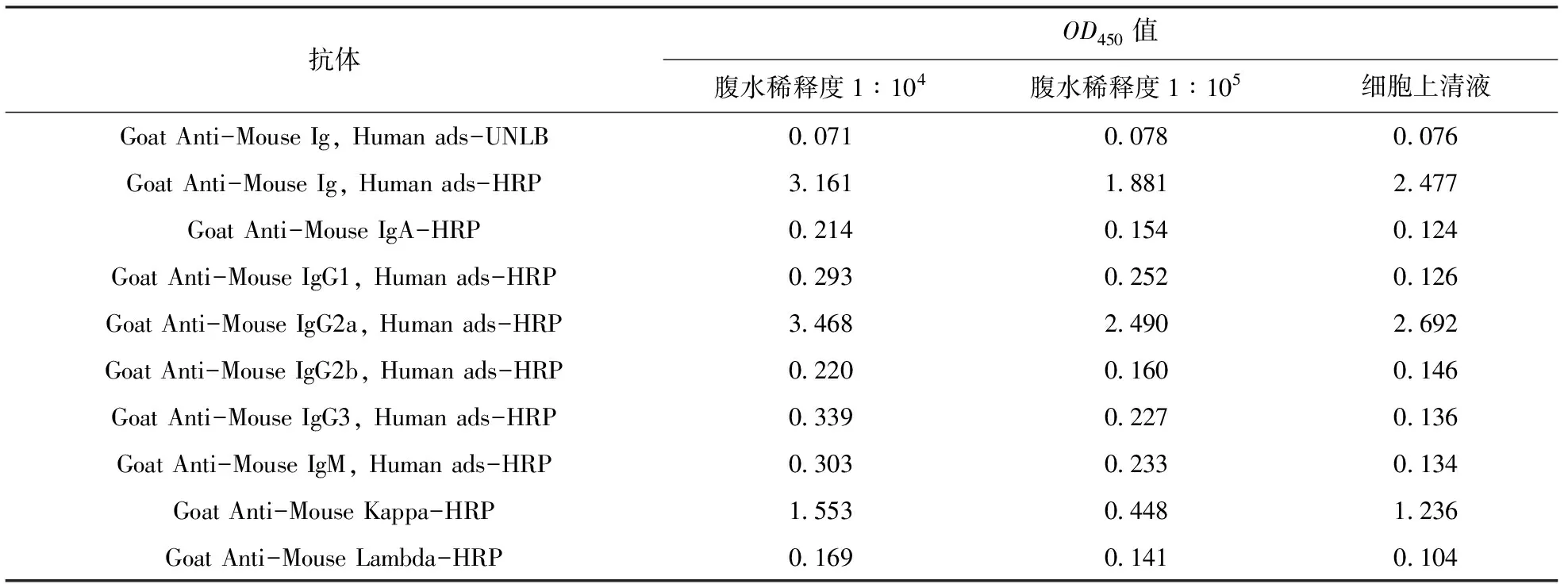
表6 6-FAM单克隆抗体亚型鉴定
腹水抗体使用Protein G琼脂糖抗体纯化柱纯化,测定纯化抗体浓度为0.954 mg/mL。纯化抗体以1∶320倍稀释后浓度为1.99×10-8mol/L,将其倍比稀释至1.52×10-13mol/L,共18个浓度梯度,进行亲和力测定,绘制亲和力曲线,见图5。通过公式计算出该株细胞所分泌的抗体的亲和力常数为5.38×109L/mol,其介于107~1012L/mol之间,属于高亲和力抗体。

cAg单位为μg·mL。
2.4 胶体金与6-FAM纯化单抗最佳标记条件
用高浓度NaCl破坏试验分别考察了胶体金与6-FAM纯化单抗的最佳标记pH值和最佳抗体标记量。如图6所示,当标记pH<7.0时,金标液变浅;当标记pH>8.0时,金标液变紫,金颗粒粒径增大或发生了金颗粒的聚集。由于制备金标抗体时加入封闭液(10% BSA)后会使金标液的pH值降低,通过试验确定了pH=8.0时标记效果更好,因此最佳标记pH值为8.0。

图6 胶体金与6-FAM纯化单抗最佳标记pH值优化结果
如图7所示:当6-FAM单抗标记量<10 μg/mL胶体金时,金标液变紫甚至变灰;标记量≥10 μg/mL胶体金时,金标液均呈鲜亮的红色;因此以12 μg/mL胶体金(在最低标记量10 μg/mL胶体金的基础上增加20%[10])为最佳抗体标记量。

图7 胶体金与6-FAM纯化单抗最佳抗体标记量优化结果
2.5 胶体金胶体金免疫层析试纸条链霉亲和素线最佳包被缓冲液
理论上模拟阳性样本的T线和C线均为红色条带。模拟阴性样本仅C线呈红色,图8中T线包被液优化结果显示,使用包被液Ⅰ、Ⅳ的T线均较浅,包被液Ⅲ的T线肉眼不可见,而包被液Ⅱ所对应的T线条带最为清晰,因此,包被液Ⅱ为最佳的包被缓冲液。

+为阳性样本,-为阴性结果;下同。
2.6 胶体金免疫层析试纸条对RPA nfo反应产物检测的可用性试验
同上,阳性样本的GICS结果能观察到红色的T线和C线,阴性样本的GICS结果仅能观察到红色的C线,其他情况则说明结果不可靠。如图9所示:使用层析液B和C均能使阳性样本的GICS结果呈阳性、阴性样本的GICS结果呈阴性;相同时间下层析液C对应的SA条带最明显;而阴性样本使用层析液A结果呈假阳性。因此,以层析液C为最佳层析液。
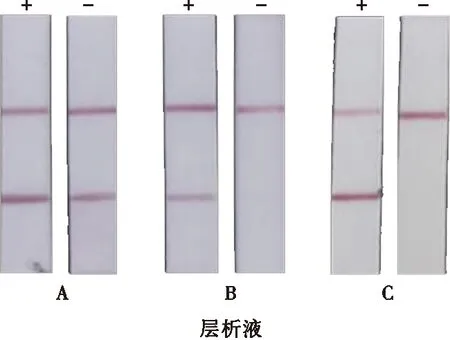
图9 最佳层析液确定
确立最佳层析液后,对T线包被浓度进行了优化,见图10。当SA包被浓度为0.5 mg/mL时,条带较浅,随着浓度升高,条带颜色加深。包被浓度为1 mg/mL和1.5 mg/mL时,肉眼观察它们的条带颜色无明显差别,为降低成本,以1 mg/mL为最佳T线包被浓度。

图10 最佳T线包被浓度确定
在1 mg/mL T线最佳包被浓度下,又先后优化了反应产物用量及金标抗体用量2个条件。如图11所示:不同反应产物用量均能观察到较为清晰的条带,2 μL的条带色度<5 μL的条带色度,约等于8 μL的条带色度。金标抗体用量同样考察了3个梯度,结果如图12。加入5 μL金标抗体时,C线条带较浅;加入15 μL金标抗体时,背景颜色略深,而加入10 μL金标抗体时背景颜色浅且条带清晰,易于观察。最终选择最佳反应产物用量为5 μL、最佳金标抗体用量为10 μL。

图11 最佳RPA nfo反应产物用量确定

图12 最佳金标抗体用量确定
条件优化后,使用T线和羊抗鼠IgG线均为1 mg/mL包被的试纸条,以5 μL最佳反应产物用量、10 μL最佳金标抗体用量,使用自主研发的试纸条检测不同拷贝数模板的RPA nfo反应产物,并与商品化试纸条的检测结果进行对比,结果如图13。两者对RPA nfo反应产物可视化判定的结果一致,条带清晰易判定,即质粒模板的每微升拷贝数≥1时,T线有明显的条带呈阳性,每微升拷贝数<1时,T线无条带呈现,且以超纯水为模板的阴性样本T线无条带呈阴性,与理论相符。试验结果表明,建立的派氏异尖线虫RPA nfo-自制的GICS相配套的检测方法的灵敏度为每微比拷贝数≥1,与RPA nfo-GICS(商品化)的检测灵敏度相同,自主研发的试纸条能替代商品化试纸条实现对RPA nfo反应产物的检测结果可视化。
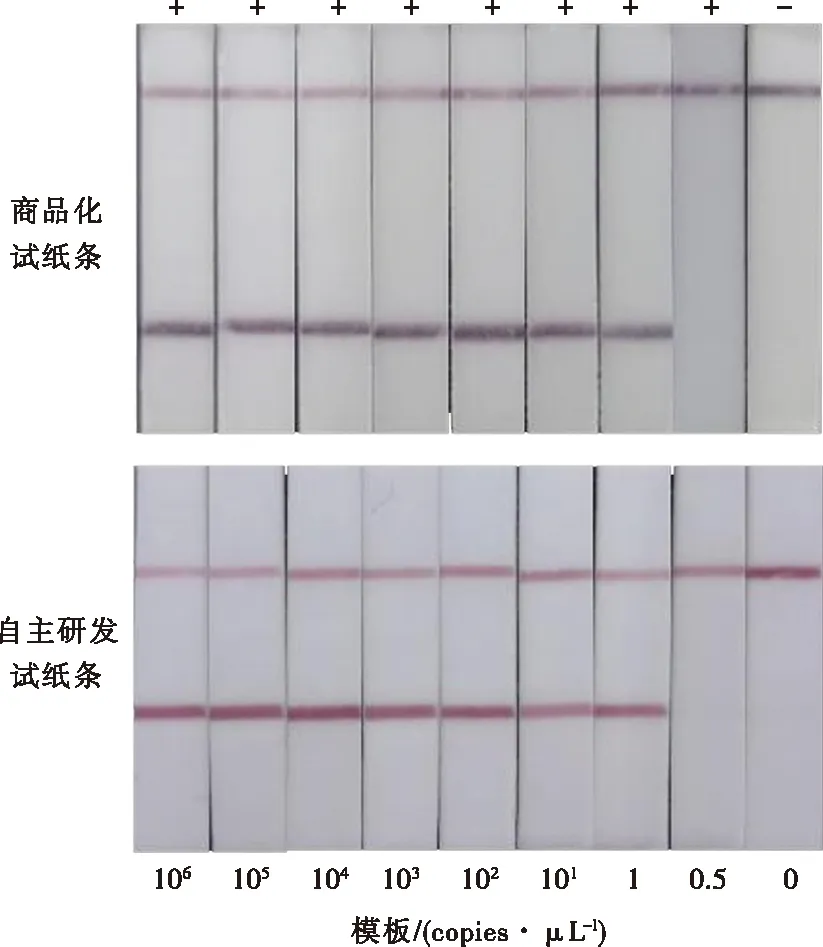
图13 自主研发试纸条与商品化试纸条RPA nfo反应产物可视化结果对比
3 讨论
本研究在6-FAM单克隆抗体制备的基础上,分别利用6-FAM与6-FAM单抗、生物素与链霉亲和素[11]之间的特异性结合作用,研制了能检测RPA nfo反应产物的胶体金免疫层析试纸条。由于6-FAM是小分子半抗原,不具有免疫原性,需要连接载体蛋白形成完全抗原后才能在免疫动物体内产生相应的抗体[12]。由于6-FAM修饰核酸的方式通常是在DNA与6-FAM的6-COOH之间形成六个或十二个碳的“间隔臂”[13],本文运用活性酯法制备的完全抗原在6-FAM与BSA或OVA之间偶联了六碳的1,2-双(2-氨基乙氧基)乙烷,一方面避免了大分子蛋白质的空间位阻对小分子抗原的影响,同时使完全抗原的结构尽可能与6-FAM标记核酸的结构接近,保证所制备的单克隆抗体能准确识别其中的6-FAM。少量多次免疫完全免疫原6-FAM-1-BSA的小鼠均获得了1∶80 000以上的效价,运用杂交瘤法融合免疫鼠脾细胞与SP2/0,经阳性孔筛选、亚克隆、扩大培养、小鼠诱生腹水等步骤获取了高亲和力6-FAM单克隆抗体,其效价达到1∶1 280 000,亲和力常数为5.38×109L/mol,使用该株单抗与胶体金偶联制备了金标6-FAM单抗,为GICS的开发奠定了坚实的基础。
在实际核酸样本检测时,只需要设计RPA nfo的上、下游引物及探针,并使用RPA nfo试剂盒和自主研发的试纸条,就能对靶基因进行快速扩增及可视化检测[14]。本文使用派氏异尖线虫ITS区的上游引物、5′端和3′端分别标记6-FAM和C3 Spacer的探针(距离3′端第16个碱基修饰为dSpacer)及5′端标记生物素的下游引物,DNA模板经RPA nfo试剂盒反应后获得阳性样本,扩增产物两端带有6-FAM和生物素。扩增产物与金标6-FAM单抗混合后形成金标6-FAM单抗-(6-FAM-DNA-生物素)复合物,层析液经过GICS的T线时,复合物上的生物素被链霉亲和素捕获;继续层析时未反应的金标6-FAM与C线的羊抗鼠IgG结合,T线和C线均呈明显的红色条带。使用该试纸条对实际样本进行初步检测,在上样后5 min内即可肉眼观察到清晰、明确的检测结果,与商品化试纸条相比,对阳性或阴性反应的判定结果一致,均能检测≥1 copy/μL模板的阳性样本,灵敏度高,自主研发的试纸条能替代商品化试纸条,初步实现了RPA nfo-GICS的国产化,为今后继续自主研发RPA nfo试剂盒,建立完整的RPA nfo-GICS体系奠定了基础。

