2 株紫花苜蓿解钾菌的筛选鉴定及其对产量和品质的影响
王彦佳,胡伯昂,陈佳欣,许丽婷,姚琳,冯丽荣,郭长虹*
(1. 黑龙江省分子细胞遗传与遗传育种重点实验室,哈尔滨师范大学生命科学与技术学院,黑龙江 哈尔滨 150000;2. 黑龙江国宏节能环保有限公司,黑龙江 哈尔滨 150028)
钾是植物生长和发育不可缺少的元素[1]。土壤全钾量高于全氮、全磷量,但由钾长石、云母等硅铝酸盐组成的难溶性钾占95%,因而可被植物直接吸收利用的钾非常少[2]。中国缺钾的耕地约占70%,严重缺钾的耕地约占45%[3]。随着中国种植业结构的调整,农作物产量和种植面积不断提高,对钾肥的需求也随之增高[4]。通常通过施加化肥来补充植物对钾的需求,但长期大规模施用化肥可能对土壤产生不利影响,并对环境构成威胁[5]。开发解钾菌生物制剂替代化学钾肥,是解决植物缺钾的一条有利途径。
解钾菌(potassium-solubilizing bacteria, KSB)能够将土壤中难溶性的钾转化为可被植物直接吸收利用的有效钾,从而促进植物生长[6]。Xiao 等[7]从油菜(Brassica campestris)根际筛选出3 株解钾菌,接种后提高了黑麦草(Lolium perenne)的钾含量和生物量。Bakhshandeh 等[8]研究表明,接种解钾菌提高了水稻(Oryza sativa)的根长、叶面积和生物量,增强了水稻的光合作用,促进了水稻幼苗的生长。解钾菌不仅对钾的吸收有积极的作用,还能通过分泌吲哚-3-乙酸(indoleacetic-3-acid, IAA)、产生铁载体,溶解磷酸盐促进植物生长。杨华等[9]分离了6 株解钾菌,促进了植物对钾的吸收,还可通过产生IAA 和铁载体来促进水稻的生长,提高了株高、叶面积、总根长、根冠比和组织钾含量。史静静等[10]研究发现,分离的5 株解钾菌,同时具有较高的溶磷能力,在棉花(Gossypium hirsutum)上施用解钾菌,根系活力、株高、干重得到了显著提高。这些研究表明,解钾菌作为生物菌剂在改善植物生长方面表现出良好的应用前景。
紫花苜蓿(Medicago sativa)是多年生豆科牧草,蛋白含量高,适口性好,被誉为“牧草之王”[11]。紫花苜蓿的种植面积在全球已超过3000 多万hm2[12]。随着中国畜牧业的发展和人们对畜产品需求的增加,紫花苜蓿种植面积不断增加[13]。紫花苜蓿对钾的需求较高,缺钾会导致植株根系发育不良,叶片边缘变黄,生长速度减慢,产量降低[14]。但是,目前对于紫花苜蓿解钾菌的研究还非常有限。
本研究从紫花苜蓿根际土壤中筛选解钾菌,评估其解钾能力及潜在的植物促生特性,包括IAA 合成、铁载体产生和磷酸盐溶解能力,通过盆栽试验分析解钾菌株接种对紫花苜蓿的产量、品质,土壤酶活性和土壤速效钾含量的影响,可为开发解钾微生物制剂,促进紫花苜蓿产业可持续发展提供菌株资源。
1 材料与方法
1.1 土壤样品的采集
2019 年,供试紫花苜蓿根际土取自黑龙江省哈尔滨师范大学农园(45°51′ N,126°32′ E)。将5 株紫花苜蓿连同根际土混匀装入干净保鲜袋中,带回实验室4 ℃保存。
1.2 解钾菌的筛选
参照陈宇丰等[15]的方法从根际土壤中分离细菌。取1 g 紫花苜蓿根际土,加入盛有玻璃珠和99 mL 无菌水的锥形瓶中,在28 ℃摇床上剧烈振荡30 min。采用平板稀释法[16]分离细菌:将土壤样品用无菌水稀释至10-2~10-5浓度梯度,取100 μL 涂布在硅酸盐细菌培养基(silicate bacteria medium)上,倒置于28 ℃恒温培养箱培养2 d,选取有水解圈的单菌落,进行平板划线纯化,反复进行,直至获得纯菌种,并挑取单菌落接种于LB(Luria-Bertani)固体培养基,待菌落长出后于冰箱中4 ℃保存,或制备成甘油菌-80 ℃保存备用。
分别用接种环挑取纯化后的菌株,接种于50 mL 种子液培养基中培养48 h 后在6000 r·min-1下离心10 min弃上清液。收集无培养基的菌体,并用去离子水将菌体悬浮,制成菌悬液(OD600=0.50±0.04)。将菌悬液按5%的接种量,接种于解钾液体培养基中,培养7 d。以等量灭活菌悬液作为对照处理。取解钾液体培养基的发酵液10 mL,加入2 mL 的H2O2并在沸水浴中消化1 h 后用去离子水补足10 mL,在13000 r·min-1下离心5 min,取上清液采用火焰分光光度计法测定钾含量[17],与空白对照对比分析,计算出菌株对钾长石矿粉的分解率。
1.3 菌株鉴定
按照东秀珠等[18]的方法,对筛选出的菌株进行形态特征、吲哚测定、甲基红、伏普、柠檬酸盐、淀粉水解、硫化氢、明胶液化、脲酶、接触酶试验,以及葡萄糖利用和革兰氏染色等生理指标的测定。
采用CTAB/NaCl 方法提取细菌DNA[19],采用细菌16S 通用引物F8(5'-AGAGTTTGATCCTGGCTCAG-3')和R1541(5'-AAGGAGGTGATCCAGCCGCA-3')扩增16S rDNA 基因序列。扩增产物送至生工生物工程(上海)股份有限公司测序,测序结果在NCBI(https://blast.ncbi.nlm. nih.gov/Blast.cgi)进行同源性比较分析,确定亲缘关系,用MEGA 7.0 软件进行系统发育分析,采用 Neighbor-joining 法和 Jukes-Cantor 模型构建系统发育树。
1.4 菌株吲哚乙酸(IAA)合成能力测定
采用Salkowski 比色法测定菌株产 IAA 能力[20]。供试菌株先在DF(Dworkin and Foster)培养液中培养48 h,再取1 mL 转入添加不同浓度色氨酸(L-Trp)的DF 培养液(含0、100、200、500 μg·mL-1)中继续培养48 h,每个菌株3 次重复,取样测菌液OD600处吸光值。其余培养液室温下10000 r·min-1离心,取500 μL 上清液,添加2 mL Salkowski 试剂,室温培养20 min 后,在OD535处测吸光值。
1.5 菌株铁载体合成能力测定
定性试验参照Schwyn 等[21]的方法进行,将已分离保存的细菌接种于铬奥醇CAS(Chrome Azurol Sulphonate)培养基上,28 ℃培养48 h,观察菌落周围的颜色变化,有橘黄色晕圈产生即可产生铁载体。定量检测参照王平等[22]的方法。将可产生橘黄色晕圈的菌株接种于MKB(Modified King’S B)培养基中,28 ℃摇床培养48 h(180 r·min-1);菌液离心,取上清液,以1∶1 的体积比加入CAS 检测液,充分混匀。静置1 h 后,OD630处测吸光值A,以去离子水与CAS 检测液等体积混合测得的Ar 为对照,A/Ar 代表样品中铁载体的相对含量。
1.6 菌株溶磷能力测定
定性试验参照乔策策等[23]的方法进行,将已分离保存的细菌接种于改良的PVK(Pikovskaya)培养基上,于28 ℃培养48 h,观察菌落周围的颜色变化,有透明晕圈产生即可溶解无机磷。定量采用钼锑抗显色法计算有效磷含量[24]。挑选菌株接种到LB 培养基,在10000 r·min-1离心10 min 富集菌体,将菌悬液浓度调至1×108cfu·mL-1,将细菌悬液按1%量接种在20 mL PVK 液体培养基中,以不接菌为对照,平行3 组,在28 ℃,180 r·min-1摇床上培养72 h 后,取发酵液在4 ℃ 10000 r·min-1下离心10 min,取上清液,加5 mL 钼锑抗显色液定容至50 mL,反应30 min,利用722E 型可见光分光光度计(上海元析仪器有限公司)在OD600处测定光密度并计算有效磷含量,减去对照的值即为溶磷量。
1.7 紫花苜蓿盆栽试验
1.7.1 盆栽试验 盆栽试验于2019 年在哈尔滨师范大学重点实验室进行,紫花苜蓿种子表面消毒后,试验设置:对照组CK:无钾长石粉、无解钾菌;处理组1:对照组CK+钾长石粉(CK+K);处理组2:只加解钾菌XLT-4(XLT-4);处理组3:解钾菌XLT-4+钾长石粉(XLT-4+K);处理组4:只加解钾菌XLT-7(XLT-7);处理组5:解钾菌XLT-7+钾长石粉(XLT-7+K)。处理组用XLT-4 和XLT-7 菌悬液(1×108cfu·mL-1)浸种2 h,经无菌水浸泡处理2 h 的为对照(CK)。将对照组和处理组的种子均匀播种于同一规格的花盆中。每盆10 粒种子,室温培养,每天光照8 h,适当浇水保持土壤水分含量。每隔7 d 用50 mL 菌悬液均匀浇灌于幼苗根部周围,对照组用等量无菌水。
1.7.2 样品测定 种苗60 d 后测定紫花苜蓿的株高、根长、地上鲜重、地下鲜重、地上干重、地下干重。采用2,3,5-氯化三苯基四氮唑(TTC)法对根活力进行测定[25],采用火焰分光光度计法、钒钼黄比色法、凯氏定氮法、中性洗涤纤维法、酸性洗涤纤维法测定植株钾含量、磷含量、粗蛋白含量、中、酸性洗涤纤维含量[26-28]。根据《土壤酶及其研究方法》[29]和《土壤农化分析》[30]测定土壤酶活性及土壤速效钾含量。
1.8 数据处理
使用SPSS 23.0(IBM, 美国)对试验数据进行统计学分析。采用T检验和单因素方差分析(ANOVA)进行不同处理组数据的比较分析。不同数据中的误差柱代表标准偏差(standard deviation, SD),不同小写字母代表统计学计算得到的差异显著性(P<0.05)。
2 结果与分析
2.1 解钾菌的分离与筛选
将紫花苜蓿根际土壤接种到硅酸盐细菌培养基上初步分离筛选出26 株可产生水解圈的解钾菌,对26株菌进行摇瓶释钾试验,孵化7 d 后测定菌株的解钾率,从中挑选出解钾率较高的2 株菌,标记为XLT-4、XLT-7,其解钾率分别为10.53%和9.75%(图1)。

图1 从紫花苜蓿根际分离出的解钾菌的解钾能力Fig. 1 Potassium-solubilizing ability of potassiumsolubilizing bacteria isolated from alfalfa rhizosphere
2.2 菌株XLT-4 和XLT-7 的鉴定
XLT-4 菌落呈圆形,不透明,黏稠,边缘整齐,表面光滑湿润,长时间培养可产生黄色色素。XLT-7 菌落圆形,淡黄色或乳白色,微微凸起,边缘光滑整齐。提取细菌XLT-4 和XLT-7 的DNA,进行16S rDNA序列的PCR 扩增,XLT-4 的GenBank 登录号为OQ726246,XLT-7 的GenBank 登录号为OQ726247。经BLAST 比对分析发现,菌株XLT-4 与巨大芽孢杆菌(Priestia megaterium)、阿氏芽孢杆菌(Priestia aryabhattai)、弯曲芽孢杆菌(Priestia flexa)、副弯曲芽孢杆菌(Priestia paraflexa)同属近缘种,序列同源性达99%;菌株XLT-7 与耐寒短杆菌(Peribacillus frigoritolerans)、食丁酸短杆菌(Peribacillus butanolivorans)、卢氏短杆菌(Peribacillus loiseleuriae)、棉籽壳短杆菌(Peribacillus gossypii)的同源性为99%(图2)。基于16S rDNA 和系统进化树分析结果表明,菌株XLT-4 属于芽孢杆菌属(Priestia),XLT-7 属于短杆菌属(Peribacillus)。进一步通过生理生化试验表明,菌株XLT-4 的柠檬酸盐、淀粉水解试验呈阳性,明胶液化呈阴性,革兰氏染色为阳性;菌株XLT-7 的明胶液化呈阳性,柠檬酸盐、淀粉试验呈阴性,革兰氏染色为阳性(表 1)。根据菌落形态特征,16S rDNA 进化树分析及生理生化鉴定,确定菌株XLT-4 和XLT-7 分别为巨大芽孢杆菌和耐寒短杆菌。

图2 分离菌株的16S rDNA 的系统发育树Fig.2 Phylogenetic tree of 16S rDNA of bacterial isolates
2.3 菌株XLT-4 和XLT-7 促生特性分析
两株菌在CAS 和PVK 检测培养基上分别形成了橘黄色和透明的晕圈,即均具有产铁载体和溶磷的能力(图3)。

图3 2 株解钾菌在CAS 和PVK 培养基上进行斑点培养Fig.3 Two strains of potassium solubilizing bacteria were blotted on CAS and PVK medium
进一步对菌株进行了IAA 合成,产铁载体和溶解磷能力的定量测定。随着色氨酸浓度的增加,IAA 的合成水平也随之增加,当色氨酸的浓度达到100、200 和500 μg·mL-1时,菌株XLT-4 和XLT-7 IAA 含量分别为12.37和23.52 μg·mL-1、12.22 和26.90 μg·mL-1、12.32 和28.90 μg·mL-1(图4)。其铁载体的相对含量(A/Ar 值)分别为0.73 和1.16;A/Ar 值越低则铁载体含量越高;菌株XLT-4 和XLT-7 的溶磷量分别为97.45 和116.93 μg·mL-1。两株菌均具有合成IAA、产生铁载体和溶解无机磷的能力。

图4 2 株解钾菌产IAA、铁载体、溶磷能力Fig.4 IAA production, siderophore and phosphorus solubilization capacity of two strains of potassium solubilizing bacteria
2.4 菌株XLT-4 和XLT-7 对紫花苜蓿生物量的影响
通过盆栽试验评价了解钾菌株对紫花苜蓿的促生效果。结果表明,接种XLT-4 和XLT-7 紫花苜蓿的株高、根长分别显著提高了16.22%和13.43%、17.31%和13.15%,地上干鲜重分别显著提高了25.35%和13.17%、28.87% 和19.45%、地下干鲜重分别显著提高了 29.27% 和 20.34%、29.27% 和22.03%(P<0.05)。XLT-4 和XLT-7 及钾长石粉(K)共接种与钾长石粉(K)接种相比紫花苜蓿植株的株高、根长分别显著增加了19.19%和8.56%、19.90%和8.87%,地上干、鲜重分别显著增加了30.26%和15.96%、36.84%和22.55%,地下干鲜重分别显著增加了29.17%和20.97%、33.33%和21.77%(P<0.05)(表 2)。
2.5 菌株XLT-4 和XLT-7 对紫花苜蓿根系活力和品质的影响
与对照相比,接种菌株XLT-4 和XLT-7 根系活力分别显著提高了29.70%和24.75%(图5)、植株钾含量分别显著提高了15.64%和18.24%、磷含量分别显著提高了40.48%和42.86%、粗蛋白含量分别显著提高了67.64%和46.83%、中性洗涤纤维含量分别显著降低了15.41%和13.24%、酸性洗涤纤维含量分别显著降低了15.09%和12.88%(P<0.05)。XLT-4 和XLT-7 及钾长石粉(K)共接种与钾长石粉(K)接种相比,根系活力分别显著提高了49.55%和40.54%、植株钾含量分别显著提高了17.27%和20.91%、磷含量分别显著提高了50.00%和52.08%、粗蛋白含量分别显著提高了37.16%和37.16%,中性洗涤纤维含量分别显著降低了17.50%和16.85%、酸性洗涤纤维含量分别显著降低了16.54%和13.32%(P<0.05)。

表1 XLT-4 和XLT-7 的生理生化特性Table 1 Physiological and biochemical characteristics of XLT-4 and XLT-7
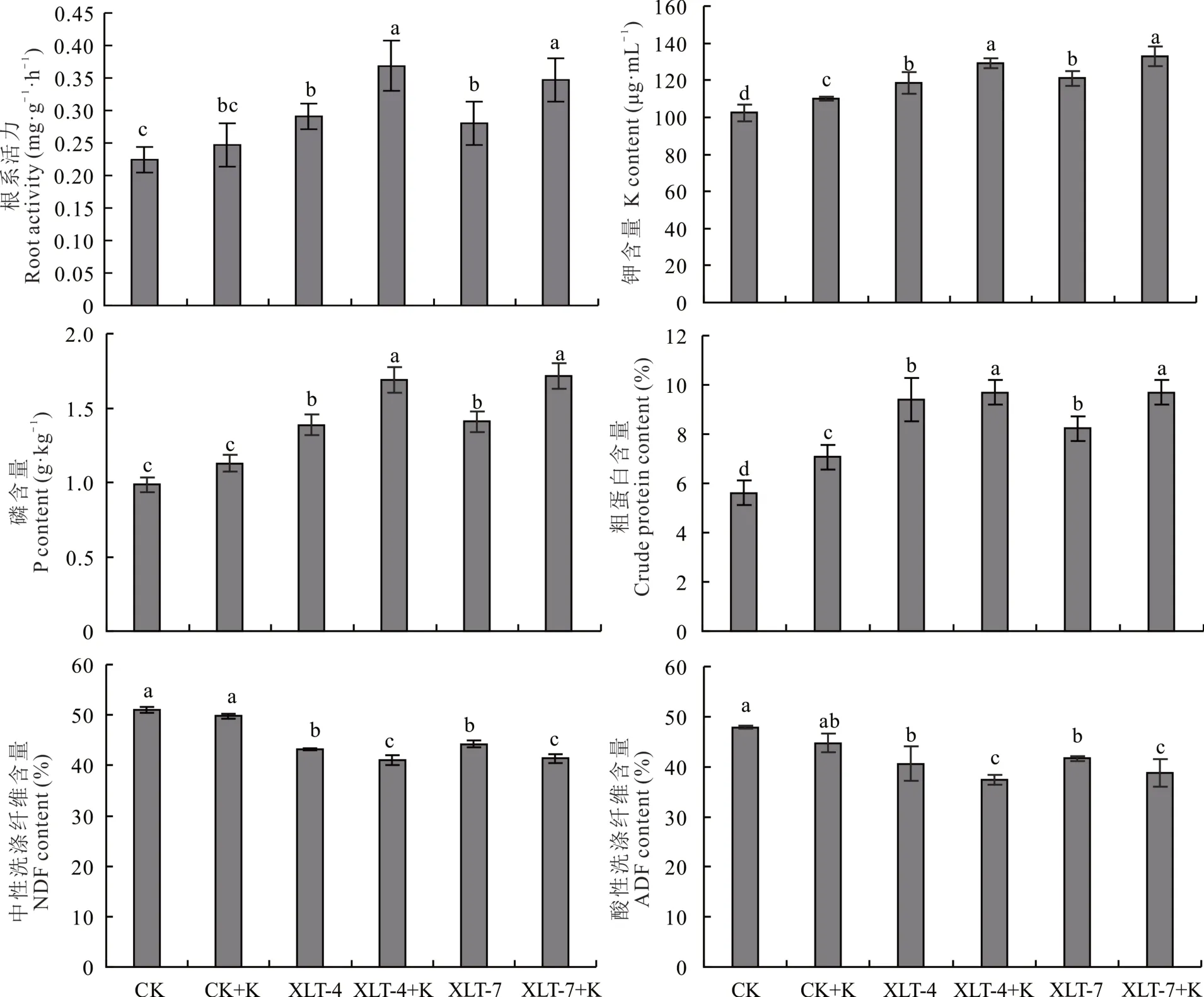
图5 接种2 株解钾菌紫花苜蓿的根系活力、钾、磷、粗蛋白、中性洗涤纤维、酸性洗涤纤维含量Fig. 5 The root activity, K, P, crude protein, neutral detergent fiber (NDF) and acid detergent fiber (ADF) contents of two strains of potassium solution-producing alfalfa were inoculated

表2 解钾菌对紫花苜蓿生物量的影响Table 2 Effects of potassium solubilizing bacteria on biomass of alfalfa
2.6 菌株XLT-4 和XLT-7 对紫花苜蓿根际土壤酶活性及速效钾含量的影响
与对照相比,接种XLT-4 和XLT-7 紫花苜蓿根际土壤脲酶活性分别显著提高了20.17%和24.54%(图6),过氧化氢酶活性分别显著提高了20.69%和27.59%,蔗糖酶活性分别显著提高了24.09%和22.03%,土壤速效钾含量分别显著提高了7.31%和8.19%(P<0.05)。XLT-4 和XLT-7 及钾长石粉(K)共接种与钾长石粉(K)接种相比,土壤脲酶活性分别显著提高了29.16% 和28.41%,过氧化氢酶活性分别显著提高了35.48% 和38.71%,蔗糖酶活性分别显著提高了25.57%和24.14%,土壤速效钾含量分别显著提高了10.29%和9.43%(P<0.05)。

图6 接种2 株解钾菌紫花苜蓿根际土壤脲酶、过氧化氢酶、蔗糖酶活性及速效钾含量Fig. 6 The activity of urease, catalase, sucrase and available potassium content in the rhizosphere soil of alfalfa inoculated with two strains of potassium-solutionizing bacteria
3 讨论
钾是植物生长发育所必需的营养元素,但土壤中大部分的钾以不溶的形式存在,接种解钾菌是提高土壤速效钾含量的重要措施[31]。在过去的研究中,发现了许多具有解钾能力的菌株,易浪波等[32]分离出11 株生长良好的解钾菌,其解钾率为10.03%~11.00%。Raji 等[33]从两个不同石生栖息地植物根际土壤中筛选出15 株能力不同的解钾菌,通过16S rDNA 序列分析,确定出4 株菌株分别与枯草芽孢杆菌(Bacillus subtilis)、蜡样芽孢杆菌(Bacillus cereus)和地衣芽孢杆菌(Bacillus licheniformis)相似。本研究从紫花苜蓿根际土壤中筛选出2 株高效解钾菌XLT-4 和XLT-7,为巨大芽孢杆菌和耐寒短杆菌,具有较强的解钾能力。
2 株解钾菌XLT-4 和XLT-7,均具有产生IAA 和铁载体的能力。IAA 可以刺激根组织的分裂和伸长,促进根系萌发和生长[34]。铁载体可以溶解以氧化物形式存在的难溶性铁,使植物能够吸收,从而促进植物生长[35]。孙科等[36]从牛蒡(Arctium lappa)根际土壤中分离得到1 株具有较强解钾和产IAA 能力的菌株,并通过盆栽试验证明其能够促进宿主植物生长。王欢等[37]从茶树(Camellia sinensis)根际分离到1 株解钾菌GD3,菌株具有产铁载体的特性。本研究选用的2 株解钾菌产生IAA 的同时还具有产铁载体的能力,可能是促进紫花苜蓿生长的原因之一。
解钾菌能作为微生物菌肥促进植物的生长。陈腊等[38]通过田间试验发现,接种解钾菌,显著提高了玉米(Zea mays)拔节期的株高和地上生物量。研究发现,用解钾菌接种马铃薯(Solanum tuberosum),株高和枝条干重显著增加[39]。Biswas 等[40]研究表明,接种解钾菌,显著提高了萝卜(Raphanus sativus)的根长和鲜重。本研究接种菌株XLT-4 和XLT-7,紫花苜蓿株高、根长、地上干鲜重和地下干鲜重较对照组显著增加。说明这2 株解钾菌具有促进紫花苜蓿生长的能力。
植物根系活力和养分吸收能力直接影响地上部分的生物量以及作物的品质[41]。Basak 等[42]研究表明,接种解钾菌提高了猕猴桃(Actinidia chinensis)的根系活力和地上部分果实的产量和品质。磷对植物生长有重要的作用,在植物体内参与光合作用、呼吸作用,磷能促进早期根系的形成和生长,其次磷对蛋白质的合成与分解也起着重要的作用[43]。接种解钾菌G218 与未接种相比,显著提高了薇甘菊(Mikania micrantha)植株的磷含量和钾含量[44]。粗蛋白含量是评价植物营养品质的重要指标[45]。Singh 等[46]报道,施用不同解钾菌显著提高了马铃薯植株磷含量、钾含量和马铃薯块茎中粗蛋白含量。本研究的两株解钾菌在具有解钾能力的同时,均具有溶解磷的能力,可以显著提高紫花苜蓿根系活力、磷、钾和粗蛋白含量。表明接种解钾菌可显著促进植物对钾、磷的吸收,进而提高作物的品质。
土壤酶的类型及酶活性的大小,可以反映土壤中微生物的代谢活动。土壤脲酶活性能够代表土壤的供氮能力,脲酶的增加伴随着土壤氮素的增加,增加根际氮源,促进紫花苜蓿健康生长;土壤过氧化氢酶是一种促进土壤物质能量循环的氧化还原酶,可以反映土壤的呼吸强度;土壤蔗糖酶在碳循环中起着重要作用,促进植物生长和植株养分的吸收[47]。在本研究中,XLT-4 和XLT-7 解钾菌处理后可以显著提高土壤脲酶、过氧化氢酶和蔗糖酶活性。Raghavendra 等[48]研究表明,施用解钾菌CR 显著提高了土壤酶活性,促进养分循环,并提高作物生产力。解钾菌可以改善植物根际微环境,分解土壤矿物中的难溶性钾,提高土壤速效养分含量[49]。本研究接种解钾菌XLT-4 和XLT-7 后紫花苜蓿根际土壤速效钾含量显著提高。万兵兵等[50]研究表明,接种解钾菌后,烟草(Nicotiana tabacum)根际土壤速效钾含量增加了4.72%,本研究结果与其一致。
4 结论
从紫花苜蓿根际土壤中分离出2 株具有很强解钾能力的菌株,分别为巨大芽孢杆菌和耐寒短杆菌。2 株菌株均具有产IAA、铁载体和溶磷的能力。接种2 株解钾菌显著提高了紫花苜蓿的生物量、根系活力和粗蛋白含量,降低了纤维含量,并且提高了根际土壤酶活性和速效钾含量。菌株XLT-4 和XLT-7 可作为开发微生物制剂的优质菌株资源。

