锌、NAC对镉染毒巨噬细胞的保护作用
陈建闪,刘童通,孙子龙,牛瑞燕,刘 慈,王璟璐,马海利,张 鼎
(山西农业大学 动物医学学院,山西 太谷 030801)
镉(Cd)是一种有毒的重金属元素,通常与氧、氯和硫等元素结合形成无机化合物存在于自然界。Cd的高生物毒性、强生物富集性、难降解性等特性使Cd污染对农田生态系统的危害日渐严重[1-2]。Cd随饮食的摄入而进入机体,在机体内的生物半衰期可达10~30年,这进一步造成肝脏、肾脏、肺脏、骨骼及脑等一系列重要器官的毒性损伤,同时引起消化、呼吸、神经、免疫和生殖等系统的功能破坏[3-4]。锌是动物体生命活动的必需元素,可以促进动物体的生长发育、提高免疫功能和促进胃肠消化等。近年来,人们发现锌可以对抗包括重金属在内多种刺激引起的细胞毒性,发挥解毒作用[5]。N-乙酰半胱氨酸(NAC)为天然含硫氨基酸的衍生物,分子中具备含有活性的巯基基团,对各种内源性或外源性氧化损伤起到保护作用。近年的研究表明,NAC不但能够消除自由基,提高机体的抗氧化应激能力,而且可以使趋化因子、炎性细胞因子以及黏附分子产生减少。此外,NAC还在机体的免疫状态与细胞凋亡程序方面起到调节作用[6]。本研究以鸡巨噬细胞为研究对象,采用体外试验观察Cd对鸡巨噬细胞的毒性损伤和免疫功能的影响,并通过单独或联合添加Zn2+、NAC的方式探讨其对Cd染毒巨噬细胞的保护作用及机制,为Cd中毒的预防和治疗提供新的思路。
1 材料与方法
1.1 细胞肉鸡巨噬细胞系(HD-11),由山西农业大学动物生理实验室提供。
1.2 主要试剂及仪器流式细胞仪(BD,美国);荧光定量PCR仪(Bio-Rad,美国);共聚焦荧光显微镜(Olympus,德国)。FITC标记鬼笔环肽(40735ES75)购自翊圣生物科技有限公司;DAPI溶液(即用型)(C0065)购自索莱宝科技有限公司;qPCR试剂盒购自宝生物工程;Annexin V-EGFP/PI细胞凋亡检测试剂盒(KGA101)、活性氧检测试剂盒(KGT010-1)和细胞凋亡线粒体膜电位检测试剂盒(JC-1)(KGA603)均购自凯基生物;葡萄糖酸锌、氯化Cd、NAC购自国药集团。
1.3 方法
1.3.1细胞处理 用含10% FBS的DMEM细胞培养基培养HD-11细胞于T25培养瓶,置于5% CO2、37℃培养箱内。待细胞长满培养瓶底部单层时,消化、传代到6孔板或共聚焦专用玻底培养板中。待6孔板中的细胞长至80%、共聚焦专用玻底培养板中细胞长至50%时,弃去旧培养基,加入一定量新细胞生长液,再分别加入一定量CdCl2、Zn(C6H11O7)2、NAC存储液组成不同的Cd2+、Zn2+、NAC组合,使终浓度Cd2+为20,50 μmol/L,Zn2+为20 μmol/L,NAC为500 μmol/L,置于细胞培养箱中孵育不同时间(6,12 h),收集细胞进行相关检测。
收集用于共聚焦显微镜拍照观察的细胞,共聚焦专用玻底培养板中不同浓度Cd2+、Zn2+、NAC组合处理细胞6 h后,弃掉旧的培养液,PBS洗涤细胞2次,备用;对用于流式检测的细胞,6孔板中不同浓度Cd2+、Zn2+、NAC组合处理细胞6,12 h后,收集旧细胞培养液于5 mL EP管中,用无EDTA的胰蛋白酶消化并收集贴壁细胞,与旧培养液混合,2 000 r/min离心5 min,弃上清,用PBS悬浮细胞并转移到新的1.5 mL EP管中,2 000 r/min洗细胞2次后离心5 min备用。
1.3.2细胞骨架蛋白染色观察 取收集到的共聚焦专用玻底培养板内的细胞,用4%甲醛溶液固定细胞10 min,PBS清洗细胞3次,每次10 min,0.5% Triton X-100溶液透化处理5 min,PBS清洗细胞3次,每次10 min,取200 μL Phalloidin-FITC工作液覆盖住培养板底部的细胞,室温避光孵育30 min,PBS清洗细胞3次,每次5 min,加入200 μL浓度为100 nmol/L的DAPI溶液对细胞核进行复染30 s,PBS洗细胞1次,于细胞表面加入1滴Fluoromount-GTM水溶性封片剂,覆盖细胞,共聚焦显微镜下进行荧光拍照,叠加处理细胞核以及骨架的照片,观察荧光的分布状态,分析Cd2+、Zn2+、NAC及其组合对细胞骨架蛋白的影响。
1.3.3细胞活性氧(ROS)含量的检测 取从6孔板内收集到1.5 mL EP管中的细胞,按照活性氧检测试剂盒(KGT010-1)的说明操作,处理细胞后进行流式细胞仪检测平均荧光强度,分析不同浓度Cd2+、Zn2+、NAC及其组合对细胞内ROS含量的影响。
1.3.4细胞线粒体膜电位(MMP)水平的检测 取从6孔板内收集到1.5 mL EP管中的细胞,按照细胞凋亡线粒体膜电位检测试剂盒(JC-1)(KGA603)的说明操作,处理细胞后进行流式细胞仪检测MMP下降的细胞数,分析不同浓度Cd2+、Zn2+、NAC及其组合对MMP的影响。
1.3.5细胞凋亡率检测 取从6孔板内收集到1.5 mL EP管中的细胞,按照Annexin V-EGFP/PI细胞凋亡检测试剂盒(KGA101)的说明操作,处理细胞后在1 h内进行流式细胞仪检测早、中、晚凋亡细胞的数量,分析不同浓度Cd2+、Zn2+、NAC及其组合对细胞凋亡率的影响。
1.3.6Real-time PCR检测 利用TRIzol法提取用不同浓度Cd2+、Zn2+、NAC及其组合分别处理6,12 h后HD-11细胞的RNA,并反转录成cDNA。依据NCBI基因库查找所需目标基因的mRNA序列,利用Primer Premier 5.0软件设计引物(表1)。采用SYBR Premix Ex TaqTMⅡ(TaKaRa公司,RR820A)试剂盒进行Real-time PCR,反应体系:SYBR Premix Ex Taq (2×) 5.0 μL,ROX Reference Dye(50×)0.2 μL,cDNA 1.0 μL,Primer-S 0.2 μL,Primer-A 0.2 μL,RNase-Free Water 3.4 μL。反应条件:预变性为95℃ 3 min;变性为95℃ 30 s;退火为56℃ 30 s;延伸为72℃ 20 s;总共扩增40个循环。溶解曲线部分反应条件为95℃ 15 s;60℃ 1 min;95℃ 15 s。将对照组模板的基因表达量(拷贝数)设成“1”,分析其他试验组基因的相对表达量。

表1 引物设计

2 结果
2.1 Zn2+、NAC对Cd染毒巨噬细胞结构损伤的抑制作用Cd2+(20 μmol/L)、Zn2+(20 μmol/L)、NAC-(500 μmol/L)不同组合处理细胞6 h后,用FITC标记的鬼笔环肽染色细胞骨架。共聚焦显微镜拍照观察可见,细胞培养基中不加入Cd2+,单独或联合加入 Zn2+、NAC,细胞骨架蛋白的结构没有被破坏,单独加入20 μmol/L Cd2+引起细胞骨架蛋白降解,胞质和胞核出现萎缩。细胞培养基中加入Cd2+的情况下,单独加入Zn2+或NAC,骨架蛋白的破坏程度减弱,联合添加Zn2+和NAC,骨架蛋白的破坏程度进一步减弱(图1)。
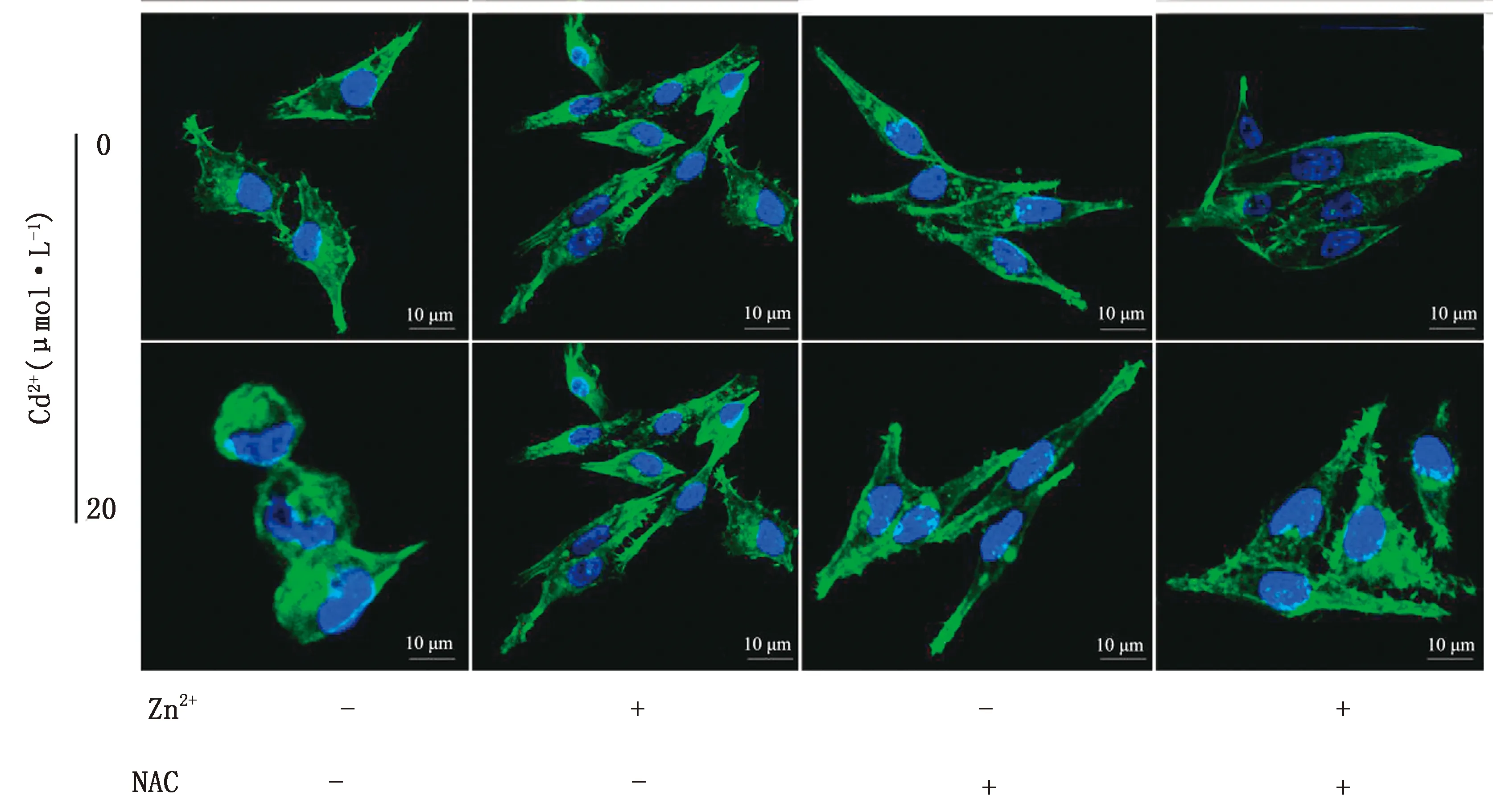
图1 Zn2+、NAC对Cd染毒巨噬细胞骨架的影响
2.2 Zn2+、NAC对Cd染毒巨噬细胞ROS产生的抑制作用流式细胞术检测结果显示,20,50 μmol/L Cd2+作用6 h,细胞中ROS含量迅速上升(P<0.01),且50 μmol/L Cd2+时ROS含量上升的较多,说明ROS含量与攻毒浓度成正相关(图2A)。单独或联合加入Zn2+、NAC均可以显著降低Cd染毒ROS含量(P<0.01),但联合加入的作用比单独加入更明显(图2A)。当作用细胞12 h时,20,50 μmol/L Cd2+染毒细胞中ROS含量均有所增加。细胞培养基中加入20 μmol/L Cd2+的情况下,单独或联合加入Zn2+、NAC均可以极显著降低ROS含量(P<0.01),而且降低效果相近。细胞培养基中加入50 μmol/L Cd2+的情况下,单独加入Zn2+显著降低ROS含量(P<0.05),单独加入NAC后ROS含量极显著降低(P<0.01),联合加入Zn2+和NAC后ROS进一步减少,均低于单独使用Zn2+或NAC(图2B)。
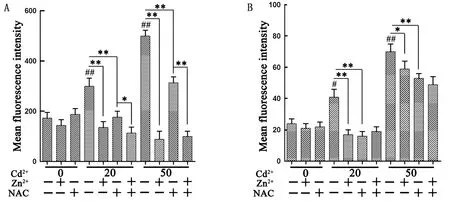
A.作用6 h细胞ROS含量;B.作用12 h细胞ROS含量。与对照组相比,#.P<0.05,##.P<0.01;*.P<0.05,**.P<0.01。下同
2.3 Zn2+、NAC对Cd染毒巨噬细胞MMP水平的影响流式细胞术检测结果显示,20,50 μmol/L Cd2+作用6 h,细胞中MMP水平均降低,且50 μmol/L Cd2+时MMP降低的水平极显著(P<0.01),说明Cd2+引起MMP降低的细胞数成浓度依赖性增加(图3A)。单独或联合加入Zn2+、NAC,低浓度Cd染毒中MMP降低的细胞数显著减少(P<0.05),而高浓度Cd染毒中MMP降低的细胞极显著减少(P<0.01),且单独加入NAC与联合加入Zn2+和NAC的作用相近,均强于单独加入Zn2+的作用(图3A)。当作用细胞12 h,20 μmol/L Cd2+对MMP降低的细胞数变化不明显,50 μmol/L Cd2+对MMP降低的细胞数极显著增加(P<0.01)(图3B)。单独或联合加入Zn2+、NAC可以显著增加高浓度Cd染毒细胞的MMP水平(P<0.05),联合添加Zn2+和NAC的效果比单独添加其中的一种所产生的效果更明显(图3B)。
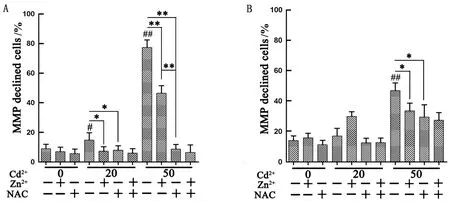
A.作用6 h细胞MMP水平;B.作用12 h细胞MMP水平
2.4 Zn2+、NAC对Cd染毒巨噬细胞凋亡率的影响流式细胞术检测结果显示,细胞培养基中加入20,50 μmol/L Cd2+,细胞凋亡率随Cd2+浓度增加和作用时间的延伸而升高。作用细胞6 h,单独或联合加入Zn2+、NAC时,低浓度Cd染毒细胞总的凋亡率显著降低(P<0.05),且单独加入NAC或联合加入Zn2+和NAC对细胞凋亡率的效果相近。而高浓度Cd染毒细胞的凋亡率极显著降低(P<0.01),联合添加比单独添加对Cd2+的抑制作用更明显(图4A)。当作用细胞12 h,单独或联合加入Zn2+、NAC时,低浓度Cd染毒细胞凋亡率均呈现极显著的下降(P<0.01),且单独加入NAC或联合加入Zn2+和NAC时,细胞凋亡率相似,均高于单独加入Zn2+的凋亡率。而高浓度Cd染毒细胞在单独加入Zn2+或NAC时细胞凋亡率相似,联合添加后细胞凋亡率进一步降低(图4B)。
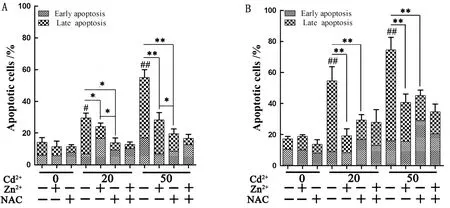
A.作用6 h细胞凋亡率;B.作用12 h细胞凋亡率
2.5 Zn2+、NAC对Cd染毒巨噬细胞细胞因子基因表达的影响荧光定量PCR结果显示,20,50 μmol/L Cd2+作用细胞6(图5A)、12 h(图5B)后,IL-1β基因的表达量均下降,其中作用相同时间,50 μmol/L Cd2+时IL-1β基因表达量进一步下降,而相同浓度的Cd2+,12 h时IL-1β基因表达量进一步下降,这说明Cd2+能够引起IL-1β基因浓度—时间依赖性表达量下降。在培养基中加入Cd2+的情况下,单独添加Zn2+或NAC,IL-1β基因表达量明显增加。与Zn2+和NAC的单独作用相比,两者联合添加后IL-1β基因表达量进一步增加,说明联合加入Zn2+和NAC可以极显著地提升IL-1β基因的表达水平(P<0.01)。50 μmol/L Cd2+作用细胞6 h,IL-8基因表达量显著减少(P<0.01),单独加入Zn2+或NAC能够显著提高Cd染毒细胞IL-8表达(P<0.05),联合加入Zn2+和NAC后,IL-8基因表达量进一步上升(P<0.001)(图5C)。50 μmol/L Cd2+作用细胞12 h后,单独加入Zn2+,IL-8基因的表达量变化不明显,单独加入NAC,IL-8基因的表达量显著上升(P<0.01),联合加入Zn2+和NAC后,IL-8基因的表达量进一步上升,说明联合添加Zn2+和NAC比单独添加其中的一种对Cd2+的抑制作用明显(图5D)。20,50 μmol/L Cd2+作用细胞6 h(图5E)和12 h(图5F)后,IL-10基因的表达量下降。Cd2+作用细胞6 h时,单独加入Zn2+能够显著提高IL-10表达(P<0.01),单独加入NAC对IL-10基因的表达效果不明显,联合加入NAC和Zn2+后IL-10基因表达量进一步上升,且50 μmol/L Cd2+中基因表达量增加幅度比20 μmol/L的高,这说明NAC可以增强Zn2+对IL-10基因的调控作用(图5E)。Cd2+作用细胞12 h时,单独加入Zn2+后IL-10基因的表达量显著上升(P<0.05),单独加入NAC时50 μmol/L Cd2+中IL-10基因表达量极显著上升(P<0.001),联合加入Zn2+和NAC后IL-10基因表达量进一步上升(图5F)。

A、C、E.作用6 h 相关细胞因子基因表达水平;B、D、F.作用12 h 相关细胞因子基因表达水平。与对照组相比,###.P<0.001,***.P<0.001。下同
2.6 Zn2+、NAC对Cd染毒巨噬细胞MT-1、MTF-1基因表达的影响荧光定量PCR结果显示,细胞培养基中单独加入Cd2+或Zn2+,作用细胞6(图6A、C)和12 h(图6B、D)后均可以引起MT-1和MTF-1基因表达量增加,而单独加入NAC对MT-1和MTF-1基因表达量没有明显的促进作用。加入Cd2+的情况下,单独加入Zn2+,2种基因的表达量进一步提高(6 hP<0.01,12 hP<0.05),单独加入NAC,2种基因的表达量变化不明显。与单独添加Zn2+或NAC的促进作用相比,联合添加Zn2+和NAC,MT-1、MTF-1基因的表达量极显著增加,6 h时这种促进作用最明显。
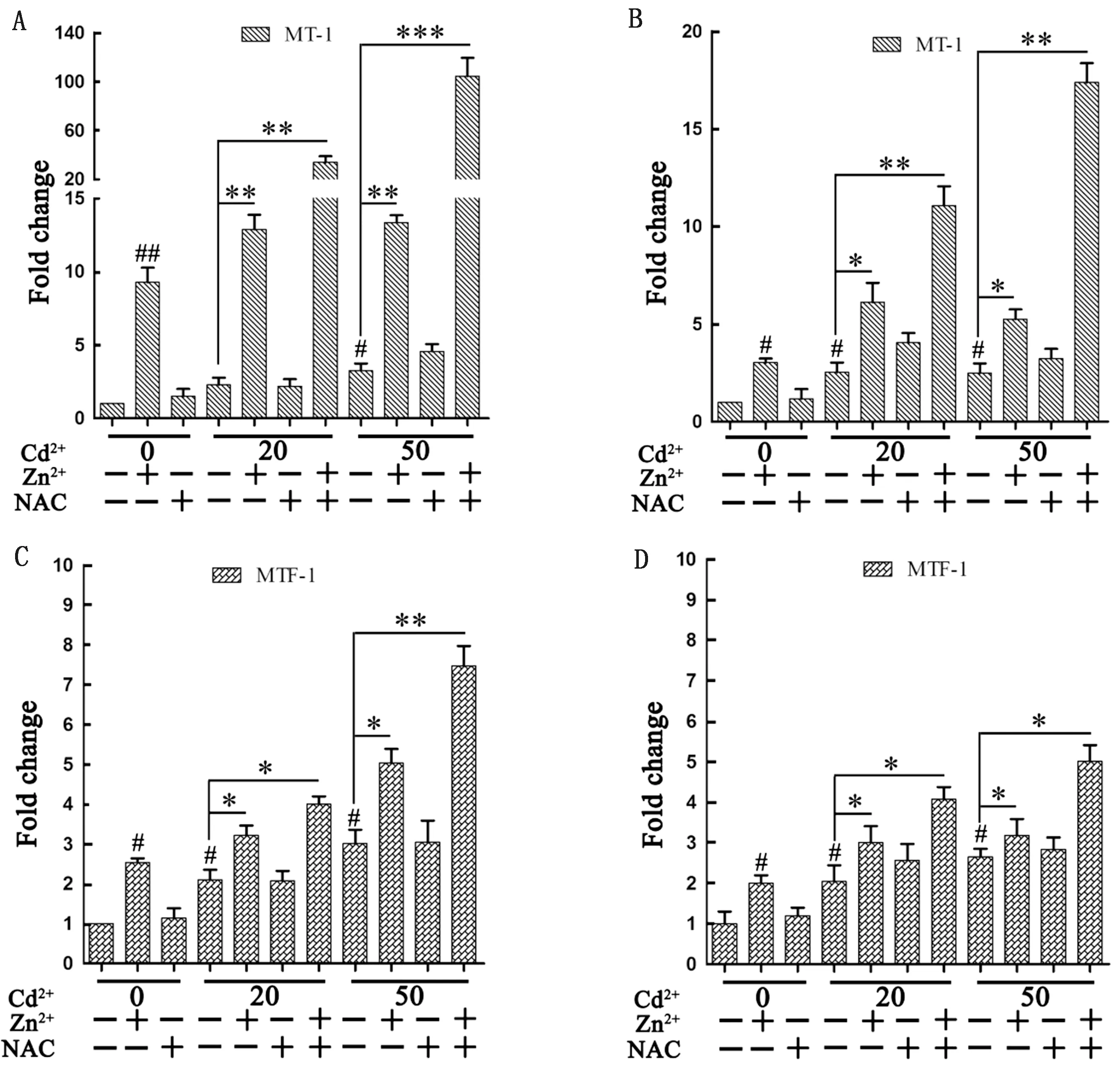
A、C.作用6 h MT-1、MTF-1基因表达水平;B、D.作用12 h MT-1、MTF-1基因表达水平
3 讨论
3.1 Cd对鸡巨噬细胞的毒性损伤Cd对多种细胞的生长和存活具有抑制作用,损伤机理涉及较多方面[7]。张鼎[8]用含有终浓度为10 μmol/L CdCl2的培养基处理牛肾脏上皮细胞,作用6 h后,ROS含量上升、MMP下降的细胞数均增多,细胞的凋亡率显著升高。本研究参考之前的报道,前期预试验分别用含有终浓度为10,20,50和100 μmol/L CdCl2的DMEM培养基培养HD-11细胞,在6,12 h时观察细胞形态,发现作用细胞6 h后20 μmol/L CdCl2引起细胞形态损伤比较明显,而50 μmol/L CdCl2对细胞形态造成显著的损伤,故本研究分别选择含有20,50 μmol/L CdCl2的细胞培养基建立鸡巨噬细胞轻度和重度Cd中毒模型,在不同时间段(6,12 h)分别从细胞骨架、ROS含量、MMP水平、细胞凋亡率以及细胞IL-1β、IL-8、IL-10基因的转录水平这5个方面的影响进行检测,探讨Cd对鸡巨噬细胞毒性损伤和免疫调控的机理。
Cd处理细胞6 h后,细胞骨架中纤维状肌动蛋白(F-actin)结构破坏,蛋白断裂、降解、模糊不清,使细胞核暴露,且损伤程度呈现浓度依赖性。说明F-actin结构的破坏是Cd引起细胞损伤的机制之一。本试验从定量角度分析Cd对ROS含量的影响,结果显示ROS含量随着Cd浓度的增加而持续升高,引起细胞氧化损伤。原因是Cd离子不仅能直接促进ROS产生,还能通过降低还原性蛋白与抗氧化酶的活性间接调控ROS含量。首先,Cd破坏了线粒体呼吸链的正常运作,抑制线粒体的呼吸,导致ROS大量产生[9];其次,侵入机体的Cd与金属硫蛋白(MT)、谷胱甘肽(GSH)等结合使蛋白失去还原性,间接促进ROS含量,使其在细胞内过量聚集[10-11]。同时抑制超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GSH-Px)等的活性,提升丙二醛(MDA)的活性,细胞自由基代谢失衡,导致ROS在细胞内聚积[12]。如此,Cd通过这些方面增加了活性氧的含量,刺激细胞的氧化损伤,介导细胞凋亡。
线粒体是ROS产生的主要场所,据报道,微摩尔水平的Cd就能够影响ROS含量,促进ROS产生,进而破坏线粒体,诱导细胞凋亡[13-14]。当Cd损伤了线粒体之后,ROS大量产生,反过来攻击线粒体,两者之间相互影响。而本研究选取MMP的变化来分析Cd的毒性作用。20,50 μmol/L的Cd处理鸡巨噬细胞后用流式细胞仪检测Cd引起MMP降低的细胞数量,发现随着Cd浓度的增加,MMP降低的细胞数量也增多。结合该试验结果可以说明Cd能够通过损伤线粒体的途径来加重对细胞的损伤程度。
据大量研究表明,Cd能够诱导犬肾脏近端小管、小鼠胸腺细胞等众多细胞发生凋亡[15]。LI等[16]报道,用5 μmol/L的Cd处理大鼠原代肝脏细胞,培养12 h后便可造成细胞核皱缩和破碎,严重时出现调亡小体。本研究检测细胞的早凋和中、晚凋过程,以及总的凋亡率,显示Cd主要影响细胞的中凋和晚凋过程,随着Cd浓度与攻毒时间的延伸,细胞凋亡中期和晚期的凋亡率持续上升,且总的凋亡率也增加。Cd对细胞凋亡的作用机制涉及较多方面,比如本试验中Cd对细胞骨架、ROS含量、线粒体的损伤以及巨噬细胞分泌白介素IL-1β、IL-8和IL-10能力的损伤均能够促进细胞的凋亡,各个方面相互作用,开启细胞的凋亡程序。
3.2 锌对Cd毒性的拮抗作用添加适当浓度的锌可以对细胞产生重要的保护作用,与锌显著的抗氧化作用有关[17],其中锌可以抑制ROS过量产生以及MMP下降,这也是锌抑制Cd毒性的机制之一[18-19]。本研究在HD-11细胞的培养基中单独添加Cd或锌孕育6,12 h,结果Cd、锌均可以促进MT-1基因表达,与之前的报道相符。研究显示,重金属诱导MT-1产生其实是机体对外界应激源的刺激作出的回应,是自身的防御机制,通过增加MT-1的含量来抑制氧化损伤,同时拮抗应激源所产生的毒性[20]。而在Cd组中加入锌之后,MT-1基因的表达量会明显提升,这说明锌可以提升细胞清除ROS的能力,避免线粒体损伤,抵抗Cd的毒性。同时,本研究结果还显示细胞中单独或联合加入Cd和锌,MTF-1基因表达水平的变化趋势与MT-1基因相似,这说明巨噬细胞中MTF-1基因的表达可能会促进MT-1基因的表达。张鼎[8]研究证明Cd和锌单独或联合处理牛肾脏上皮细胞能够引起细胞MTF-1、MT-1基因不同程度的上调表达[8]。本研究结论中锌对Cd毒性的拮抗机理与之前的报道相符。
研究表明,Cd染毒可降低巨噬细胞的吞噬能力、抗原提呈能力和细胞因子分泌能力,最终抑制机体对病原体的免疫应答[21-22],而适量浓度的锌补充可以有效改善Cd对巨噬细胞的免疫损伤[23]。本研究也证实,Zn2+添加可以缓解细胞IL-1β、IL-8和IL-10基因表达量下降的趋势,促进免疫调控。
3.3 NAC对Cd毒性的拮抗作用在相关的研究中,NAC作为一种抗氧化剂可以显著降低 ROS水平,并保护细胞免受死亡[24-25]。本研究也证实在Cd攻毒巨噬细胞中添加500 μmol/L NAC可以抑制Cd对线粒体的损伤、减少ROS含量,进而阻止细胞发生过氧化反应,降低细胞的凋亡率。这可能与NAC的抗氧化性、增加抗氧化酶活性、以及直接结合Cd离子等有关。首先,直接抗氧化是NAC凭借自身的巯基氧化还原生物大分子中的二硫键,消除体内氧自由基,如羟自由基、次氯酸(HOCl)和H2O2等物质来保护生物大分子活性[26]。间接抗氧化是小分子的NAC进入细胞后脱去乙酰基成为合成GSH的前体,促使细胞合成GSH,清除能透过细胞膜并与DNA、氨基酸、蛋白质等多种细胞成分发生反应、损伤机体的过量氧自由基,调整氧化应激水平,降低ROS含量,抑制线粒体损伤。其次,NAC能增加CAT、GSH-Px、SOD等抗氧化酶的活性[27-28],阻止MDA的生成量增加,抑制ROS生成。同时,GSH能结合Cd离子,使有毒的Cd离子转化为无毒的化合态Cd,抑制Cd的毒性,保护细胞自身完整性[29]。本研究结果显示,NAC在一定条件下还能够提高细胞中IL-1β、IL-8和IL-10基因的表达量,恢复巨噬细胞的免疫功能。此外,NAC与Zn2+联合使用能够促进Zn2+对MT-1和MTF-1基因的调控,具体机理需要进一步研究。

