基于低压静电场技术(LVEF)对半滑舌鳎(Cynoglossus semilaevis)的保鲜效果及微生物菌落影响分析*
杨莎莎 谢 超 林 琳 郑 炜 朱亚猛 张海玲
基于低压静电场技术(LVEF)对半滑舌鳎()的保鲜效果及微生物菌落影响分析*
杨莎莎1谢 超1①林 琳1郑 炜1朱亚猛1张海玲2
(1. 浙江省海产品健康危害因素关键技术研究重点实验室 浙江海洋大学食品与药学学院 浙江舟山 316022; 2. 舟山汇丰冷藏物流发展有限公司 浙江舟山 316002)
为研究低压静电场对半滑舌鳎()在贮藏过程中微生物群落特征, 采用高通量测序技术对贮藏至30 d半滑舌鳎的微生物群落碱基信息测序, 产生的碱基序列通过OTU聚类、多样性分析、相关性分析等手段, 探讨影响半滑舌鳎保鲜效果的微生物群落组成和发育信息。研究不同低压静电场(2 000、2 500 V/m)对半滑舌鳎贮藏期间微生物群落组成的影响。结果表明: 半滑舌鳎有效序列范围为76 735~103 583, 平均长度为428.39~429.17 bp, OTU数目在45~218。贮藏期间样品的微生物多样性和相对丰度均有所下降。在门水平上共鉴定出四种微生物菌门, 分别为变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidota)和其他。在属水平上鉴定出11种微生物菌属, 分别为不动杆菌属()、嗜冷杆菌属()、希瓦氏菌属()、环丝菌属()、漫游菌属()、发光杆菌属()、和肉食杆菌属()、假单胞菌属()、无色杆菌属()和其他。贮藏至30 d时, CK组优势腐败菌为环丝菌属, LVEF-1 (2 000 V/m)和LVEF-2 (2 500 V/m)组样品中环丝菌属相对丰度显著上升, 但是低于CK组, 且嗜冷杆菌属和希瓦氏菌属相对丰度仍然占据一定比例。由此推测LVEF能够抑制半滑舌鳎优势腐败菌属相对丰度的增加。研究结果为低压静电场保鲜贮藏半滑舌鳎微生物多样性变化提供了理论基础。
半滑舌鳎(); 低压静电场; 高通量测序; 微生物多样性
半滑舌鳎()属鲽形目(Pleuronectiformes), 舌鳎科(Cynoglossidae), 舌鳎属(), 生长速度快, 适温范围广, 有“皇帝鱼”的美称。以往研究在对比野生和养殖半滑舌鳎肌肉中营养成分时发现, 半滑舌鳎肌肉中不饱和脂肪酸在其肌肉脂肪酸中的占比分别高达41.25%和40.62% (马爱军等, 2006)。研究表明, 不饱和脂肪酸在预防心脑血管疾病(Shiels, 2022)、降血压血脂(Cui, 2017)、抗衰老及促进儿童大脑发育(Ebrahimi, 2019)等方面具有一定功效。吴云辉等(2016)在研究中发现, 低温环境下半滑舌鳎无水保活的成活率较高, 温度越高半滑舌鳎无水保存成活时间越短。李敬等(2016)使用ε-聚赖氨酸、壳聚糖和乳酸链球菌素复合保鲜剂延长了半滑舌鳎贮藏时间, 提升了其贮藏期间的品质。
电场保鲜技术分为高压静电场技术(HVEF) (Zhao, 2023)和低压静电场技术(LVEF)。HVEF电场场强高于2 500 V/m, LVEF电场场强低于2 500 V/m。部分研究理论认为电场保鲜技术可以影响到细胞膜电位效用, 使细胞膜电位发生变化, 进而影响到生物体的生化反应(丹阳等, 2004); 静电场可以与细胞内水分子产生共振, 改变水分子与酶的结合状态, 进而影响到酶活性(Tao, 2015); 有研究认为, 在果蔬的贮藏过程中, 高压电场能够使空气产生微量臭氧和负离子, 这些物质作用于果蔬可以抑制果蔬的呼吸(张敏欢等, 2019)。
研究表明, 一般水产品贮藏后期的优势腐败菌群仅有少数几种, 它们参与了水产品劣化的过程, 是水产品品质腐败的关键菌群(Li, 2022; Nian, 2022; Zhuang, 2023)。而诸如实时定量荧光聚合酶链式反应以及多重聚合酶链式反应等腐败菌的其他分离培养鉴定方法(史恬恬等, 2022), 在检测过程中极易受多重因素干扰, 从而得出偏差判定结论。少数优势腐败菌如、等仅凭传统方法难以对其群落结构加以全面分析(章骞等, 2021)。
目前, 高通量测序技术可以对样品中的微生物菌群分布加以准确反映, 并完成对微生物基因的序列测定, 能够更加精准和全面鉴定样品中微生物的单一或全面基因组, 因此在多学科领域均有所应用, 如畜产品肠道生长菌群研究、人类疾病与健康领域(陶飞燕等, 2021)。在食品领域, 高通量测序技术在发酵食品关键菌属鉴定(Yu, 2022)、酿酒工程菌属鉴定(Hansen, 2023)以及食品冷藏腐败菌数鉴定(Zhang, 2023)等方面均有成功运用案例。除了关注水产品贮藏期间优势腐败菌, 引起食品安全问题的食源性微生物也是我们研究中重点关注的对象(郑双芝等, 2023)。本文基于高通量测序技术对贮藏至30 d半滑舌鳎的微生物群落碱基信息测序, 以期深入探讨影响半滑舌鳎保鲜效果的微生物群落组成和发育基础信息。
1 材料与方法
1.1 实验材料
半滑舌鳎()购于舟山市国际水产城, 平均体长为30 cm。购买后将其放入带有冰袋的泡沫箱内, 30 min内运送至实验室。平均分成三组, 均在–4 °C冰箱中贮藏, 每5 d测定其指标变化。
1.2 实验试剂
实验所需主要试剂包括Fast DNA® Spin Kit (美国MP Biomedicals公司), 琼脂糖(西班牙Biowest公司), MiSeq Reagent Kit v3测序试剂(美国Illumina公司), AxyPrepDNA凝胶回收试剂盒(美国AXYGEN公司)。
1.3 实验设备
实验所用主要仪器设备包括测序仪Illumina Miseq (美国Illumina公司), 蓝色荧光定量系统(美国Promega公司), 旋涡混合器QL-901 (海门其林贝尔仪器制造有限公司), 酶标仪BioTek ELx800 (美国Biotek公司), PCR仪ABI GeneAmp®9700型(美国ABI公司), 研磨仪TL-48R (上海万柏生物科技有限公司)。
1.4 实验处理与方法
1.4.1 样品处理 选取个体大小相似的半滑舌鳎, 蒸馏水冲洗, 无菌棉擦拭表面水分, 分三组。其中对照(CK)组样品为无电场组, 低压静电场-1 (LVEF-1)组样品, 在其上方3 cm处放置放电板, 输出电压为2 000 V, 频率100 Hz; 低压静电场-2 (LVEF-2)组样品, 在其上方3 cm处放置放电板, 输出电压为2 500 V, 频率为100 Hz。选取贮藏第0 (新鲜样品)、15 d和30 d组样品进行后续分析。
1.4.2 高通量测序分析
微生物提取 参考毛俊龙(2022)方法并略作改动。采取10 g半滑舌鳎肌肉, 混入9倍体积灭菌生理盐水, 室温下置于培养摇床(300 r/min)培养1 h, 无菌纱布过滤培养液并用无菌水淋洗样品, 过滤液离心(1 200 r/min) 10 min, 所获沉淀进行后续DNA抽提。
DNA抽提 参照试剂盒说明进行, 对基因组DNA进行抽提后, 采用凝胶电泳(1%琼脂糖)对抽提基因组DNA完整性进行检测, 确认样品准确性。
PCR扩增 根据指定测序区域, 对带有barcode特异引物进行合成后完成PCR扩增(样品均进行3次重复实验), 混合同样本PCR产物并进行凝胶电泳检测(2%琼脂糖), 使用AxyPrepDNA凝胶回收试剂盒(AXYGEN公司)切胶回收PCR产物, Tris-HCl洗脱后以2%琼脂糖电泳对回收PCR产物进行检测。
荧光定量和Illumina文库构建与测序 根据电泳初步定量结果, 将各组半滑舌鳎样品的PCR产物用蓝色荧光定量系统(Promega公司)进行检测定量后根据样本测序量要求, 进行混合。使用NEXTflexTM Rapid DNA-Seq Kit进行建库。利用Illumina公司的Miseq PE300平台进行测序。
生物多样性分析 测序所得原始数据在Illumina平台上进行分析。
1.4.3 菌落总数测定 菌落总数测定参考《食品微生物学检验—菌落总数的测定》(GB 4789.2-2016)。
1.4.4 感官评价 实验选择10名食品专业人员, 经培训后对产品的色泽、形态、质地、滋味风味进行打分, 满分为10分, 最终评分以评价人员的平均分为准。表1为感官评分表。
1.4.5 H.E染色观察分析 选取0、15和30 d样品进行分析, 样品选取鱼肉样品中心部位, 切成1 cm×1 cm×0.5 cm小块, 使用4%多聚甲醛固定液浸泡固定, 室温下过夜, 苏木精-伊红常规染色后, 显微镜下观察肌肉微观结构。
表1 半滑舌鳎感官评分表
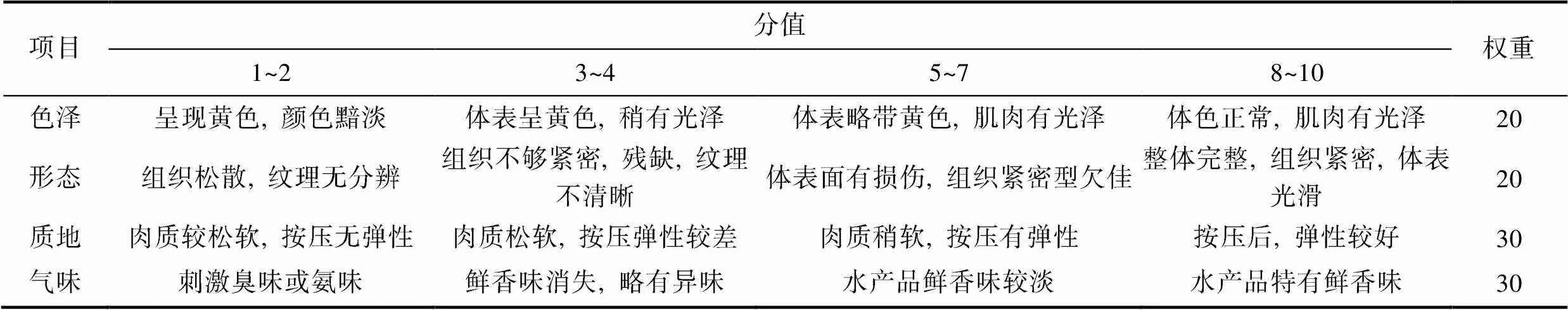
Tab.1 Sensory score of ready-to-eat C. semilaevis
1.5 数据分析
使用Usearch 11统计OTU数目, Qiime 1.9.1分析微生物丰度表, Mothur 1.30.2进行Alpha多样性分析。
2 结果与分析
2.1 低压静电场对半滑舌鳎肌肉菌落总数影响
微生物生长与繁殖是影响半滑舌鳎贮藏期间肌肉品质的重要因素, 贮藏期间各组样品肌肉中菌落总数变化情况如图1所示。半滑舌鳎新鲜样品肌肉中菌落总数为3.62 lg(CFU/g)。随着贮藏时间的延长, 各组样品肌肉中菌落总数呈逐渐上升趋势。贮藏至第30 d时, CK组样品肌肉中菌落总数上升至6.14 lg(CFU/g),表明此时CK组的半滑舌鳎已经腐败变质, 失去其经济价值。LVEF-1和LVEF-2组样品肌肉中菌落总数分别为5.68和5.36 lg(CFU/g), 显著低于CK组(<0.05), 表明LVEF对于微生物生长具有一定的抑制作用。贮藏前15 d时可以观察到, 各组样品肌肉中菌落总数上升速率较缓慢, 贮藏15 d后其菌落总数上升速率较快, 可能是因为贮藏中后期半滑舌鳎肌肉中蛋白质降解, 肌肉组织遭到破坏, 为微生物的生长和繁殖提供了大量营养物质, 致使微生物大量繁殖。此外, 贮藏前20 d时, LVEF-1和LVEF-2组样品肌肉中菌落总数无显著性差异, 说明贮藏前期两种场强对微生物的抑制效果无较大差异。
2.2 低压静电场对半滑舌鳎肌肉感官影响
图2为贮藏期间各组半滑舌鳎肌肉感官评分变化情况。贮藏前期, 各组样品肌肉色泽、形态、质地和气味评分较高。随着贮藏时间延长, 各组样品肌肉颜色逐渐劣化, 样品肌肉表面光泽逐渐暗淡, 由于脂质氧化程度加深导致样品肌肉逐渐发黄, 肌肉逐渐劣化。贮藏前期, 可以观察到样品肌肉硬度和弹性较好, 按压后具有较好回复性, 贮藏末期, 样品肌肉硬度显著下降, 肌肉被按压后无法恢复原状, 此时样品肌肉结构松散, 体表附有黏液并散发出水产品腐败时特有不愉快气味, 此时样品整体可接受度较差, 已经失去经济价值。贮藏至相同时间时, CK组相感官评分显著低于LVEF-1和LVEF-2组(<0.05), 表明LVEF处理能够延缓半滑舌鳎肌肉感官评分的下降。
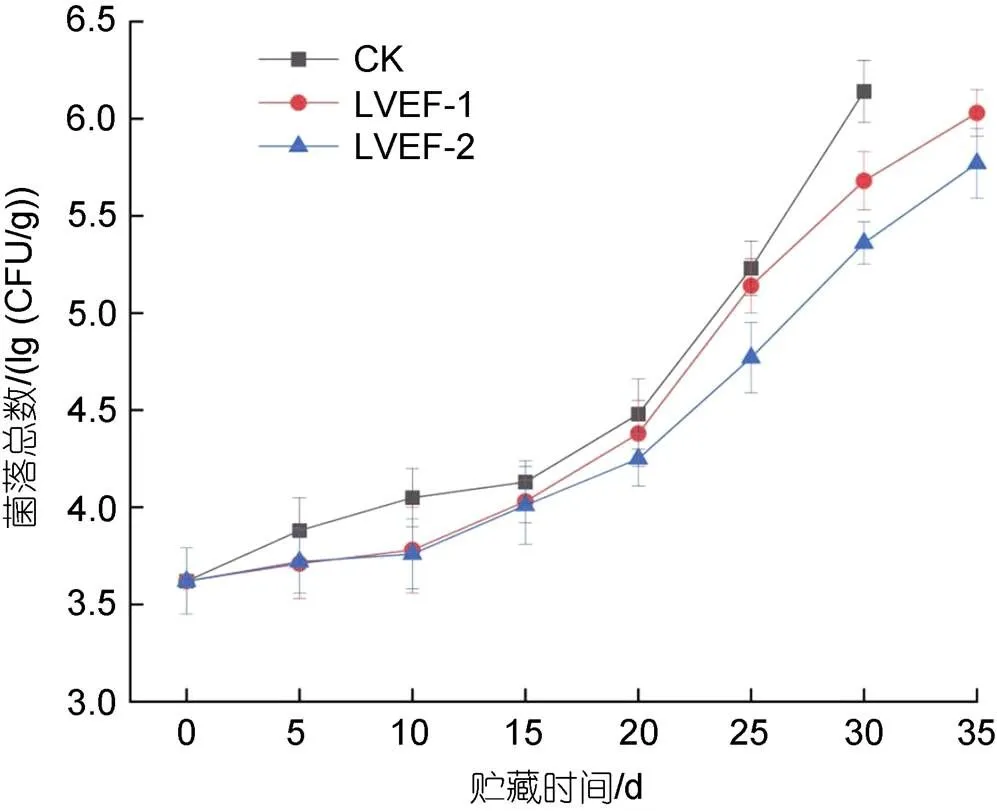
图1 低压静电场对半滑舌鳎肌肉菌落总数影响
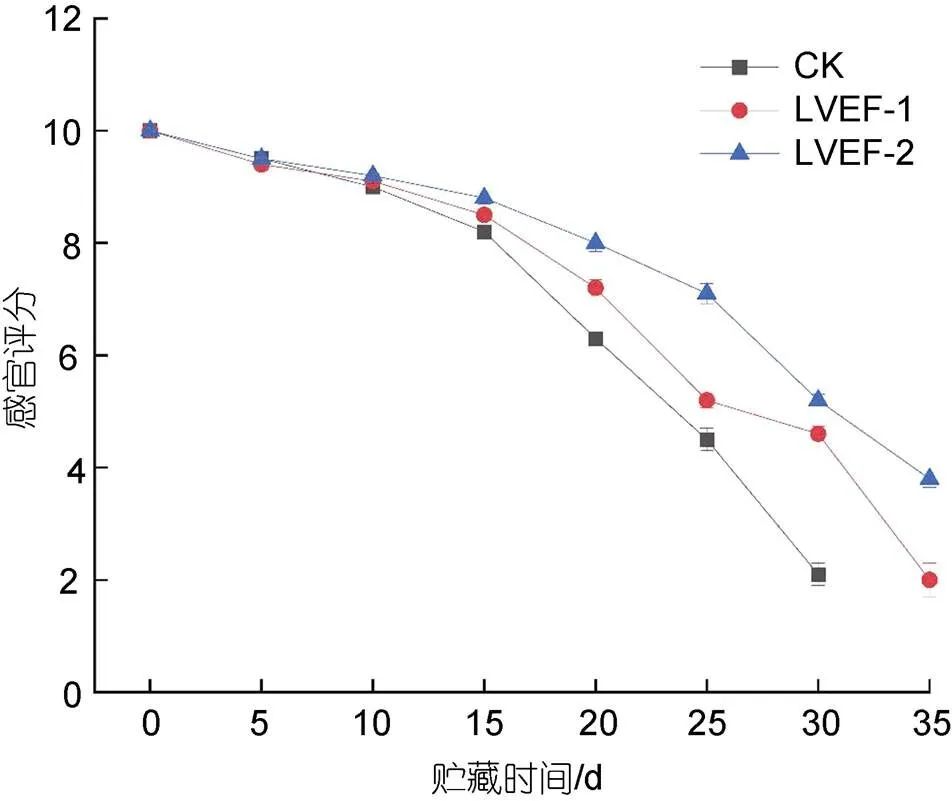
图2 低压静电场对半滑舌鳎肌肉感官评分影响
2.3 半滑舌鳎肌肉微观结构观察分析
图3为贮藏期间各组半滑舌鳎H.E染色图。如图3所示, 新鲜样品肌肉结构较为完整, 其肌肉纤维排列紧密, 细胞间隙较小或排列均匀。贮藏至30 d时, CK组样品肌肉纤维松散, 细胞间隙明显增大, 说明其样品肌肉在贮藏后期遭到严重破坏, 可能是因为微生物的繁殖和蛋白质的降解所导致, 此外, 贮藏期间细胞中冰晶生成也会导致半滑舌鳎肌肉结构被破坏。与CK组相比, LVEF-1和LVEF-2组样品肌肉结构维持相对较好。
2.4 测序信息统计
由表2可知, 贮藏0、15和30 d得各组样品半滑舌鳎有效序列范围为76 735~103 583, 平均长度为428.39~429.17 bp, OTU数目在45~218之间。在贮藏期间, 样品得OTU数为68; 贮藏至第15 d时, CK、LVEF-1和LVEF-2组样品肌肉中OTU数分别上升至135、94和82, 此时LVEF组样品中的OTU数低于CK组, 说明LVEF对于贮藏期间微生物生长具有抑制作用。贮藏至第30 d时, 各组OTU数均有所下降且CK组OTU数高于其他两组, 可能是因为贮藏后期, 样品中的优势腐菌占据较高丰度所致。
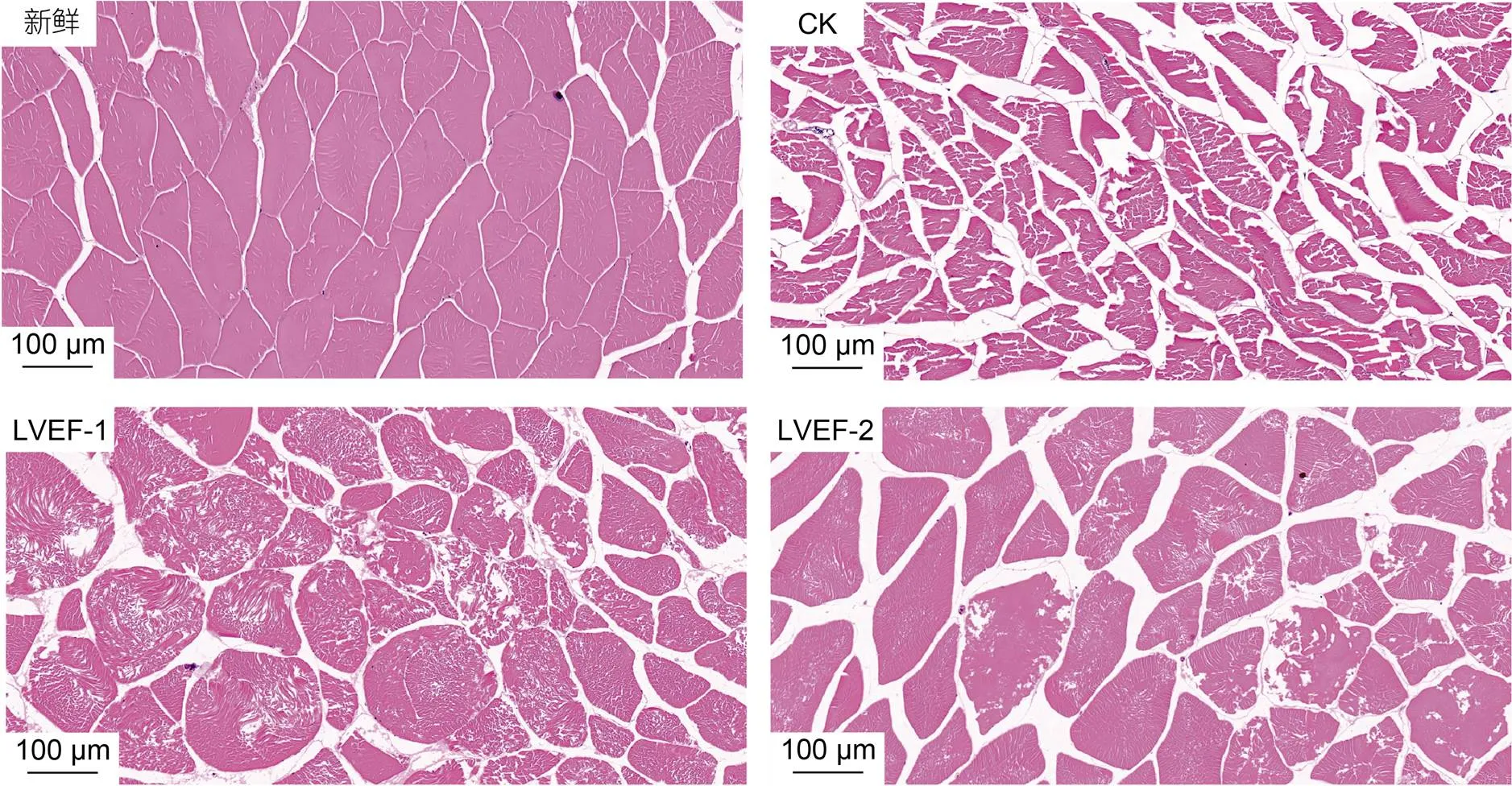
图3 低压静电场对半滑舌鳎肌肉H.E染色图影响
2.5 微生物Alpha多样性分析
表3为贮藏期间半滑舌鳎不同样本微生物Alpha多样性分析表。如表所示, Shannon指数和Simpson指数表示贮藏期间半滑舌鳎样品微生物多样性变化; Ace指数和Chao指数表示贮藏期间半滑舌鳎样品微生物丰度变化; Coverage指数表示样品中低丰度OTU覆盖率从而可以反映测序信息的准确性, 一般来说Coverage指数越高说明数据信息越准确。表3中, 新鲜样品Shannon指数较高, 说明此时样品中微生物多样性较高, 贮藏第30 d时, CK组得Shannon指数仅为低于其他两个实验组, 说明此时CK组样品微生物多样性较低, 我们可以推测此时样品由于腐败变质, 主要微生物为其优势腐败菌。根据Ace指数和Chao指数可以了解到, 贮藏末期微生物丰度较高的是CK组。此外与贮藏15 d时样品相比, 贮藏30 d的各组样品Ace指数和Chao指数均有所下降, 可能是因为贮藏中期微生物多样性和丰度均较高, 随着贮藏时间得延长, 微生物结构发生显著变化, 优势腐败菌逐渐占据菌群优势, 其他菌种逐渐减少或消失, 从而引起了微生物多样性和丰度得变化(吴双慧等, 2023)。
表2 各组样品有效序列与OTU数统计
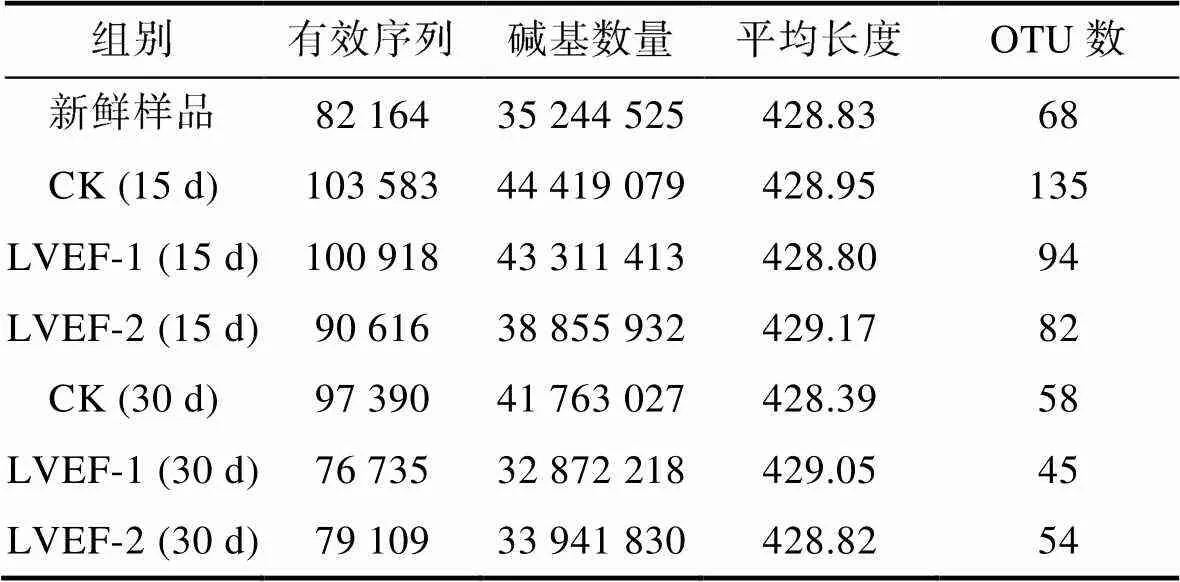
Tab.2 Observed valid sequence and OTU numbers in different groups
表3 贮藏期间半滑舌鳎不同样本微生物Alpha多样性分析
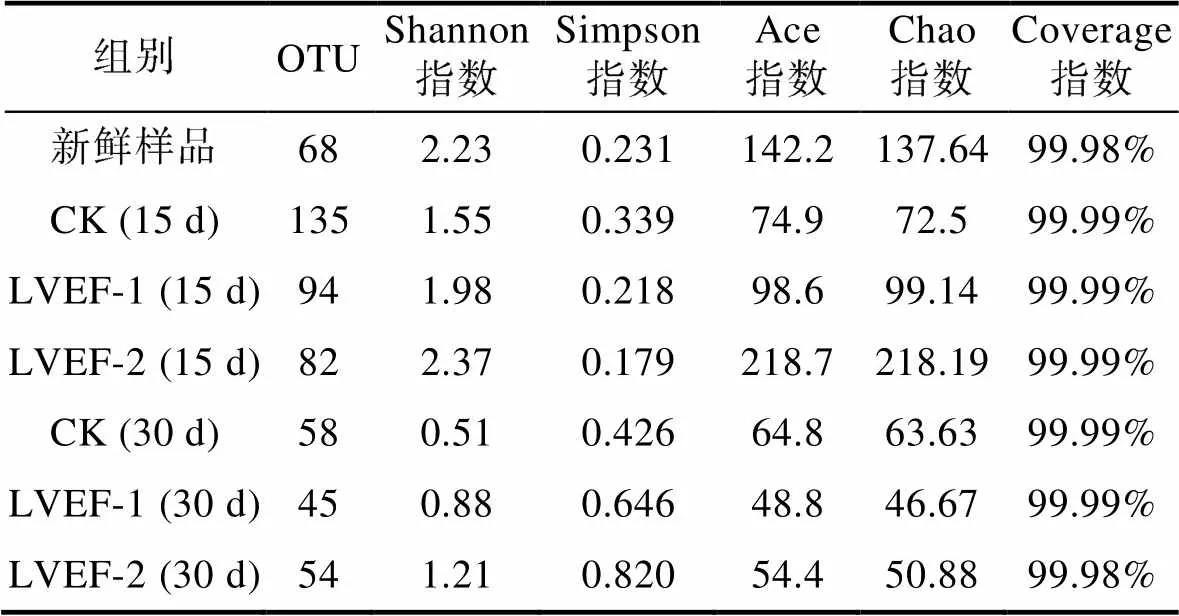
Tab.3 Alpha diversity analysis of different samples of C. semilaevis during storage
2.6 微生物Shannon曲线和Rank-Abundance曲线分析
为了更直观分析各组样品贮藏期间微生物多样性和丰度变化, 绘制了样品微生物Shannon曲线和Rank-Abundance曲线。如图4所示, 贮藏期间各组样本Reads数量>10 000时, 样本曲线接近于0, 说明了测序信息已覆盖所有样本微生物, 其结果较为真实准确(蒋慧丽等, 2021), 新鲜和贮藏15 d的LVEF样品Shannon曲线较高, 贮藏第30 d的CK和LVEF Shannon曲线较高。结果较直观地反映出了各组微生物多样性变化。如图5所示, Rank-Abundance曲线的横坐标是OTU等级, 纵坐标是OTU中序列数的相对百分含量, 它可用来解释多样性的两个方面, 即样品中微生物丰度和微生物分布均匀度。在水平方向上, 曲线越宽表明微生物丰度越高, 反之说明微生物丰度越低, 此外曲线斜率越大说明微生物多样性越高。如图5所示, CK和贮藏第15 d的LVEF-1样本丰度较高; 贮藏30 d时, CK和LVEF-1样本斜率值较高, 水平曲线较小, 说明其多样性和相对丰度较低。
2.7 贮藏期间半滑舌鳎门水平菌群结构分析
对各组半滑舌鳎肌肉微生物进行门水平注释, 选取在门水平丰度>0.01的微生物菌门进行分析, 微生物丰度<0.01的微生物菌门归属为其他, 其结果如图6所示。贮藏期间各组样品微生物菌门共注释到四种, 分别为变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidota)和其他。其中, 新鲜样品肌肉中各微生物均门丰度分别为变形菌门83.74%、厚壁菌门13.28%、拟杆菌门2.44%和其他0.53%。贮藏第15 d时, 各组样品中微生物在门水平丰度发生变化, 此时, CK组变形菌门相对丰度下降至45.51%, 厚壁菌门相对丰度上升至54.15%, 拟杆菌门未检测出; LVEF-1组样品变形菌门和拟杆菌门相对丰度分别下降至79.52%和2.44%, 厚壁菌门相对丰度上升至19.75%; LVEF-2组样品变形菌门和拟杆菌门分别下降至79.52%和1.29%, 厚壁菌门相对丰度上升至26.61%, 由结果可知, 贮藏第15 d时各组样品微生物在门水平丰度均有所变化, 可能是因为随着贮藏时间的延长, 优势腐败菌相对丰度逐渐增大, 抑制了其他菌门的相对丰度。至贮藏第30 d时可以看出, 各组样品微生物菌门结构发生较大改变, 其厚壁菌门相对丰度显著增高, 变形菌门相对丰度显著较少, 此时CK、LVEF-1和LVEF-2组样品厚壁菌门相对丰度分别为92.07%、82.21%和60.23%, 变形菌门分别为7.72%、17.33%和38.96%。由结果可知, 贮藏30 d时, 半滑舌鳎优势腐败菌多为厚壁菌门, LVEF-2组样品中变形菌门相对丰度高于其余两组, 结合前文菌落总数分析说明其品质保鲜效果较好, 优势腐败菌的生长和繁殖尚未达到最高峰值。
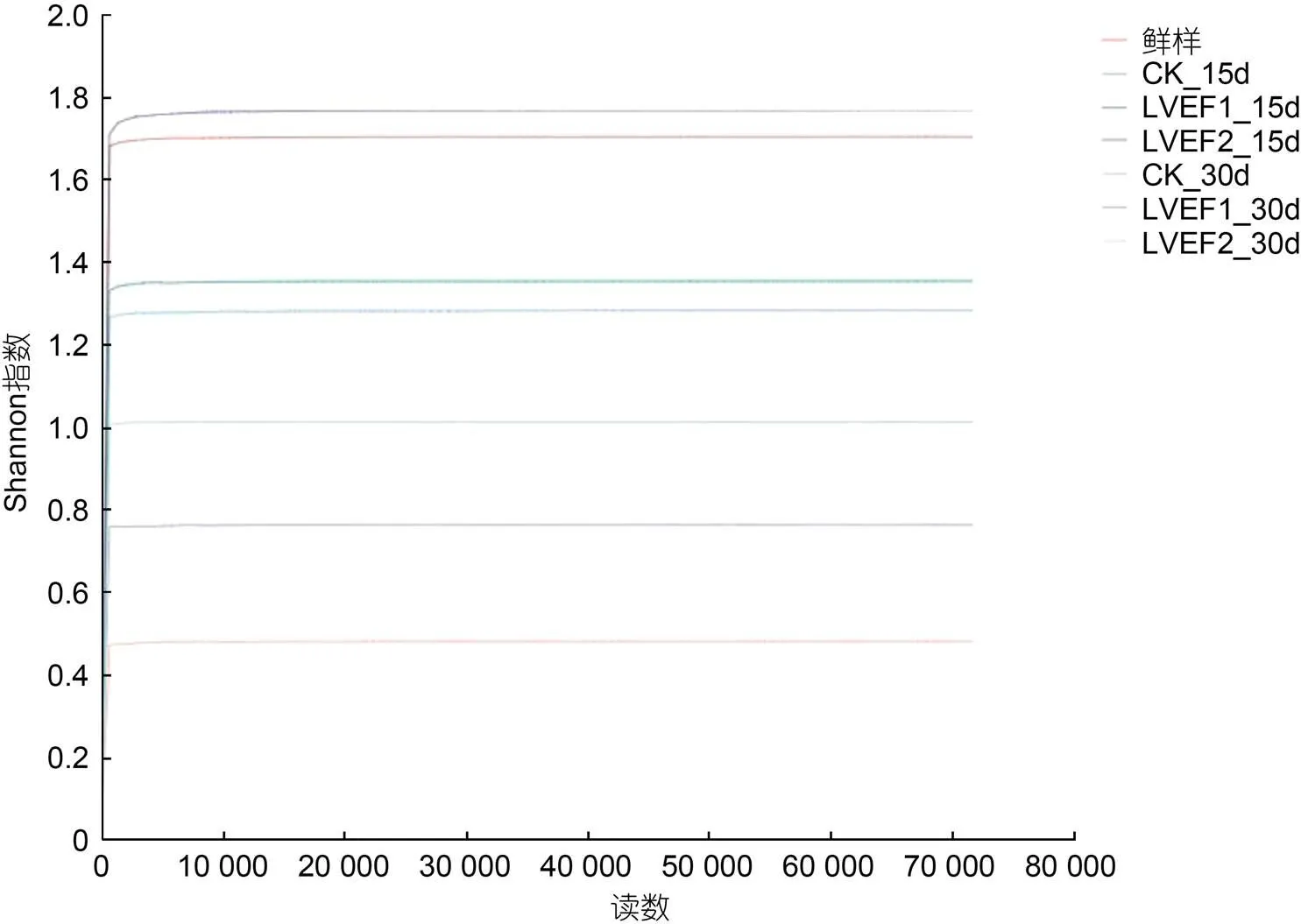
图4 贮藏期间半滑舌鳎微生物Shannon曲线
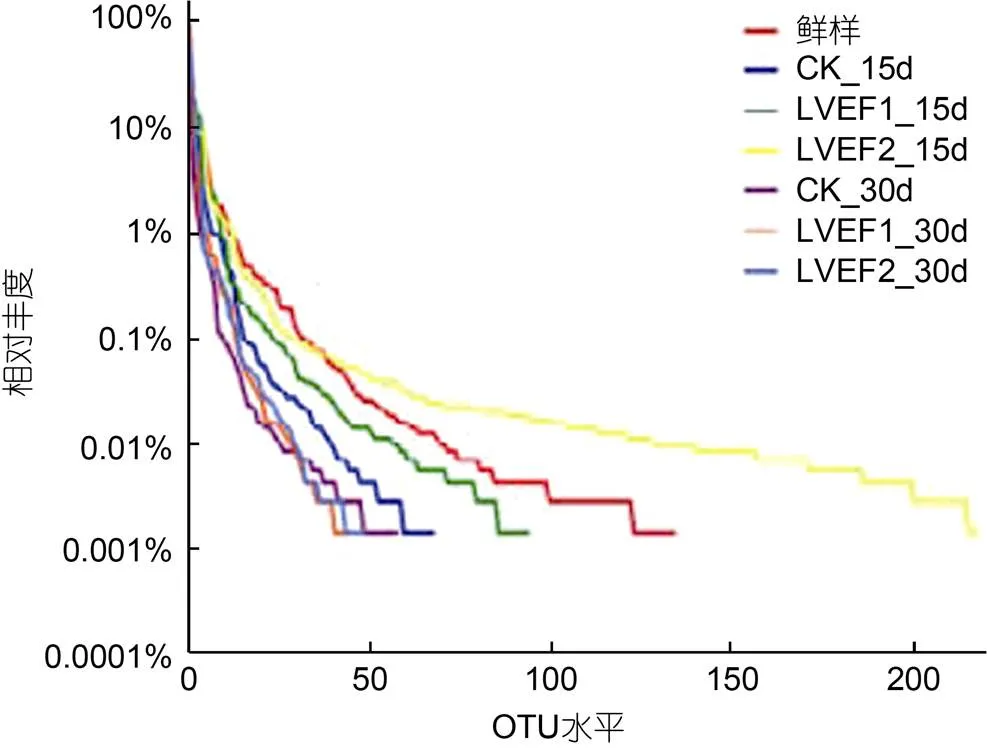
图5 贮藏期间半滑舌鳎微生物Rank-Abundance曲线
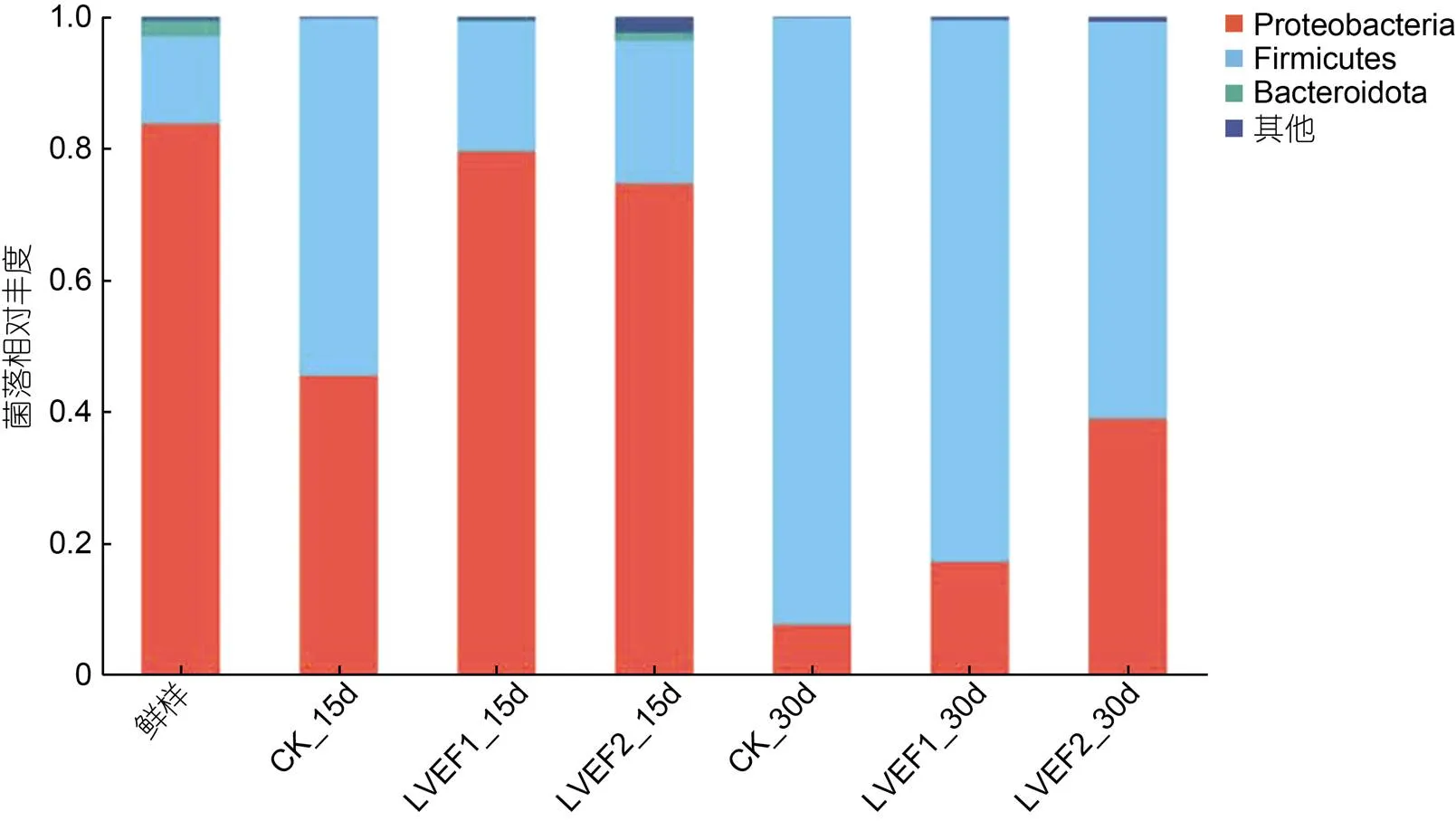
图6 贮藏期间半滑舌鳎微生物菌落组成(门水平)
2.8 贮藏期间半滑舌鳎门属平菌群结构分析
对各组半滑舌鳎肌肉微生物进行属水平注释, 其结果如图7所示。贮藏第0 d时, 新鲜样品中的微生物多样性较高, 共鉴定出9种微生物菌属, 分别为不动杆菌属() 49.25%、嗜冷杆菌属() 19.81%、希瓦氏菌属() 8.90%、环丝菌属() 7.27%、漫游菌属() 4.42%、发光杆菌属() 2.34%、2.25%、肉食杆菌属() 0.49%和其他。贮藏第15 d时, 各组样品中微生物菌属结构发生变化, 其中CK组样品中环丝菌属和嗜冷杆菌属相对丰度分别上升至52.46%和28.22%, 不动杆菌属下降至12.07%; LVEF-1组样品中环丝菌属和嗜冷杆菌属相对丰度分别上升至18.86%和54.52%, 不动杆菌属下降至12.07%; LVEF-2组样品中环丝菌属和嗜冷杆菌属相对丰度分别上升至19.94%和46.94%, 不动杆菌属下降至11.43%, 此外希瓦氏菌属相对丰度有较低程度上升为10.99%; 贮藏至第30 d时, 可以观察到CK组样品环丝菌属相对丰度最高为90.45%, 另外检测到嗜冷杆菌属和希瓦氏菌属占有较低丰度, 从而可以推测贮藏末期, 半滑舌鳎肌肉中的优势腐败菌为环丝菌属, LVEF-1和LVEF-2组样品中环丝菌属相对丰度同样显著上升但是低于CK组, 且嗜冷杆菌属和希瓦氏菌属相对丰度仍然占据一定比例。这说明LVEF抑制了贮藏期间半滑舌鳎优势腐败菌(环丝菌属)的生长。水产品中微生物生长受温度、湿度和营养物质等因素影响较大, 如嗜冷杆菌属具有较好耐寒性, 在整体贮藏期间呈先上升后下降趋势。有研究发现不动杆菌属是水产品贮藏过程中影响其腐败程度的一种菌属(Wang, 2023), 然而在本研究中贮藏后期, 不动杆菌属消失, 环丝菌属显著上升, 说明贮藏后期引起半滑舌鳎肌肉腐败的主要菌属为环丝菌属。
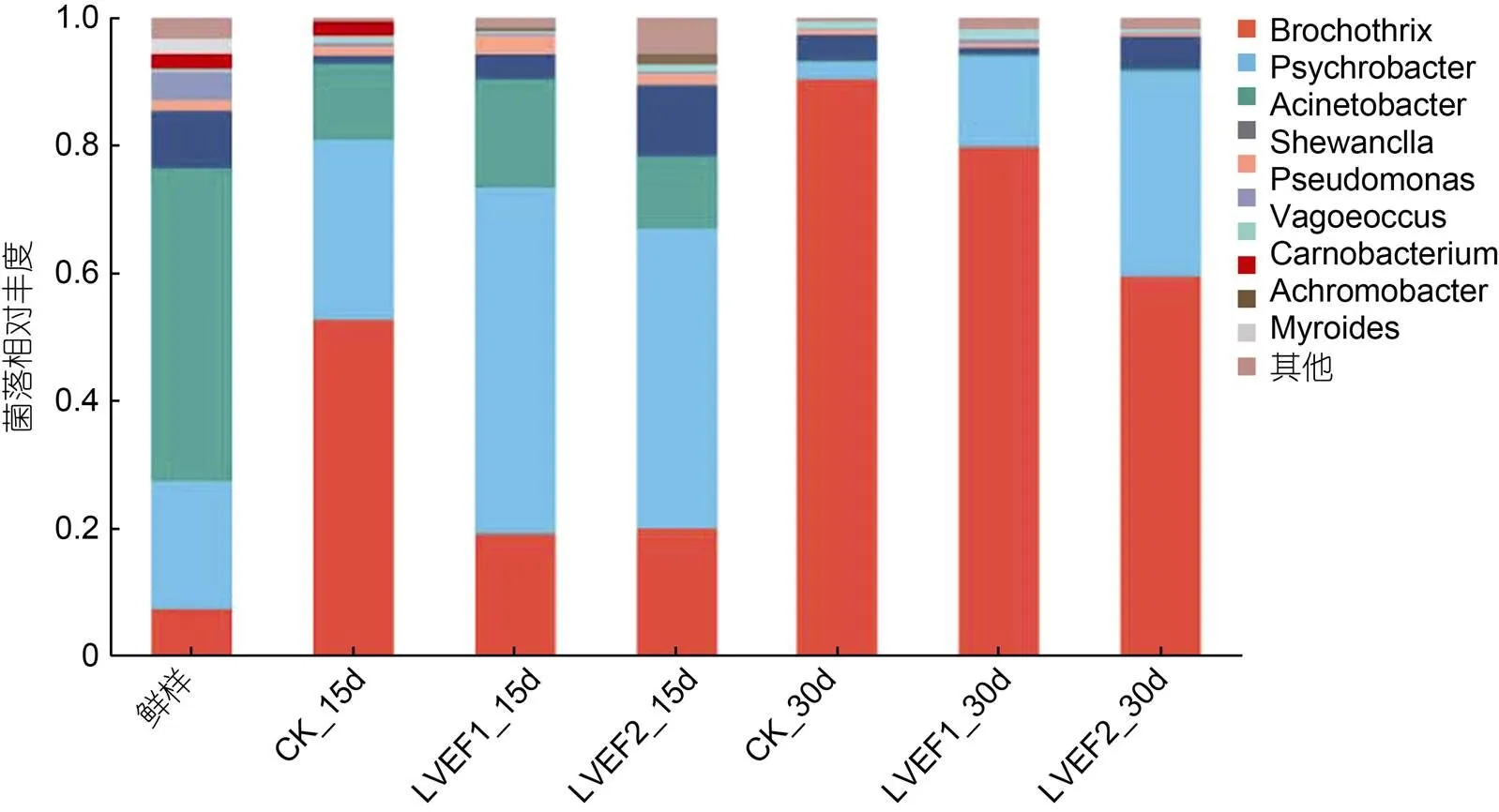
图7 贮藏期间半滑舌鳎微生物菌落组成(属水平)
2.9 贮藏期间半滑舌鳎门微生物β多样性分析
主坐标分析(principal component analysis, PCoA)是将样本数据经过不同距离算法获得样本距离矩阵的投影, 在图形中样本点的距离等于距离矩阵中的差异数据距离; 也就是对样本关系进行低维平面的投影, 可以用于研究样本间的相关程度, 其中两样本之间距离越近表明样本间的相似度越高, 反之则越低(Ding, 2022)。如图8所示, 横坐标PC1的贡献率为73.25%, 纵坐标PC2的贡献率为18.51%, 两个坐标合计贡献率为91.76%, 表明此PCoA图可以反映出样本微生物组成情况。其中, 新鲜组样品距离其他各组较远, 表明其样品中的微生物组成与其他组别具有较大差异, 贮藏第15 d时两个LVEF组样品微生物组成相似度较高, 说明LVEF对半滑舌鳎样品贮藏中期时的微生物具有一定影响。整体来看, 各组样本之间存在较大距离, 说明了贮藏期间各组样品微生物菌群均发生较大变化。
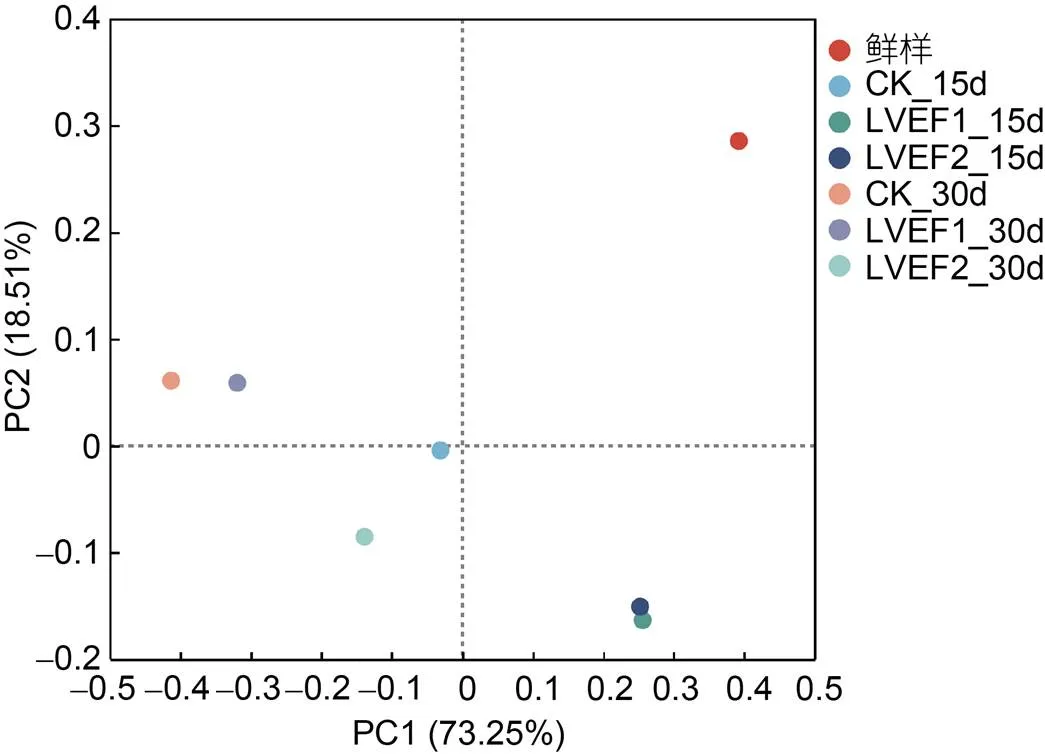
图8 不同贮藏半滑舌鳎样本间主坐标分析(PCoA)
3 结论
通过高通量测序技术对新鲜样本及贮藏第15 d和30 d的CK、LVEF-1和LVEF-2组样本微生物多样性和相对丰度进行分析。结果显示, 各组样品半滑舌鳎有效序列范围为76 735~103 583, 平均长度为428.39~429.17 bp, OTU数目在45~218之间。贮藏期间各组样本的微生物多样性和相对丰度均有所下降。在门水平上, 各组样品共鉴定出四种微生物菌门, 分别为变形菌门、厚壁菌门、拟杆菌门和其他。其中, 新鲜样品和贮藏15 d的各组样品中变形菌门相对丰度较高, 贮藏第30 d时, 各组样品中厚壁菌门相对丰度较高, 其中CK组厚壁菌门相对丰度达到92.07%, 说明贮藏末期半滑舌鳎优势腐败菌门为厚壁菌门。在属水平上, 共鉴定出11中微生物菌属, 分别为不动杆菌属、嗜冷杆菌属、希瓦氏菌属、环丝菌属、漫游菌属、发光杆菌属、、肉食杆菌属、假单胞菌属、无色杆菌属和其他, 贮藏至30 d时, CK组优势腐败菌为环丝菌属, LVEF-1和LVEF-2组样品中环丝菌属相对丰度同样显著上升但是低于CK组, 且嗜冷杆菌属和希瓦氏菌属相对丰度仍然占具一定比例。由此推测LVEF能够抑制半滑舌鳎优势腐败菌属相对丰度的增加。研究结果为低压静电场保鲜贮藏半滑舌鳎微生物多样性变化提供了理论基础。
马爱军, 刘新富, 翟毓秀, 等, 2006. 野生及人工养殖半滑舌鳎肌肉营养成分分析研究[J]. 海洋水产研究, 27(2): 49-54.
毛俊龙, 2022. 茶黄素对大黄鱼贮藏过程中品质特性的影响作用[D]. 舟山: 浙江海洋大学.
丹阳, 李里特, 2004. 高压静电场(HVEF)臭氧产生能力以及所产生臭氧对毛霉菌的抑制作用[J]. 食品工业科技(1): 49-51.
史恬恬, 谢超, 张家玮, 等, 2022. 基于低压变频电场技术对带鱼()保鲜过程中微生物群落影响分析[J]. 海洋与湖沼, 53(1): 133-140.
李敬, 韩冬娇, 刘红英, 2016. 复合生物保鲜剂对半滑舌鳎保鲜效果的研究[J]. 河北农业大学学报, 39(1): 84-88.
吴云辉, 陈慧斌, 叶福财, 等, 2016. 温度对半滑舌鳎无水保活的影响[J]. 食品工业, 37(1): 177-180.
吴双慧, 牛茵, 何济坤, 等, 2023. 基于宏基因组技术分析自然发酵羊肉香肠中微生物多样性及生物胺的代谢[J/OL]. 食品科学: 1-12. (2022-12-30). http://kns.cnki.net/kcms/ detail/ 11.2206.TS.20221229.1918.010.html.
张敏欢, 王莉梅, 王治洲, 等, 2019. 静电场结合自发气调包装对马铃薯贮藏期间的保鲜效果[J]. 食品科学, 40(9): 269-275.
郑双芝, 王晓迪, 张蕾, 等, 2023. 光动力杀菌技术及其杀灭食源性有害微生物的研究进展[J/OL]. 食品与发酵工业: 1-8. (2022-12-06). https://doi.org/10.13995/j.cnki.11-1802/ ts.034189.
陶飞燕, 潘创, 陈胜军, 等, 2021. 基于高通量测序技术分析微冻凡纳滨对虾的微生物[J]. 南方水产科学, 17(2): 104-113.
章骞, 陈宏, 阙华勇, 等, 2021. 长牡蛎()不同组织中蛋白酶的分布及冷藏过程中酶活力与鲜度变化[J]. 海洋与湖沼, 52(4): 1039-1046.
蒋慧丽, 水珊珊, 吴琼静, 等, 2021. 基于高通量测序分析紫贻贝冻藏过程中菌群组成变化[J]. 食品与机械, 37(1): 143-147, 155.
CUI S, ZHOU Q W, WANG X L,, 2017. Immobilization of lipase onto-succinyl-chitosan beads and its application in the enrichment of polyunsaturated fatty acids in fish oil [J]. Journal of Food Biochemistry, 41(5): e12395.
DING Y X, ZHOU T, LIAO Y Q,, 2022. Comparative studies on the physicochemical and volatile flavour properties of traditional deep fried and circulating-air fried hairtail () [J]. Foods, 11(17): 2710.
EBRAHIMI M, RAJION M A, JAFARI S,, 2019. Correction: Effects of dietary-6:-3 polyunsaturated fatty acid ratios on meat quality, carcass characteristics, tissue fatty acid profiles, and expression of lipogenic genes in growing goats [J]. PLoS One, 14(9): e0222678.
HANSEN A Å, LANGSRUD S, CARLEHÖG M,, 2023. CO2packaging increases shelf life through reduction of off-odor production by CO2tolerant bacteria in addition to growth inhibition of the spoilage bacteriota [J]. Food Control, 144: 109390.
LI D P, ZHUANG S, PENG Y K,, 2022. Mechanism of Inosine monophosphate degradation by specific spoilage organism from grass carp in fish juice system [J]. Foods, 11(17): 2672.
NIAN L Y, WANG M J, PAN M,, 2022. A potential spoilage bacteria inactivation approach on frozen fish [J]. Food Chemistry: X, 14: 100335.
SHIELS K, TSOUPRAS A, LORDAN R,, 2022. Anti-inflammatory and antithrombotic properties of polar lipid extracts, rich in unsaturated fatty acids, from the Irish marine cyanobacterium[J]. Journal of Functional Foods, 94: 105124.
TAO X Y, CHEN J, LI L N,, 2015. Influence of pulsed electric field onand[J]. International Journal of Food Properties, 18(7): 1416-1427.
WANG C H, ZHANG R, SUN Y,, 2023. Combinatorial co-expression of xanthine dehydrogenase and chaperone XdhC fromandand their applications in decreasing purine content in food [J]. Food Science and Human Wellness, 12(4): 1343-1350.
YU J, LU K, ZI J W,, 2022. Halophilic bacteria as starter cultures: A new strategy to accelerate fermentation and enhance flavor of shrimp paste [J]. Food Chemistry, 393: 133393.
ZHANG Q, DING Y C, JIA S L,, 2023. Characterization of the action of the lipid oxidation product 4-hydroxyhexenal on, the dominant bacterium in dry-cured fish [J]. Food Bioscience, 51: 102320.
ZHAO Y X, LI L C, GAO S D,, 2023. Postharvest storage properties and quality kinetic models of cherry tomatoes treated by high-voltage electrostatic fields [J]. LWT, 176: 114497.
ZHUANG S, TIAN L, LIU Y Y,, 2023. Amino acid degradation and related quality changes caused by common spoilage bacteria in chill-stored grass carp () [J]. Food Chemistry, 399: 133989.
ANALYSIS OF EFFECT OF LOW VOLTAGE ELECTROSTATIC FIELD ON THE PRESERVATION AND MICROBIAL COMMUNITY STRUCTURE OF
YANG Sha-Sha1, XIE Chao1, LIN Lin1, ZHENG Wei1, ZHU Ya-Meng1, ZHANG Hai-Ling2
(1. Zhejiang Provincial Key Laboratory of Health Risk Factors for Seafood, College of Food and Medicine, Zhejiang Ocean University, Zhoushan 316022, China; 2. Zhoushan HSBC Cold Storage Logistics Development Co. Ltd., Zhoushan 316002, China)
To investigate the effect of different low voltage electrostatic field (2 000 V/m, 2 500 V/m) on microbial changes ofduring storage. High-throughput sequencing techniques were used to determine and analyze samples offrom 0, 15, and 30 d storage. The results showed that the effective sequences of the samples ranged from 76 735~103 583 bp, with an average length of 428.39~429.17 bp and OTU numbers between 45~218. Microbial diversity and relative abundance decreased during storage for all groups of samples. At the phylum level, four microbial phyla were identified in each sample group, namely Proteobacteria, Firmicutes, Bacteroidota, and Others. 11 microbial genera were identified at the genus level. These were,,,,,,,,,, and Others. At 30 d of storage, the dominant spoilage organisms in the CK group were, while the relative abundance ofin samples from the LVEF-1 (2 000 V/m) and LVEF-2 (2 500 V/m) groups increased significantly but was lower than that of CK. The relative abundance of the CK group increased significantly, but was lower than that of the CK group, and the relative abundance ofandstill accounted for a certain proportion. It is assumed that the LVEF treatment was able to suppress the increase in the relative abundance of the dominant spoilage genera in the. The results provide a theoretical basis for the effects of LVEF on microbial diversity and abundance changes during storage of.
; low voltage electrostatic field (LVEF); high-throughput sequencing; bacterial diversity
* 水产品陆海联动冻藏冷链物流贮运与品质监控关键技术及装备研发项目; “十三五”国家重点研发计划重点专项, 2019YFD0901604号。杨莎莎, 硕士研究生, E-mail: 2020033759@qq.com
谢 超, 博士, 副教授, E-mail: xc750205@163.com
2023-06-28,
2023-09-30
TS254; Q789
10.11693/hyhz20230600132

