茅台镇不同海拔酒厂环境可培养酵母多样性分析
王星 谯露 周叶鸣 董醇波 韩燕峰 邹晓







摘要:以中国酱香酒核心产区仁怀市茅台镇为研究区域,探索高温大曲和环境中可培养酵母的物种多样性,以及在不同海拔下的种群结构和相对丰度。结果显示,从高温大曲和环境样品中最终分离474株酵母,鉴定为21属32个种,其中从环境样品中共分离269株酵母,鉴定为19属28个种;从大曲中共分离205株酵母,鉴定为15属18个种。Wickerhamomyces anomalus在环境和大曲中均作为核心酵母菌。环境中分离出的酵母菌多样性指数高于高温大曲。在不同海拔梯度上,环境样品中酵母多样性和丰度差异明显,高温大曲中酵母多样性和丰度差异较小,主要的优势菌群均保持一定的相似性和稳定性。总的来说,海拔500 m以上的酵母菌群落结构较为相似;海拔500~600 m的酵母菌群相对丰度及多样性最高,海拔600 m以上酵母多样性及丰度要低于海拔500 m以下。
关键词:环境;大曲;可培养方法;不同海拔;酵母菌群多样性
中图分类号:TS262.33文献标识码:A
文章编号:1008-0457(2023)06-0065-07国际DOI编码:10.15958/j.cnki.sdnyswxb.2023.06.009
仁怀市位于贵州省西北部,地处赤水河中游,大娄山脉西段北侧[1]。作为中国酱香型白酒的发源地和核心产区,仁怀市有着悠久的酿酒历史、特殊的酿造环境和独特的酿造工艺,代表着酱香白酒酿造的最高水准。酱香白酒作为我国的特色名酒,具有突出浓郁的酒体风格,是世界上最受欢迎的酒类之一[2]。其酿造工艺以“三高三长”著称,即高温制曲、高温堆积、高温蒸馏,大曲贮存时间长、基酒生产周期长、基酒酒龄长[3]。复杂的酿造工艺也造就了其他香型白酒无法比拟的特殊风味[4]。无法复制的酿造环境和常年酿酒所形成的特殊微生物区系也直接影响着发酵的产率和质量[5]。酿造过程微生物群系来源广泛,主要有生产原料、大曲和发酵环境[6]。整个酿酒过程涵盖着细菌、酵母、霉菌等菌群结构复杂的演替,其中酵母菌是白酒酿造发酵的主要动力[7]。酵母菌在酿造过程中大量存在,除高温大曲自身提供的酵母外,酿造环境(如地面、空气、使用工具等)、生产原料都能够提供来源[8]。
茅台镇作为最大的酱香型白酒产地,位于仁怀西北部13 km处,属河谷坡地。张亚丽[9]对茅台镇空气微生物的群落结构进行分析,发现发酵微生物有一部分来源于当地的空气微生物,即“離开茅台镇,就酿不出茅台酒”[10]。特殊复杂的酿造工艺与不可复制的酿造环境造就了酱香型白酒独特的风格特征,而酿造过程的极端环境,也迫使微生物经过长期生存驯化,从而形成了酱香酒酿造环境中特有的微生物菌群[11]。对酿造环境中的酵母进行研究已成为研究酵母类群的热点。
茅台酱香酒的工艺使得大曲能够不断从酿造环境中富集酿造酵母菌[12-13],相对开放的环境也使得大曲中的酵母能够被释放到环境中,从而形成较为特殊的酒体风味。吴徐建[14]对酱香型白酒酿造2~7轮次环境、大曲及酒醅中的酵母进行分离鉴定,发现酿造空气中几乎包含了大曲中的酵母种属。随着茅台酱香酒产业的发展需求增加,发酵性能好、产香性能好的酵母的分离成为研究的主要目的之一[15-16]。
研究表明,随着海拔的变化,光照、水分、温度、土壤养分、植物等因子也随之改变,从而引起区域小气候的微生物发生变化[17]。Wang等[18]跟踪大曲发酵过程微生物的变化情况发现,大曲存放的位置不同,微生物群落的结构也会不同。因此,不同的小气候可能会对酵母种类和数量产生影响,从而直接或间接影响酱香型白酒的发酵及其品质[19]。目前对茅台镇的酵母研究常限于某一轮次或某个酒厂,酵母群落结构在不同海拔层面上的关系还未揭示。因此,本研究根据茅台镇各酒厂在不同海拔的分布情况,大致可分为<500 m、500~600 m、>600 m等3个梯度,对不同海拔酿造环境及大曲中的酵母进行可培养分离,这有利于认识酵母菌在不同海拔上的群落结构分布差异,也为茅台镇的酿酒酵母研究提供参考。
1材料与方法
1.1试验材料
1.1.1供试样品
环境样品及大曲样品取自贵州省茅台镇核心酿酒区域,分别在海拔<500 m(H1)、500~600 m(H2)、>600 m(H3)各选取3家酱香型白酒公司,共9家(表1)。其中环境样品采集包括:将各酒厂生产车间的窗户玻璃、窗台、晾堂及四周地面、墙面、墙角、行车梯子及上表面、配电箱上表面、消防箱上表面、储酒罐和一些平时不易被打扫的角落等处的采样点进行灰尘样品等量采集并均匀混合,每个企业采集混合样100 g。大曲样品为曲房贮存使用的生产用大曲,每个企业采集混合样500 g(取样时间2022年7月—2023年3月)。同一海拔梯度采样点采集的两类样品分别进行等量均值混匀,采集后立即装袋密封运往实验室。
1.1.2供试培养基
WL营养培养基:酵母粉5.0 g、酸水解酪蛋白5.0 g、葡萄糖50.0 g、磷酸二氢钾0.55 g、氯化钾0.425 g、氯化钙0.125 g、硫酸镁0.125 g、氯化铁0.0025 g、硫酸锰0.0025 g、溴甲酚绿0.022 g、琼脂17 g、pH值5.5±0.2。
麦芽汁液体培养基:麦芽膏粉130.0 g、氯霉素0.1 g、pH 5.6±0.2。
1.2试验方法
1.2.1稀释涂布平板分离
在无菌条件下分别称取25 g大曲粉末和25 g环境样品于225 mL无菌水中,摇床充分震荡30 min,制成菌悬液。从菌悬液中取1 mL加到9 mL无菌水中,以10倍为稀释单位,逐次稀释到10-2~10-7倍,各吸取100 μL菌悬液于WL营养培养基中(3个平行)。放入30 ℃培养箱中倒置培养1~2 d,然后进行酵母计数。酵母菌的鉴定根据形态持征,参照《常见与常用真菌》中的方法鉴定[20]。
1.2.2划线平板分离
根据稀释涂布平板上的单菌落特征,挑取形态不同的菌株在平板上划线纯化2~3次,获得酵母菌纯培养物,纯化后的菌株4 ℃斜面保存。
1.2.3酵母的分子生物学鉴定
将活化后的酵母菌株接入麦芽汁液体培养基中震荡培养24 h后,取1 mL菌液离心后弃上清液,采用北京索莱宝科技有限公司的柱式真菌基因组DNA抽提试剂盒,按照说明书流程进行酵母基因组DNA提取。引物序列见表2,PCR反应体系(25 μL体系)及反应程序[21]:ITS1和ITS4各1 μL,DNA模板2 μL,Mix 12.5 μL,补充dd H2O至25 μL。94 ℃预变性5 min,94 ℃变性30 s,55 ℃退火45 s,72 ℃延伸1 min,35个循环反应,最后72 ℃继续延伸5 min。1%琼脂糖凝胶检测扩增目标产物后,送上海生工生物工程股份有限公司进行测序。
1.2.4系统发育树构建
测序结果在NCBI(http:www.ncbi.nlm.nih.gov.blast)数据库进行BLAST比对,初步确定分离菌株的分类地位,一般相似率为98%以上,即可认为是同一个物种。选取同源性较高的菌株作为参比对照,采用MEGA 7.0软件进行多序列比对后,进行1000次的Bootstraps检验,用邻接法(Neighbor-Joining)构建菌株系统发育树[22]。
1.2.5数据分析
利用多样性指数分析可培养酵母菌的物种多样性,Sorenson相似性指数(S)比较样本间酵母菌种类组成的相似程度。计算公式为[23]:
Shannon-Wiener指数(H):H=-Σ(PilnPi) (1)
Simpson指数(D):D=1-ΣP(2)
Pielou指数(J):J=H/lnS (3)
Sorenson相似性指数S=2j/(a+b) (4)
式中:Pi为菌种i的个体在全部个体中的比例;S为总物种数。
使用Excel 2016处理数据并分析物种多样性指数;Origin Pro 2021绘制相对丰度图及和弦图;韦恩图由在线软件绘制 (http://bioinformatics.psb.ugent.be/webtools/Venn/)。
2结果与分析
2.1环境与大曲样品中酵母菌的多样性分析
如表3所示,大曲中的可培养酵母菌多样性指数(Shannon-Wiener指数)、均匀度指数(Pielou指数)均小于环境中,两者的Simpson指数相同,相似性(Sorenson相似性指数)程度略高。由此可知,环境样品的酵母菌多样性较大曲样品丰富,这为大曲开放式获取环境微生物提供了广泛来源。
2.2环境和大曲中可培养酵母菌群落数量及组成
从表4可以看出样品中酵母数量为103~105数量级,总数上大曲>环境。结合多样性指数分析结果来看,这离不开大曲开放式的生产、储存、使用环境。大曲在堆积储存过程中,实则是一个个独立的固态发酵体系,能够广泛地自然接种和网罗环境中的微生物,在曲块内形成丰富的核心菌系。虽然以前有研究认为高温制曲的环境不利于酵母菌的生长[15],但是通过在常温存放的过程中,酵母的休眠体可能复苏,同时环境中的酵母附着在曲中,因此依然蕴含着较多的酵母菌。
采用传统培养法从3个不同海拔的环境和大曲样品中共分离获得474株酵母菌,其中环境269株,大曲205株。经菌落形态相似性初筛后,最终选择106株菌送检,鉴定为21属32种(表5),其中环境28种,大曲18种。共有酵母菌有14种,大曲特有酵母菌有4种,环境中特有酵母菌14种(图1)。
Pichia属酵母菌是环境和大曲中的优势属,其中大曲中分离出3种,分别为P.kudriavzevii、P.farinosa和P.exigua;环境中分离出5种,分别为P.pastoris、P.kudriavzevii、P.farinosa、P.exigua和P.galeiformis。其次占优势的是Candida属酵母,在大曲中分离出1种,为C.albicans;环境中分离出3种,分别是C.vartiovaarae、C.solani和C.glabrata。
2.3不同海拔大曲酵母种群多样性结构
从大曲中共分离出205株、18种酵母菌,在海拔梯度500~600 m均有分离得到,在海拔500 m以下分离出了其中12种,在海拔600 m以上分离出了其中13种。由此可知,在海拔500~600 m之间的大曲中富集了更多的酵母菌群。
从圖2可看出,大曲中的M.guilliermondii、W.anomalus、P.kudriavzevii、S.cerevisiae、S.paradoxus、Z.bailii、T.delbrueckii、T.ciferrii和Z.rouxii在3个海拔梯度中都有出现,平均相对丰度分别为13%、22%、11%、5%、4%、11%、7%、3%和2%。根据核心微生物的定义,即在样本中分布频率较大的普遍微生物群[24-25],本研究发现M.guilliermondii、W.anomalus、P.kudriavzevii和T.delbrueckii是酱香型白酒大曲的核心酵母菌。
2.4不同海拔环境酵母种群多样性结构
环境样本中的可培养酵母菌共28种269株。经统计分析,M.guilliermondii、W.anomalus、C.vartiovaarae、C.glabrata、P.pastoris、P.kudriavzevii、Z.bailii、C.solani、P.farinosa、S.pombe、P.exigua、P.galeiformis和S.podzolica在不同海拔环境中的分布频率为100%,平均相对丰度最大的依次为W.anomalus(20%)、M.guilliermondii(15%)、C.vartiovaarae(8%)、P.pastoris(6%),是酱香型白酒环境的核心酵母菌(图3)。
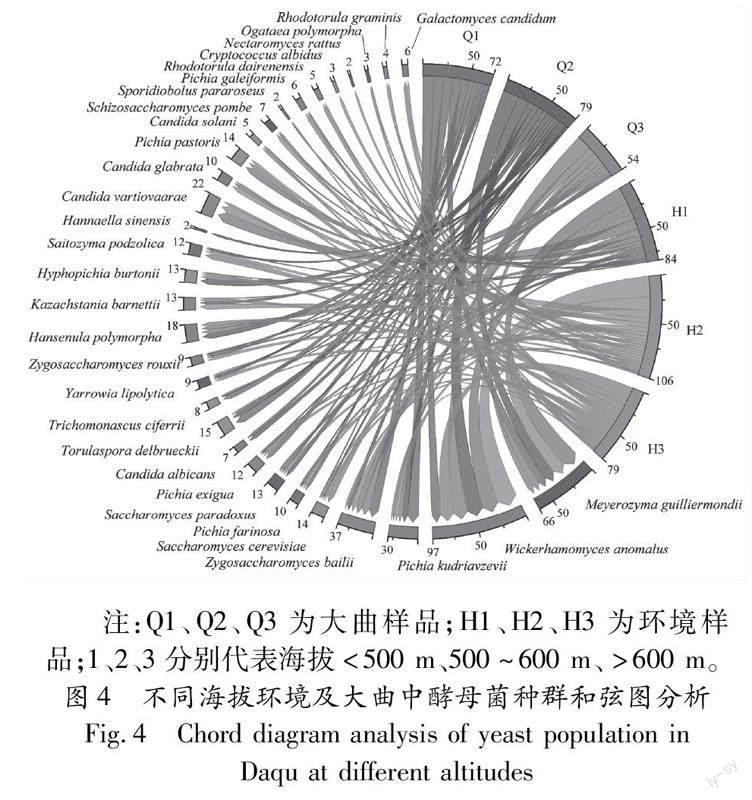
2.5不同海拔环境及大曲中酵母菌种群和弦图分析由图4可知,在海拔500 m以下、500~600 m及600 m以上的环境样品中分别分离到84株、106株和79株酵母菌。海拔500 m以下的主要优势种为W.anomalus、M.guilliermondii和C.vartiovaarae;500~600 m的优势菌与500 m以下相似;600 m以上的优势种主要为P.kudriavzevii、M.guilliermondii和S.podzolica。M.guilliermondii在各个海拔梯度的环境中均广泛存在。
在3个海拔的大曲样品中分别分离到72株、79株和54株酵母菌。海拔500 m以下的主要优势种为W.anomalus、P.kudriavzevii、Z.bailii;500~600 m的優势种主要为W.anomalus和M.guilliermondii;600 m以上的优势种主要为S.cerevisiae、W.anomalus、M.guilliermondii和Z.bailii。W.anomalus在各个海拔梯度的大曲中均广泛存在。
2.6不同海拔环境及大曲酵母菌群落相似性分析
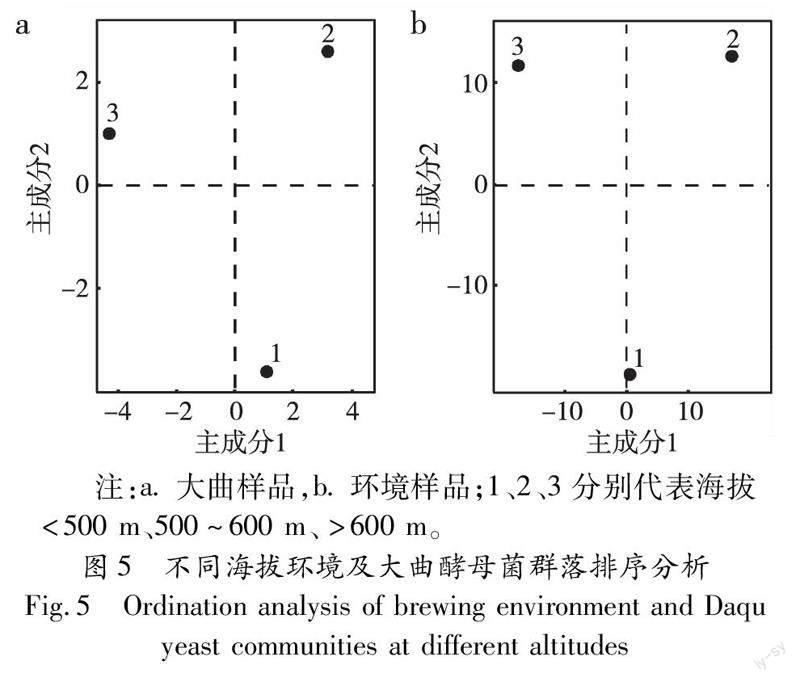
基于Bray-Curtis距离指数,对3个不同海拔环境及大曲酵母菌群落进行排序,通过点与点之间的距离,能够反映不同海拔之间酵母菌组成的差异。大曲样本中(图5-a),第一轴的解释率为59.1%,第二轴的解释率为40.9%;环境样本中(图5-b),第一轴的解释率为56.9%,第二轴的解释率为43.1%,两个样本的总解释率均达到100%。总的来说,海拔500 m上下的酵母菌群落组成差异较大,海拔500~600 m与600 m以上的酵母菌组成差异相对较小。说明以海拔500 m为界,酵母菌呈明显的垂直分布特征。海拔越往上,酵母群落间的距离逐渐拉小,群落相似性也越高。
3结论与讨论
本研究的环境样品包括酿造空气沉降灰尘、酿造车间地面灰尘、墙体表面的灰尘、粉尘、车间外地面、沟渠表面土质粉尘等,所采集样品具有充分的代表性,能体现环境样品特征性。采用可培养方法分离得到的474株高纯度单个酵母菌株,丰富了酱香型白酒酿造的酵母菌资源,有利于菌种特性的探究和实际生产的应用。高温大曲培养出的酵母菌数量是环境的42倍,这得益于酿造过程的开放式,使得环境中酵母菌不断向大曲富集[26]。环境和大曲中的共有种14株,包括W.anomalus、M.guilliermondii、S.cerevisiae等常见的酿酒有益菌株。
Pichia属是酱香大曲中常见的酵母属,占酵母菌总数的绝大部分,可促进酿酒过程发酵和生香[27-28]。本研究从环境和大曲样品中共分离出5种Pichia酵母,均在环境中存在,在大曲中存在3种。有研究者从酱香白酒酒醅中筛选出一株P.kudriavzeviil,发现它能够高产乙酸苯乙酯,对白酒有提香提味作用[29]。在大曲和环境样品中还分离到4种Candida属酵母,该属酵母菌具备较高的乙醇耐受性,使其在酿造过程中能够持续贡献产酯能力[30]。S.cerevisiae和W.anomalus作为环境和大曲中相对丰度较大的种,具有较好的产酒和产香能力,在白酒成品曲中也广泛存在[31]。范光先等[32]从制曲发酵过程中分离得到微生物有97种,其中酵母18种。整个制曲发酵过程中发现的酵母种类主要有P.kudriavzevii、Z.cidrci、Hyphichia burtoniiai等[16]。相关酱香型白酒的研究表明,虽然酵母的数量相对于霉菌和细菌最少,但是酵母的种类和数量对酒的品质影响巨大,其中产酒酵母主要影响着酒质和出酒率[33]。产香酵母能够产生大量的挥发性香气化合物,能提高酒体中香味物质的含量,赋予酒体独特的风格[34]。
3个海拔层面环境和高温大曲中可培养酵母多样性和丰度存在差异,环境中酵母多样性和丰度差异明显,高温大曲酵母多样性和丰度差异小。其中W.anomalus在环境和大曲中均为核心酵母菌。海拔500~600 m的酵母菌种类及丰度最高,这可能是受地势、地形条件的影响,茅台镇境内气候垂直分异较为明显,区域分异较大,各海拔形成了独特的小生境,影响着酵母菌群的分布[35]。其次,经调查发现,该海拔的酒厂较多,长期的酿酒活动也使得该海拔积累了丰富的酵母菌群。不同海拔的大曲和环境样品可培养酵母菌群结构组成及丰度虽有所不同,但主要优势菌群却保持一定的相似性和稳定性。
通过对海拔间可培养酵母菌种群结构差异性分析,证实了不同海拔样品中酵母菌之间存在一定的共性特征,中间海拔作为一个过渡的海拔梯度,富集了较多来自低海拔和高海拔的酵母菌群。海拔500 m上下的酵母菌呈明显的垂直分布特征,群落差异较大。海拔越往上,群落相似性越高。本研究对环境和大曲中的酵母群落垂直分布结构有一个整体而系统的认识,也在一定程度为高温大曲中酵母属与海拔的关系进行了探讨,为今后更好地认识和了解酱香酒品质提供科学参考。
(责任编辑:胡吉凤严秀芳)
参考文献:
[1]贵州省仁怀市地方志编纂委员会.仁怀市志(1978-2005)[M].北京:方志出版社,2013.
[2]戴奕杰.酱香型白酒酿造过程中微生物群落组成及其与酒品质的关系[D].长沙:湖南农业大学,2021.
[3]郭世鑫,姚孟琦,马文瑞,等.酱香型白酒的研究现状[J].中国酿造,2021,40(11):1-6.
[4]王婧,王晓丹,邱树毅,等.酱香型白酒酿造体系风格特征形成探究[J].酿酒,2015,42(4):99-104.
[5]金尚萍,惠明,田青.酱香型白酒风味物质及影响因素的研究进展[J].发酵科技通讯,2022,51(3):164-168,181.
[6]杨国华,邱树毅,黄永光.酱香白酒生产中产香微生物研究[J].中国酿造,2011(4):24-27.
[7]黄永光,谌永前,吴广黔,等.酱香白酒堆积发酵过程酒醅中酵母菌的分析研究[J].酿酒科技,2013(6):8-13.
[8]戎梓溢,白茹,闫学娇,等.酱香型白酒酿造微生态中酵母菌的研究进展[J].食品研究与开发,2022,43(13):180-188.
[9]张亚丽.贵州省仁怀地区茅台空气微生物的鉴定与分析[D].北京:北京化工大学,2014.
[10]王晓丹,陈美竹,邱树毅,等.茅台大曲中酵母的分、鉴定及其功能初探[J].食品科学,2017,38(4):51-57.
[11]李景辉.酱香型白酒生香酵母菌的筛选与应用[D].天津:天津科技大学,2023.
[12]羅方雯.茅台镇酱香型白酒酿造酵母类资源多样性特征研究[D].贵阳:贵州大学,2021.
[13]陈美竹,邱树毅,胡宝东,等.酱香型白酒酿造体系中酵母菌研究进展[J].中国酿造,2015,34(6):5-10.
[14]吴徐建.酱香型白酒固态发酵过程中酵母与细菌群落结构变化规律的研究[D].无锡:江南大学,2013.
[15]蒋红军.茅台酒制曲发酵过程中微生物演替及作用规律[J].酿酒科技,2004(3):39-40.
[16]赵桂琴,琚泽亮,柴继宽.海拔和品种对燕麦营养品质及表面附着微生物的影响[J].草业学报,2022,31(11):147-157.
[17]Fierer N,Mccain C M,Meir P,et al.Microbes do not follow the elevational diversity patterns of plants and animals[J].Ecology,2011,92:797-804.
[18]Wang C L,Shi D J,Gong G L.Microorganisms in Daqu:a starter culture of Chinese Maotai-flavor Baijiu[J].World Journal of Microbiology and Biotechnology,2008,24(10):2183-2190.
[19]吴成,杨龙飞,胡峰,等.酱香型白酒造沙轮次堆积发酵微生物及理化指标演替规律[J].食品科技,2023,48(6):9-15.
[20]中国科学院.常见与常用真菌[M].北京:科学出版社,1978.
[21]杨凯环,相里加雄,曹苗文,等.清香型酒曲中高产乙酸乙酯酵母的筛选及鉴定[J].酿酒科技,2023(7):38-43.
[22]樊建辉,侯建光,郭福祥,等.仰韶陶融型白酒大曲可培养微生物多样性研究[J].中国酿造,2017,36(7):71-75.
[23]唐雪娅,徐明,聂坤,等.黔中地区不同马尾松群丛植物群落多样性特征研究[J].山地农业生物学报,2023,42(4):26-32.
[24]杨第芹.酱香酒醅和大曲中耐高温产酯酵母的筛选及其生产丢糟酒的研究[D].贵阳:贵州大学,2023.
[25]宋哲玮.酱香型白酒核心酿造菌群及群体代谢机制的研究[D].无锡:江南大学,2022.
[26]罗方雯,黄永光,涂华彬.茅台镇酱香白酒不同酿造区域可培养酵母种群结构多样性分析[J].食品科学,2020,41(12):143-149.
[27]黄武,王晓丹,邱树毅,等.酱香型酒糟发酵前后品质和挥发性成分初步分析[J].中国酿造,2021,40(2):97-101.
[28]Chu Y,Li M,Jin J,et al.Advances in the application of the non-conventional yeast Pichia kudriavzevii in food and biotechnology industries[J].Journal of Fungi,2023,9(2):170.
[29]Rosanna T,Clemencia C L,Federico D F,et al.Molecular identification and osmotolerant profile of wine yeasts that ferment a high sugar grape must[J].International Journal of Food Microbiology,2009,130(3):179-187.
[30]侯建光,郭富祥,樊建辉,等.响应面法优化陶香型窖池中异常威克汉姆酵母发酵产乙酸乙酯条件[J].酿酒科技,2016(10):77-81.
[31]Chen L,Li D,Ren L,et al.Effects of simultaneous and sequential cofermentation of Wickerhamomyces anomalus and Saccharomyces cerevisiae on physicochemical and flavor properties of rice wine[J].Food Science & Nutrition,2020,9(1):71-86.
[32]范光先,王和玉,崔同弼,等.茅台酒生产过程中的微生物研究进展[J].酿酒科技,2006(10):75-77.
[33]郝飞,吕锡斌,吴耀领,等.酱香型白酒酿造酒醅中酵母菌多样性研究[J].菌物学报,2019,38(5):620-630.
[34]杨玉蓉,钟海雁,徐帅哲,等.产香酵母的分离鉴定及对不同原料酿造甜酒香气成分的影响[J].中国酿造,2021,40(7):77-82.
[35]宗加權.茅台酒产地气候特征及气候变化趋势分析[D].南京:南京信息工程大学,2022.
Population Structure and Diversity of Culturable Yeast in Maotai Liquor at Different Altitudes in Maotai Town
Wang Xing Qiao Lu Zhou Yeming Dong Chunbo Han Yanfeng Zou Xiao
(1.Forestry Bureau of Renhuai,Renhuai 564500,Guizhou,China;2.Institute of Fungus Resources/College of Life Sciences,Guizhou University, Guiyang 550025, Guizhou,China)
Abstract:This paper explored the species diversity of culturable yeast in high-temperature Daqu and environmental samples,as well as the population structure and relative abundance at different altitudes,taking Maotai Town,Renhuai City,the core production area of Chinese Maotai-flavor liquor,as the research area.The results showed that 474 strains of yeast were finally isolated from high-temperature Daqu and environmental samples,and identified as 32 species in 21 genera.Among them,a total of 269 strains of yeast were isolated from environmental samples and identified as 28 species in 19 genera.A total of 205 strains of yeast were isolated from Daqu and identified as 18 species in 15 genera.Wickerhamomyces anomalus acts as a core yeast both in the environment and in Daqu.The diversity index of yeast isolated in the environment was higher than that of high-temperature Daqu.At different altitude gradients,the diversity and abundance of yeast in environmental samples were significantly different,while the differences in high temperature Daqu were less,and the main dominant yeast populations maintained a certain degree of similarity and stability.In general,the yeast community structure above 500 m was relatively similar,and the relative abundance and diversity of yeast community at 500~600 m were the highest,and both of them above 600 m were lower than those below 500 m.
Keywords:brewing environment; Daqu; culturable method;different altitudes;yeast community diversity

