CTCs、IGF-1R 及RNPC1 对非小细胞肺癌患者术后复发的预测价值
李娜 于宏彬 张茜 叶鑫
目前,肺癌位居我国肿瘤死亡原因首位。肺癌分为非小细胞肺癌(Non-small-cell lung carcinoma,NSCLC)和小细胞肺癌两大类,其中,NSCLC最常见,约占肺癌总发病率的85%[1]。NSCLC 又可分为腺癌、鳞状细胞癌、腺鳞癌、大细胞癌、类癌和肉瘤样癌等亚型,目前腺癌发病率最高,其可通过局部浸润、淋巴系统、血液系统转移到其他部位。循环肿瘤细胞(Circulating Tumor Cells,CTCs)是存在于外周血中的各类肿瘤细胞的统称,因自发或诊疗操作从实体肿瘤病灶(原发灶、转移灶)脱落,大部分CTCs 在进入外周血后发生凋亡或被吞噬,少数能够逃逸并锚着发展成为转移灶,增加恶性肿瘤患者死亡风险。研究发现肿瘤细胞的扩散传播是肿瘤患者死亡的主要原因[2]。胰岛素样生长因子1 受 体(Insulin like growth factor 1 receptor,IGF-1R)是在人细胞表面发现的蛋白质,其在生长中起重要作用,可以诱导细胞中原癌细胞的表达,并可抑制细胞凋亡。RNA 结合蛋白(RNA binding protein,RNPC1)是P53基因家族的一个靶细胞,具有RNA 结合活性,它可以通过结合并调节癌细胞中靶基因的表达来充当肿瘤抑制因子。现有研究发现,RNPC1 蛋白在肺腺癌中有明显表达,且与患者临床病理特征有一定关系[3]。本文旨在分析CTCs、IGF-1R 及RNPC1 对非小细胞肺癌患者术后复发的预测价值,报道如下。
1 一般资料与方法
1.1 一般资料
选取2021 年4 月至2022 年1 月于首都医科大学附属北京朝阳医院进行肺切除术治疗NSCLC 患者132 例为研究对象,其中男性82 例,女50 例,平均年龄(46.57±9.32)岁,BMI(21.57±2.89)kg/m2。低分化NSCLC 患者28 例,中分化NSCLC 患者36 例,高分化NSCLC 患者68 例;Ⅰ期患者29 例,Ⅱ期患者35 例,Ⅲ期患者68 例。本研究经院医学伦理委员会批准通过,受试者或家属已签署知情同意书。
纳入标准:①经病理学检查均符合《中国肺癌筛查与早诊早治指南》[4]中NSCLC 的诊断标准。②临床资料无缺乏;③无精神障碍,可以配合治疗。排除标准:①妊娠期患者;②患有其他肿瘤者;③重要器官功能异常者。
1.2 方法
1.2.1 CTCs、IGF-1R、RNPC1 检测方法
1.2.1.1 CTCs 检测方法 于术前、术后1 w 抽取研究对象5 mL 静脉血,置于抗凝管中,混合均匀后,将其放入冰箱内保存,在24 h 内进行检测。采取密度梯度离心法对样本进行富集,使用Cell Search 循环肿瘤细胞检测试剂,试剂中的铁磁流体试剂含有带磁芯的纳米微粒,在磁芯周围的聚合物层上涂覆有针对上皮细胞粘附因子抗原的抗体用来捕获CTCs,添加荧光剂用来识别并计数CTCs。
1.2.1.2 IGF-1R 检测方法 于术前、术后1 w 分别抽取研究对象5 mL 静脉血,并置入干燥管中,于常温环境下静置4 h 后做离心处理,使用血型血清学离心机HT12MM,以3 000 r/min 的转速进行离心10 min 处理,离心半径为10 cm,提取血清,将其倒入1.5 mL 的聚丙二醇脂管内,于-60℃保存。采取放射免疫分析法对IGF-1R 进行检测。
1.2.1.3 RNPC1 检测方法 于术前、术后1 w 提取肺部组织,所有的组织均制作呈标本,经石蜡包埋后作连续切片,厚度约4 mm,采用免疫组化链霉卵白素-生物素复合体法染色,二氨基联苯胺显色。使用通用型二抗、SP 试剂盒和DNB 显色盒(均来自北京中杉金桥生物技术开发公司)检测PNPC1,在高倍显微镜下观察PNPC1 蛋白的表达情况。具体染色步骤严格按照SP 试剂盒说明书进行操作。
1.2.2 随访
患者出院后,通过电话、门诊等方式随访12 个月,随访截止至2023 年1 月,统计所有患者的复发转移等情况。随访内容:CT、肿瘤标志物检测等。
1.3 观察指标
整理12 个月随访资料,对比手术前与术后1 w CTCs、IGF-1R、RNPC1 变化情 况,分析影 响NSCLC 患者术后复发的单因素,采用多元Logistic回归分析CTCs、IGF-1R、RNPC1 对NSCLC 患者术后复发的相关因素。
1.4 统计学方法
采用SPSS 21.0 统计软件进行统计分析,计量资料采用()描述,两两间使用t检验;计数资料通过n(%)表示,并采用χ2检验,采用多元Logistic回归分析影响NSCLC 患者术后复发的多因素;均以P<0.05 为差异具有统计学意义。
2 结果
2.1 手术前后CTCs、IGF-1R、RNPC1 水平的比较
患者术后1 w CTCs、IGF-1R、RNPC1 水平均低于术前,差异有统计学意义(P<0.05)。见表1。
表1 手术前后CTCs、IGF-1R、RNPC1 水平对比()Table 1 Comparison of CTCs,IGF-1R,and RNPC1 levels before and after surgery()
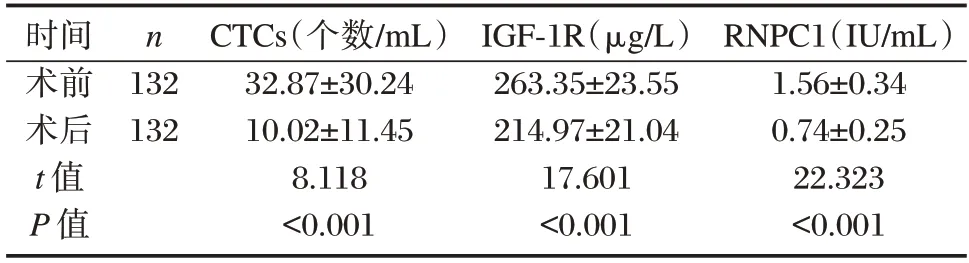
表1 手术前后CTCs、IGF-1R、RNPC1 水平对比()Table 1 Comparison of CTCs,IGF-1R,and RNPC1 levels before and after surgery()
2.2 随访情况
经过12 个月随访,发现132 例NSCLC 患者中87 例未出现复发,归为非复发转移组;45 例复发转移患者(34.09%),其中脑转移20 例(44.44%),肺内转移13 例(28.89%),骨转移9 例(20.00%),肝脏转移3 例(6.67%),归为复发转移组。
2.3 影响NSCLC 患者术后复发的单因素
两组性别、年龄、BMI、高血压史、糖尿病史、吸烟比较差异无统计学意义(P>0.05)。两组TNM分期、分化程度与CTCs、IGF-1R、RNPC1 测量值比较差异具有统计学意义(P<0.05)。见表2。
表2 影响NSCLC 患者术后复发的单因素[n(%),()]Table 2 Single factor influencing postoperative recurrence in NSCLC patients[n(%),()]
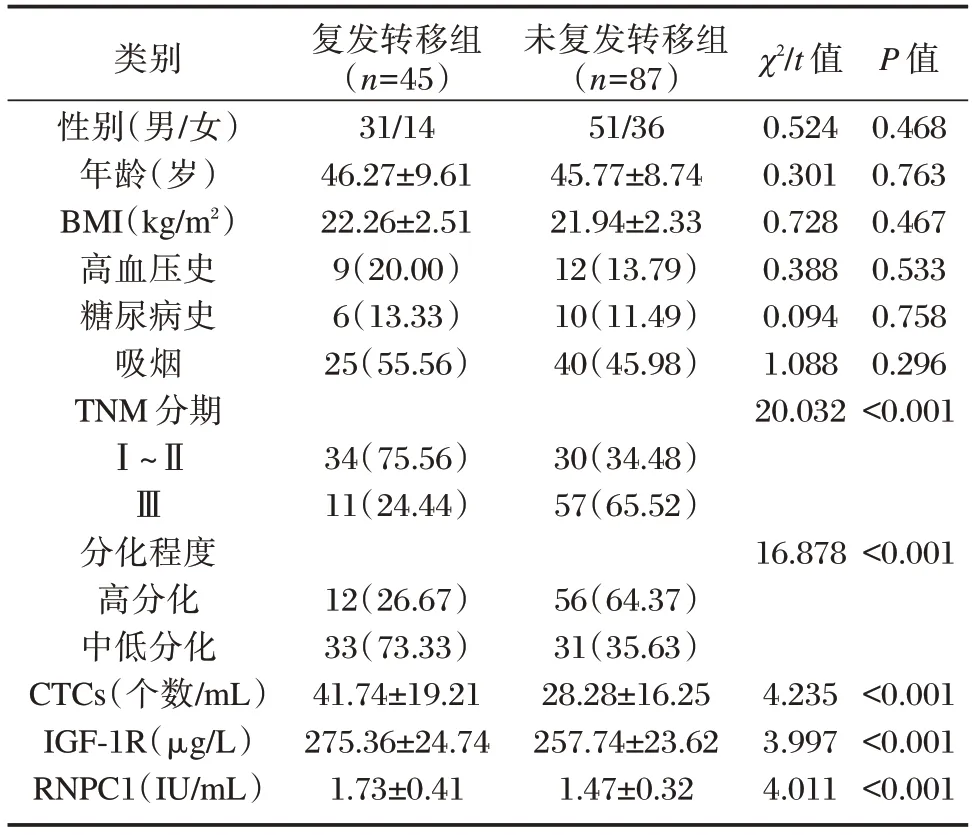
表2 影响NSCLC 患者术后复发的单因素[n(%),()]Table 2 Single factor influencing postoperative recurrence in NSCLC patients[n(%),()]
2.4 影响NSCLC 患者术后复发的多因素
经Logistic 回归分析显示:TNM 分期为Ⅲ~Ⅳ期、分化程度为中低分化、CTCs>14.05±11.73 个/mL、IGF-1R>256.39±23.47 μg/L、RNPC1>0.89±0.12 IU/mL 均是影响NSCLC 患者术后复发的危险因素(P<0.05)。见表3。
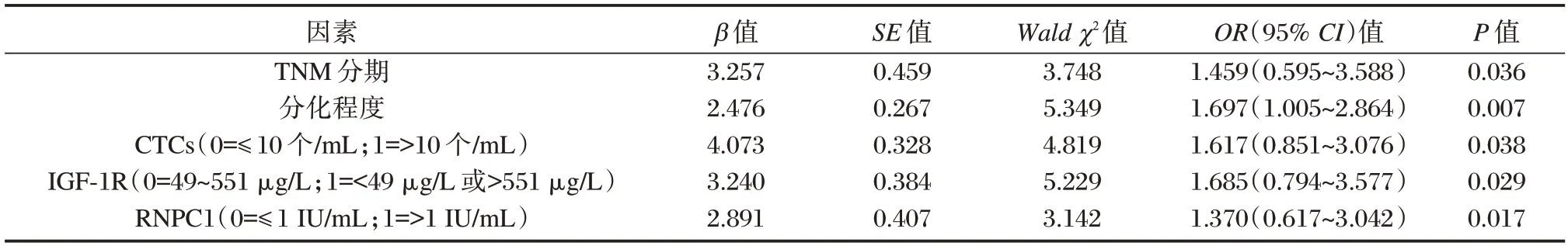
表3 影响NSCLC 患者术后复发的多因素logistic 回归分析Table 3 Multivariate logistic regression analysis on postoperative recurrence in NSCLC patients
3 讨论
NSCLC 主要是指源自于支气管粘膜上皮或者肺泡上皮的恶性肿瘤,属于最常见的肺癌类型,主要症状为咳嗽、血痰、胸痛、发热、气促、消瘦等[5]。NSCLC 其治疗方法为手术切除。按照现有的统计,肺癌整个5 年生存率非常低,死亡的极大原因便是术后复发[6]。有报道指出,可以通过检测循环肿瘤细胞的相关数据对恶性肿瘤进行诊断与复发预测[7]。
CTCs 检测通过捕捉检测外周血中痕量存在的CTC,检测CTC 类型和数量变化的趋势,以实时检测肿瘤动态、评估治疗效果,实现实时个体治疗。程煌荣等学者[8]指出,肿瘤细胞侵入到原发肿瘤细胞的周围组织中,进入血液和淋巴管系统,形成循环肿瘤细胞CTCs,并转运到远端组织,再渗出,适应新的微环境,最终“播种”、“增殖”、“定植”、形成转移灶,因此,早期发现血液中的CTCs,对于患者预后判断、疗效评价和个体化治疗都有着重要的指导作用。肿瘤细胞可以通过血液和淋巴结转移形成转移灶,手术治疗后血液中的残余肿瘤细胞可能是造成肿瘤复发转移的重要因素[9]。对转移肿瘤患者进行预后评估是目前CTCs临床应用最广泛的领域,恶性肿瘤患者治疗前后的CTCs 类型和数目的变化具有重要的预后提示价值[10]。大量实验证明,CTCs 的出现与恶性肿瘤患者的预后密切相关[11]。本次研究显示,NSCLC患者术后CTCs 检测值低于术前,且经Logistic回 归分析发现CTCs>14.05±11.73 个/mL 是影响NSCLC 患者术后复发的危险因素之一,说明CTCs在NSCLC 的复发转移过程中发挥着重要作用。
IGF-1R 是一类多功能细胞增殖调控因子,在细胞的分化、增殖、个体的生长发育中具有重要的促进作用,其广泛分布于各个组织中。IGF-1R 一旦表达过度,IGF-1R 附着的细胞将可能向恶性转化[12]。当IGF-1R 与靶细胞结合时,IGF-1R 会抑制细胞凋亡以及蛋白质合成,刺激恶性肿瘤的发生[13]。刘晓鑫等[14]指出,血液中IGF-1R 浓度的增加将导致恶性肿瘤病复发的易感性增加,且有利于肿瘤的快速生长。本次研究显示,NSCLC 患者术前术后IGF-1R检测值比较差异具有统计学意义,且Logistic 回归分析发现IGF-1R>256.39±23.47 μg/L 会对NSCLC 患者术后复发情况产生影响,说明IGF-1R 可作为NSCLC 患者术后复发评估的重要参考指标。
本次研究显示,RNPC1 检测值在术前术后的差距较小,但仍具有统计学意义;且Logistic 回归分析显示RNPC1>0.89±0.12 IU/mL 是影响NSCLC患者术后复发的危险因素,说明RNPC1 对NSCLC 术后复发具有预测价值。分析原因:RNPC1 的RNA 结合作用能够交错式激活患者体内的癌细胞转录调控因子,提高癌细胞DNA 的扩散速度;且RNPC1 对于一些微小RNA 的调控作用可以促进癌细胞膜表面糖蛋白配体的激活[15]。而以往有研究指出[16],RNPC1 的功能异常会导致癌症的发生与转移,尤其是在上皮细胞中。RNPC1 的表达能够提高癌细胞黏附淋巴结内皮细胞的能力,促进癌细胞对于临近正常肺泡上皮组织的浸润过程,从而影响NSCLC 预后[17]。本次研究结果与上述研究相似。
综上所 述,CTCs、IGF-1R、RNPC1 水平在NSCLC 术后均明显下降,对预后评估具有重要的指导价值;因此,可将CTCs、IGF-1R、RNPC1 水平作为评估NSCLC 患者术后复发转移的重要参考依据。

