血清LRG1 联合β-catenin 在DLBCL 患者诊断与预后评估的应用
孙雷 范艳玲 张诒田 孙宗文
弥漫性大B 细胞淋巴瘤(diffuse large B-cell lymphoma,DLBCL)是非霍奇金淋巴瘤的常见病理学类型[1],DLBCL 在临床特征及遗传学上具有异质性,一些患者在治疗过程中易出现耐药,继而转化为难治性或复发性DLBCL,导致患者预后较差[2]。DLBCL 具有侵袭性高、转移快等特点,因此,对于临床专科医师而言,通过可靠指标了解和预测DLBCL 患者疾病进程和治疗转归十分重要。研究表明[3],富亮氨酸α-2 糖蛋白-1(Leucinerich-alpha-2-glycoprotein-1,LRG1)可通过促进上皮细胞向间质细胞转化、促进异常血管增生、调节肿瘤细胞凋亡等过程参与多种肿瘤的发生发展,但目前对于LRG1 在DLBCL 中的作用研究尚不多见。Wnt 通路在恶性肿瘤细胞增殖和转化过程中发挥重要作用,β-连环蛋白(β-catenin)为Wnt 信号通路活化过程中的关键蛋白因子,其与恶性肿瘤进展过程密切相关[4]。本研究通过分析DLBCL 患者血清LRG1、β-catenin 水平,并探讨二者与DLBCL 临床病理特征的相关性分析二者在DLBCL 诊断与预后评估中的应用价值,具体总结如下。
1 资料与方法
1.1 一般资料
选取2017 年10 月至2019 年10 月济宁医学院附属金乡医院收治的86 例初治DLBCL 患者作为研究组,纳入标准:①符合《中国弥漫大B 细胞淋巴瘤诊断与治疗指南》[5]中DLBCL 的诊断标准,并经病理检查确诊;②临床资料和随访资料完整;③对本研究知情同意并签署知情同意书;④能够接受R-CHOP 方案化疗。排除标准:①合并肝肾心肺等脏器功能严重障碍者;②合并严重感染、免疫系统疾病、凝血功能异常及神经系统疾病者;③合并其他原发性肿瘤者;④无法配合完成研究者。研究组男47 例,女39 例,年龄平均(52.2±3.9)岁,>60岁30 例,≤60 岁56 例;临床分期[5]:Ⅰ期29 例、Ⅱ期24 例、Ⅲ期20 例、Ⅳ期13 例;病理类型:生发中心B细胞(germinal center B cell,GCB)42 例,非生发中心B 细胞(nGCB)44 例;美国东部协作肿瘤组体质状态[6](Eastern Cooperative Oncology Group physique state,ECOG PS)评分≤2 分62 例,>2 分24 例;骨髓侵犯5 例,结节受累57 例,白细胞计数升高41 例,单核细胞计数升高44 例,淋巴细胞计数降低46 例。选择同期于本院接受治疗的淋巴结反应增生(reactive lymph node hyperplasia,RLNH)患者80 例作为对照组,其中男45 例,女35 例,年龄平均(53.5±4.4)岁,均自愿参与本研究并签署知情同意书,无重要脏器功能障碍、未合并其他疾病。两组患者性别、年龄等一般资料比较差异无统计学意义(P>0.05),具有可比性。本研究取得本院伦理委员会批准通过。
1.2 方法
DLBCL 患者入院后建立个人档案,收集性别、年龄、临床分期、ECOG PS 评分等临床病理特征资料,ECOG PS 分为0~5 分共6 个等级,评分越低患者身体状态越好[6]。DLBCL 患者依照R-CHOP 方案(阿霉素、地塞米松、环磷酰胺、长春新碱、利妥昔单抗)给予3 个疗程放射治疗。治疗结束后依照Lugano 反应标准对治疗效果进行评估,包含CT 形态反应、部位、PET-CT 代谢反应结果,分为完全缓解(complete relief,CR)、部分缓解(partial remission,PR)、稳定(Stablize,SD)、疾病进展(Disease progression,PD)[7]。其中,CR、PR、SD 作为缓解组,PD 作为未缓解组。
患者分别于入院当日及治疗结束后收集空腹静脉血5 mL,3 000 r/min(离心半径15 cm)离心10 min 获得血清,采用酶联免疫吸附法(enzyme-Linked immunosorbent assay,ELISA)检测血 清LRG1、β-catenin 水平,LRG1 试剂盒购自武汉华美生物科技公司,β-catenin 试剂盒购自上海科华生物技术有限公司,严格依照试剂盒说明书执行操作。血常规指标(白细胞计数、单核细胞计数、淋巴细胞计数等)采用XS-500i 全自动血细胞分析仪(购自日本西森美康公司)检测。DLBCL 患者出院后随访3 年(2019 年10 月-2022 年10 月),统计病情复发、患者生存等预后状况。
1.3 统计学分析
采用SPSS 22.0 统计学软件进行统计分析,计量资料以()表示,两两比较采用t检验,多组间比较采用单因素方差分析;采用ROC 曲线分析LRG1、β-catenin 在DLBCL 中的诊断价值,采用COX 多因素回归分析LRG1、β-catenin 是否为影响DLBCL 患者预后的独立危险因素。以P<0.05 为差异有统计学意义。
2 结果
2.1 研究组与对照组血清LRG1、β-catenin 水平比较
入院时,研究组血清LRG1、β-catenin 水平显著高于对照组,差异有统计学意义(P<0.05)。见表1。
表1 两组血清LRG1、β-catenin 水平比较()Table 1 Comparison of serum LRG1 and β-catenin levels between the two groups()
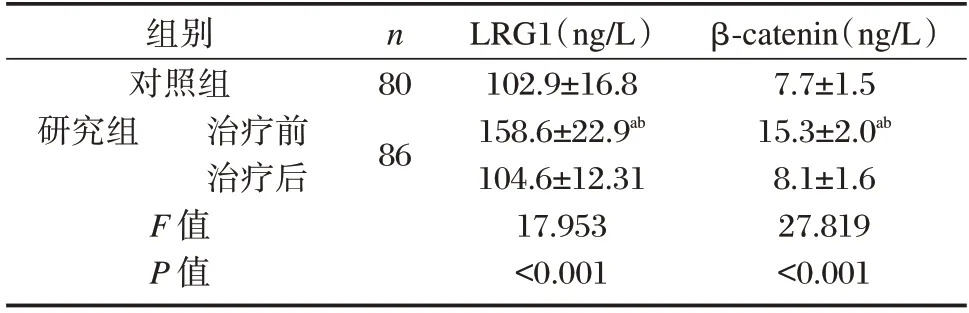
表1 两组血清LRG1、β-catenin 水平比较()Table 1 Comparison of serum LRG1 and β-catenin levels between the two groups()
注:与对照组比较,aP<0.05;与研究组治疗后比较,bP<0.05。
2.2 DLBCL 患者不同临床病理特征血清LRG1、β-catenin 水平比较
入院时,DLBCL 患者不同性别、年龄、白细胞计数、单核细胞计数、病理类型血清LRG1、β-catenin 水平比较差异无统计学意义(P>0.05);不同临床分期、淋巴细胞计数、ECOG PS 评分及有无骨髓侵犯、结节受累患者血清LRG1、β-catenin水平比较差异有统计学意义(P<0.05)。见表2。
表2 DLBCL 患者不同临床病理特征血清LRG1、β-catenin 水平比较()Table 2 Comparison of serum LRG1 and β-catenin levels in DLBCL patients with different clinicopathological features()
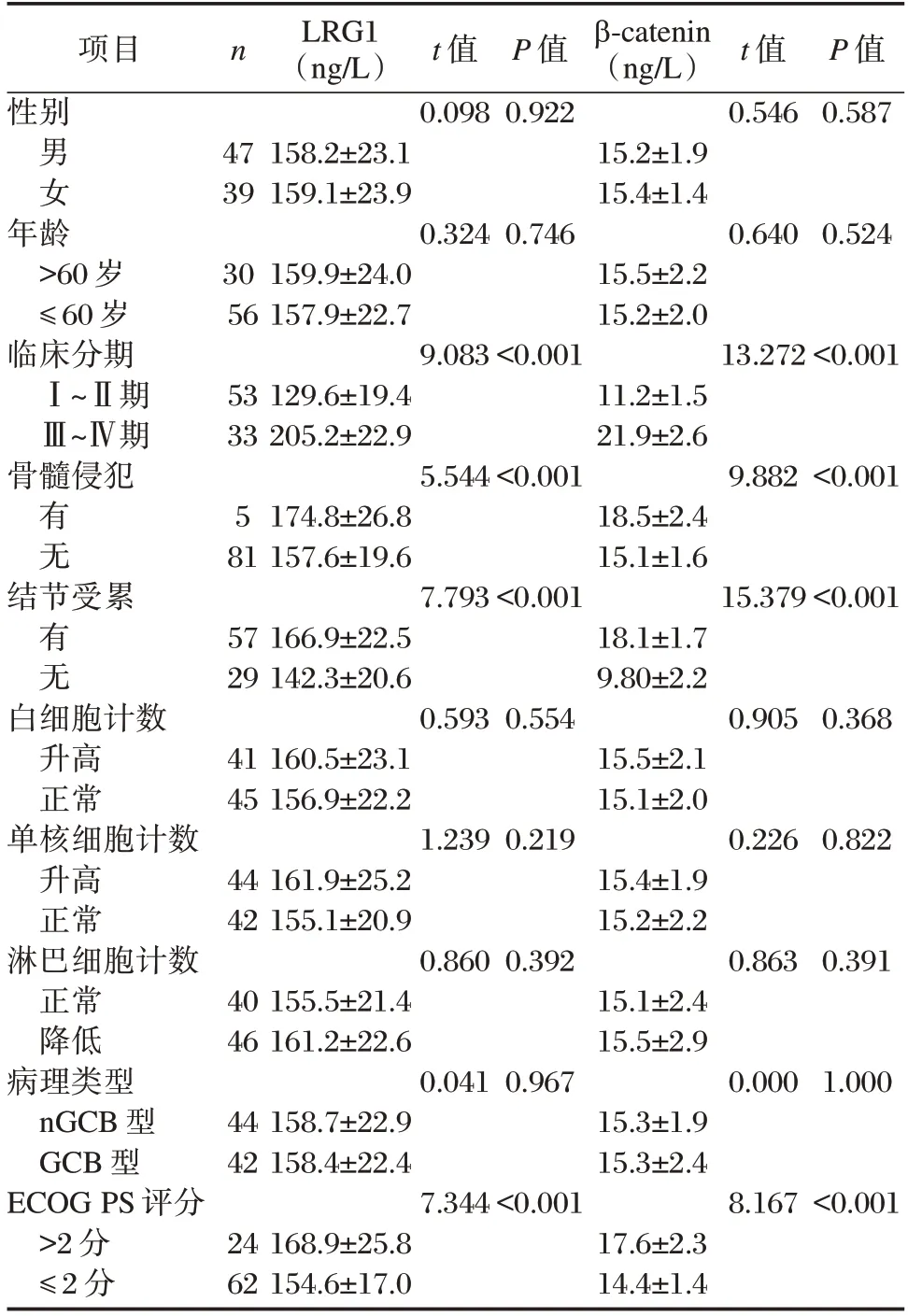
表2 DLBCL 患者不同临床病理特征血清LRG1、β-catenin 水平比较()Table 2 Comparison of serum LRG1 and β-catenin levels in DLBCL patients with different clinicopathological features()
2.3 血清LRG1、β-catenin 诊断DLBCL 的ROC 曲线分析
以DLBCL 患者入院时LRG1、β-catenin 结果行ROC 曲线分析显示,LRG1、β-catenin 诊断DLBCL的AUC 分别为0.791(95%CI:0.729~0.853)、0.756(95%CI:0.696~0.816),联合检测的AUC 为0.807(95%CI:0.870~0.9744),联合检测的AUC 显著高于单一检测(P<0.05)。见图1。
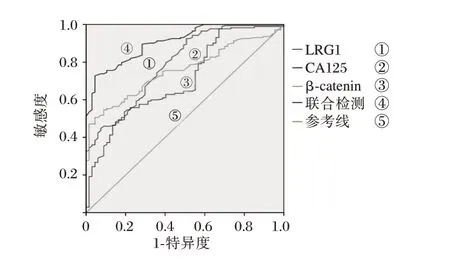
图1 血清LRG1、β-catenin 诊断DLBCL 的ROC 曲线Fig. 1 The ROC curve of serum LRG1 and β-catenin in the diagnosis of DLBCL
2.4 缓解组与未缓解组血清LRG1、β-catenin 水平比较
86 例DLBCL 患者经R-CHOP 方案化疗后65例缓解(CR+PR),缓解率为75.6%,且缓解组患者血清LRG1、β-catenin 水平显著低于未缓解组,差异有统计学意义(P<0.05)。见表3。
表3 缓解组与未缓解组血清LRG1、β-catenin水平比较()Table 3 Comparison of serum LRG1 and β-catenin levels between the remission group and the non-remission group()
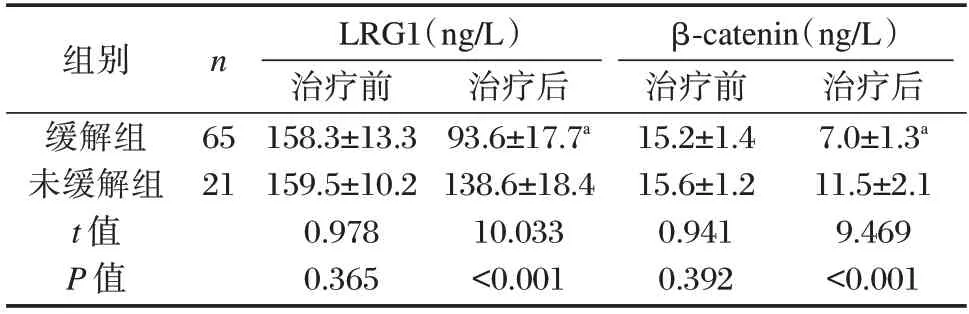
表3 缓解组与未缓解组血清LRG1、β-catenin水平比较()Table 3 Comparison of serum LRG1 and β-catenin levels between the remission group and the non-remission group()
注:同组间同一指标治疗前后比较,aP<0.05。
2.5 DLBCL 患者预后的COX 多因素回归分析
所有患者随访三年统计生存率为52.3%%(45/86),对DLBCL 患者观察指标进行赋值[(临床分期Ⅰ期~Ⅱ期为0、Ⅲ~Ⅳ期为1)、(骨髓侵犯无为0、有为1)、(结节受累无为0、有为1)、(LRG1<93.6 ng/L 为0、≥93.6 ng/L 为1)、(β-catenin <7.0 ng/L 为0、≥7.0 ng/L 为1)],行预后生存因素分析结果显示,采用COX 多因素回归分析血清LRG1(≥93.6 ng/L)、β-catenin(≥7.0 ng/L)与临床分期(Ⅲ~Ⅳ期)、有骨髓侵犯、有结节受累均为DLBCL患者预后的独立危险因素(P<0.05)。见表4。
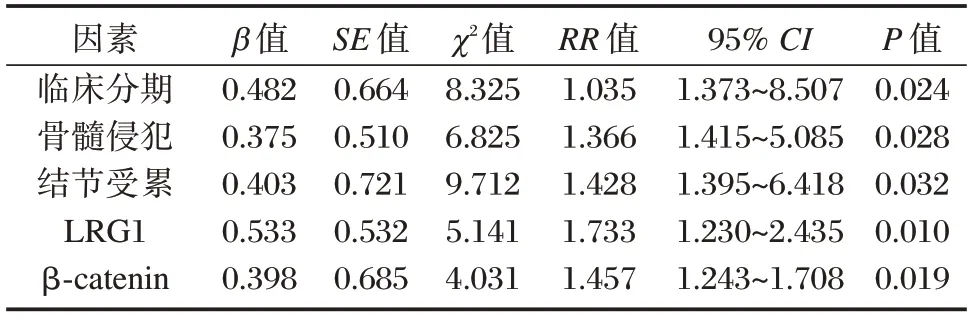
表4 DLBCL 患者预后的COX 多因素回归分析Table 4 COX multivariate regression analysis of the prognosis of DLBCL patients
3 讨论
淋巴瘤是一种源于淋巴组织和淋巴结的免疫系统恶性肿瘤,多数DLBCL 患者通过化疗或免疫治疗可获得完全缓解,但研究表明[8]部分患者初治即难治,或存在初治后复发,严重时可造成患者死亡。因此,通过在初期筛查一些敏感指标,以反映DLBCL 患者病情发展和预后状况,对于临床医师评估患者治疗效果,进而改善治疗方案,避免病情进一步发展,降低难治患者治疗难度及改善患者预后具有重要意义。本研究中结果显示,DLBCL 患者血清LRG1、β-catenin 水平均显著升高,提示初治前血清LRG1、β-catenin 水平在反映DLBCL 患者病情及发展可能存在一定价值。随后,本研究中经过R-CHOP 方案化疗后,65 例DLBCL 患者病情得到缓解,病情缓解患者血清LRG1、β-catenin 水平显著低于未缓解患者,提示血清LRG1、β-catenin 对于反应DLBCL患者的最终治疗效果具有指导意义。
LRG1是近年来新发现的一种与免疫疾病、炎症、恶性肿瘤等疾病相关的活性蛋白质类物质,其可通过激活转化生长因子-β(transforming growth factor-β,TGF-β)通路参与细胞增殖转移、迁徙凋亡、免疫应答及肿瘤新生血管形成等过程,目前已被证实在卵巢癌、肺癌、乳腺癌等恶性肿瘤患者中存在异常表达,其具有稳定的灵敏度和特异性,可作为肿瘤筛选及预后评估的新型生物标志物[9-10]。β-catenin 是Wnt信号通路的主要成员之一,其可与细胞膜上的钙黏蛋白E(E-Cadherin)结合,调控白血病、脑胶质瘤、肺癌等多种肿瘤细胞的迁移、侵袭能力,现已成为肿瘤治疗的热门研究靶点之一[11-12]。研究表明[13],β-catenin 在T 淋巴母细胞淋巴瘤中存在异常表达,并与患者肿瘤分期和不良预后存在密切联系。张燕等[14]研究显示,通过抑制淋巴瘤细胞中Wnt/β-catenin 信号通路及相关分子表达,可抑制DLBCL细胞的增殖,降低细胞活性。本研究中,DLBCL 患者临床分期越高、淋巴细胞计数异常降低、ECOG PS评分越高、存在骨髓侵犯和结节受累,则血清LRG1、β-catenin 水平越高,提示血清LRG1、β-catenin 水平能够反映DLBCL 患者肿瘤临床分期等临床病理特征。ROC 曲线结果显示联合检测的AUC 显著高于单一检测,提示LRG1 联合β-catenin 在DLBCL 诊断中具有较好的应用价值。
研究认为[15-16],影响DLBCL 患者预后的因素较多,如患者侵袭性指标、结外受累状况、肿瘤负荷、体能状态等。研究已证实[17],低临床分期、无骨髓侵犯的DLBCL 患者有着较长的生存期。本研究中,血清LRG1(≥93.6 ng/L)、β-catenin(≥7.0 ng/L)与临床分期(Ⅲ~Ⅳ期)、有骨髓侵犯、有结节受累均为DLBCL患者预后的独立危险因素,提示血清LRG1、β-catenin在DLBCL 患者预后中具有较高的预测价值。
综上所述,血清LRG1、β-catenin 在DLBCL 患者中明显升高,二者均是影响DLBCL 患者预后的独立危险因素,联合检测其水平对于DLBCL 的诊断、治疗及预后具有显著价值。

