苯并[a]芘恶性转化细胞THBEc1中miR-584-5p/miR-211-5p/叉头框蛋白A1轴参与IDH1和HSPB1转录调控
马雪,刘芷毓,邢云昆,姚碧云,傅娟玲,赵鹏
(1.浙江省疾病预防控制中心,浙江 杭州 310051;2.北京大学公共卫生学院毒理学系,食品安全毒理学研究与评价北京市重点实验室,北京 100191)
苯并[a]芘(benzo[a]pyrene,BaP)属于多环芳烃类化合物,广泛存在于烟草烟雾及空气、水和土壤等环境中,长期暴露会导致肺癌等多种癌症的发生[1-2]。BaP 经代谢酶代谢生成二氢二醇、酚类、环氧化物和醌类等中间产物及终致癌物7,8-二氢二醇-9,10-环氧BaP 发挥毒作用,可能的机制涉及与芳烃受体结合,与DNA 结合导致遗传损伤,引起微RNA(microRNA,miRNA)失调等表观遗传改变及干扰信号通路等[3-10]。Jin 等[11]提出了BaP 始于芳香受体活化,继而经不同关键事件诱发肺功能减退、肺纤维化和肺癌等肺损伤有害结局路径。尽管BaP 致癌机制研究取得了一定进展,但BaP 致癌的遗传和表观遗传机制尚未阐明。
研究表明,miRNA表达失调是BaP诱发肺癌过程中的重要特征,基于二代测序(next-generation sequencing,NGS)技术的miRNA 表达谱分析可为进一步阐明BaP 致癌的表观遗传学机制提供线索。BaP可诱导miR-137,miR-150,miR-142-5p,miR-122,miR-34c,miR-34b-5p,miR-29b,let-7a,miR-21 和miR-29等表达失调,影响免疫应答、炎症反应、细胞增殖、迁移、侵袭和细胞周期等生物学过程[12-14]。前期开展的miRNA组测序研究发现,BaP恶性转化细胞THBEc1与对照细胞16HBE的miRNA存在明显差异。功能研究发现,THBEc1细胞中miR-152-3p,miR-142-5p和miR-211-5p表达下调可导致活化白细胞黏附分子(activated leukocyte cell adhesion molecule,ALCAM)上调,影响THBEc1 细胞增殖、迁移和裸鼠体内成瘤等,提示miR-152-3p/miR-142-5p/miR-211-5p-ALCAM 轴可能在BaP 致癌过程中发挥作用[6]。本课题组前期对BaP 恶性转化人支气管上皮细胞T-16HBE-C1(THBEc1)和16HBE细胞的蛋白质组差异进行分析发现,THBEc1细胞中叉头框蛋白A1(forkhead-box A1,FOXA1)蛋白表达水平上调。通过建立FOXA1敲除单克隆细胞THBEc1-ΔFOXA1-c34 和敲除对照单克隆细胞THBEc1-ctrl 开展表型锚定研究发现,FOXA1在BaP 致癌中具有癌基因作用[15]。但FOXA1在THBEc1细胞中表达上调的机制和发挥癌基因作用的信号通路或网络尚未阐明。鉴于miRNA 在基因转录后调控中的重要作用,推测BaP 可能通过诱导miRNA 表达改变导致FOXA1 蛋白表达上调,继而FOXA1 通过调控靶基因的表达在肿瘤发生发展中发挥作用。本研究采用人支气管上皮细胞16HBE和本课题组构建的细胞THBEc1,THBEc1-ctrl 和THBEc1-ΔFOXA1-c34,综合利用生物信息学和分子生物学技术,筛选靶向FOXA1的miRNA 以及FOXA1 的潜在靶基因,识别以FOXA1 为轴的上下游分子,以期为进一步探究FOXA1 在BaP 致癌中的作用和可能机制提供线索。
1 材料与方法
1.1 试剂和主要仪器
MEM 培养基和胎牛血清(美国Gibco公司);胰蛋白酶、青霉素和链霉素(美国Sigma公司);TRIzol和Lipofectamine®2000试剂(美国Invitrogen公司);FastKing cDNA 第一链合成试剂盒、SuperReal-PreMix Plus(SYBR Green)和Pro-Light HRP 化学发光检测试剂盒(北京天根生化科技有限公司);人FOXA1基因cDNA 表达质粒和对照质粒pCMV-未标记的阴性对照质粒(北京义翘神州科技股份有限公司);潮霉素B(hygromycin B,中国上海阿拉丁公司);一抗,兔抗人FOXA1单克隆抗体(美国Abcam公司);兔抗人异柠檬酸脱氢酶1(isocitrate dehydrogenase 1,IDH1)多克隆抗体和兔抗人热休克蛋白B1(heat shock protein B1,HSPB1)多克隆抗体(北京义翘神州科技股份有限公司);鼠抗人β 肌动蛋白单克隆抗体、辣根过氧化物酶标记山羊抗兔IgG 抗体和辣根过氧化物酶标记山羊抗小鼠IgG 抗体(二抗)(北京中杉金桥生物技术有限公司);双链miRNA 模拟物和双链miRNA 模拟物阴性对照(上海吉玛制药技术有限公司)。SCI-I65D CO2恒温培养箱(日本ASTEC 公司);CFX96TM实时荧光定量PCR仪(美国Bio-Rad公司)。
1.2 细胞构建和培养
人支气管上皮细胞16HBE,由中山大学公共卫生学院陈雯教授惠赠,本实验室保存。BaP 恶性转化细胞THBEc1 由本实验室构建并保存[16]。敲除FOXA1基因的THBEc1 单克隆细胞THBEc1-ΔFOXA1-c34和质粒对照细胞THBEc1-ctrl分别为利用CRISPR/Cas9 技术将FOXA1 双切口酶质粒和对照双切口酶质粒转染到THBEc1 细胞后筛选所获的单克隆株,由本实验室构建并保存[15]。细胞培养均使用含10% 胎牛血清的MEM 培养液,培养于37 ℃、5% CO2、饱和湿度培养箱中。
1.3 靶向FOXA1的miRNA的预测和筛选
利用TargetScan7.2 数据库(http://www.targetscan.org/vert_72/)和ENCORI 数据库(https://starbase.sysu.edu.cn/)预测靶向FOXA1 的miRNA。同时结合本课题组前期miRNA 测序结果:与16HBE细胞比较,在THBEc1细胞中351个miRNA表达下调(差异倍数<0.5 且错误发现率<0.05)[6]。采用Venny2.1.0(https://bioinfogp.cnb.csic.es/tools/venny/)对数据进行汇总分析,使用Venn图对数据库预测靶向FOXA1的miRNA与THBEc1细胞中表达下调的miRNA取交集,综合预测可能靶向调控FOXA1的miRNA。
1.4 实时荧光定量PCR(real-time quantitative PCR,RT-qPCR)检测16HBE和THBEc1细胞中hsamiR-584-5p(miR-584-5p),hsa-miR-142-5p(miR-142-5p)和hsa-miR-211-5p(miR-211-5p)表达水平
收集对数生长期的16HBE和THBEc1细胞,利用TRIzol 试剂提取细胞总RNA。以总RNA 为模板用FastKing cDNA 第一链合成试剂盒合成cDNA,RT-qPCR 检测miRNA 水平。以U6 作为内参,miRNA相对表达水平以2-ΔΔCt表示。引物序列见表1。

Tab.1 MicroRNA(miRNA)primer sequences for realtime quantitative PCR(RT-qPCR)
1.5 靶向FOXA1的miRNA鉴定
1.5.1 miRNA转染
将THBEc1 细胞以每孔2.5×105密度接种于6 孔板,当细胞处于对数生长期且细胞密度达到60%时进行转染。转染前弃掉原培养基,用无血清和无双抗的MEM 培养基润洗细胞3 次,按照Lipofectamine®2000 转染试剂操作说明书,THBEc1 细胞分别转染miR-584-5p 模拟物,miR-142-5p 模拟物和miR-211-5p 模拟物,同时设空白对照组(blank control,BC)、无模拟物含Lipofectamine®2000 试剂的转染试剂对照组(mock control,MC)和转染阴性对照模拟物的阴性对照组(negative control,NC)。于转染后48 和72 h 收集细胞,Western印迹法检测FOXA1表达水平。
1.5.2 Western 印迹法检测miRNA 转染后THBEc1细胞中FOXA1表达水平
取1.5.1 中转染的THBEc1 细胞,使用RIPA 裂解液提取细胞总蛋白,Bradford 法测定蛋白浓度。将30 μg蛋白样品经12% SDS-PAGE分离,再经湿式电转法转印至硝酸纤维素膜。电转后的硝酸纤维素膜经5%脱脂奶粉室温封闭2 h 后,分别与FOXA1 单克隆抗体(1∶3000)和β 肌动蛋白抗体(1∶3000)4 ℃孵育过夜,继而与辣根过氧化物酶标记的二抗(1∶20 000)室温孵育2 h。经TBST 清洗后,使用Pro-Light HRP 化学发光检测试剂盒检测蛋白条带,利用天能化学发光成像分析系统获取图像。利用Image J软件分析每个条带积分吸收光度值,以目的蛋白与内参蛋白的积分吸光度比值表示目的蛋白表达水平。
1.6 FOXA1潜在靶基因的预测和筛选
利用hTF(Database of Human Transcription Factor Targets)数据库(http://bioinfo.life.hust.edu.cn/hTFtarget#!/),并结合Harmonizonme 数据库(https://maayanlab.cloud/Harmonizome/)进入ENCODE 和JASPAR 转录因子靶基因数据库综合预测FOXA1 的潜在靶基因。采用Venny2.1.0(https://bioinfogp.cnb.csic.es/tools/venny/)对数据进行汇总分析,使用Venn图对hTF,ENCODE和JASPAR 数据库预测的FOXA1 潜在靶基因与本课题组前期对THBEc1-ctrl 和THBEc1-ΔFOXA1-c34细胞转录组测序检出的差异表达基因取交集,综合预测FOXA1的潜在靶基因[17]。
1.7 RT-qPCR 检测THBEc1-ctrl 和THBEc1 -ΔFOXA1-c34 细胞中FOXA1 潜在靶基因的表达水平
收集对数生长期THBEc1-ctrl 和THBEc1-FOXA1-c34 细胞,利用TRIzol 试剂提取细胞总RNA。以总RNA为模板,使用FastKing cDNA第一链合成试剂盒合成cDNA。通过RT-qPCR 检测mRNA 水平,包括跨膜蛋白98(transmembrane protein 98,TMEM98)、IKAROS 家族锌指2(IKAROS family zinc finger 2,IKZF2)、IDH1、肿瘤坏死因子受体相关因子5(TNF receptor associated factor 5,TRAF5)、骨形态发生蛋白2 型受体(bone morphogenetic protein receptor type 2,BMPR2)、HSPB1、Runt 相关转录因子2(RUNX family transcription factor 2,RUNX2)、golgin A7 家族成员B(golgin A7 family member B,GOLGA7B)和维甲酸相关孤核受体A(RAR related orphan receptor A,RORA)共9 个基因表达水平。以GAPDH 作为内参,mRNA 相对表达水平以2-ΔΔCt表示。引物序列见表2。

Tab.2 mRNA primer sequences for RT-qPCR
1.8 FOXA1过表达质粒稳定转染细胞的构建和鉴定
1.8.1 构建
将THBEc1-ΔFOXA1-c34 细胞以每孔1.5×105密度接种于24 孔板中培养24 h,细胞密度60%~70%时进行转染。按照Lipofectamine®2000 转染试剂操作说明分别转染FOXA1过表达质粒和阴性对照质粒,同时设转染试剂组。于转染后48 h,使用含潮霉素100 mg·L-1的MEM 培养基进行抗性筛选,每2 d更换1次含潮霉素的培养基。潮霉素筛选10 d,转染试剂组细胞全部死亡后,使用不含潮霉素的MEM 完全培养基继续培养细胞。待细胞生长成克隆后,将全部克隆相继转到6 孔板和25 cm2培养瓶扩增培养,从而得到稳定转染FOXA1 过表达质粒和对照质粒的细胞。以THBEc1-ΔFOXA1-c34细胞作为亲本细胞构建的稳定表达FOXA1的细胞命名为THBEc1-ΔFOXA1-c34-oe 细胞,稳定转染对照质粒的细胞命名为THBEc1-ΔFOXA1-c34-ctrl细胞。
1.8.2 鉴定
收集对数生长期的THBEc1-ctrl,THBEc1-ΔFOXA1-c34,THBEc1-ΔFOXA1-c34-ctrl和THBEc1-ΔFOXA1-c34-oe 细胞,用Western 印迹法检测细胞中FOXA1表达水平,方法同1.5.2。
1.9 RT-qPCR 检测THBEc1-ΔFOXA1-c34-ctrl 和THBEc1-ΔFOXA1-c34-oe 细胞中FOXA1 潜在靶基因的表达水平
收集对数生长期THBEc1-ΔFOXA1-c34-ctrl和THBEc1-ΔFOXA1-c34-oe 细胞,用RT-qPCR 检测FOXA1潜在靶基因TMEM98,IKZF2,IDH1,TRAF5,BMPR2,HSPB1,RUNX2,GOLGA7B和RORA的表达水平,方法同1.7。
1.10 Western 印迹法检测THBEc1-ΔFOXA1-c34-ctrl 和THBEc1-ΔFOXA1-c34-oe 细胞中lDH1和HSPB1的表达水平
收集对数生长期THBEc1-ctrl,THBEc1-ΔFOXA1-c34,THBEc1-ΔFOXA1-c34-ctrl和THBEc1-ΔFOXA1-c34-oe细胞,用Western印迹法检测IDH1和HSPB1的表达水平。其中电转后的硝酸纤维素膜经5%脱脂奶粉室温封闭2 h 后,分别与IDH1 多克隆抗体(1∶500)、HSPB1 多克隆抗体(1∶10 000)和β 肌动蛋白抗体(1∶3000)4 ℃孵育过夜,继而与辣根过氧化物酶标记的二抗(1∶20 000)室温孵育2 h。其余方法均同1.5.2。
1.11 统计学分析
数据均为3 次重复实验的结果,以±s表示。利用SPSS 26.0 软件对数据进行统计学分析,Graphpad Prism 8.0 软件进行图表绘制。两组间比较采用Studentt检验,多组间比较采用单因素方差分析(ANOVA),组内两两比较采用Dunnettt检验。P<0.05表示差异具有统计学意义。
2 结果
2.1 预测和筛选靶向调控FOXA1的miRNA
利用TargetScan 7.2和ENCORI数据库分别预测到213 和145 个可能靶向调控FOXA1的miRNA。对数据库检索到的miRNA 和THBEc1 细胞(与16HBE比较)中下调的miRNA取交集,发现THBEc1细胞中下调的miR-584-5p,miR-142-5p 和miR-211-5p 潜在靶向调控FOXA1(图1A)。RT-qPCR结果显示,THBEc1细胞中上述3个miRNA的表达水平均低于16HBE细胞(P<0.01)(图1B)。
2.2 鉴定靶向调控FOXA1的miRNA
Western 印迹结果如图2 所示。在转染后48和72 h,BC,MC 和NC 组间FOXA1 蛋白表达水平无明显差异;miR-584-5p 模拟物和miR-211-5p 模拟物组THBEc1 细胞中FOXA1 蛋白表达水平均低于NC 组(P<0.01);而miR-142-5p 模拟物组THBEc1 细胞中FOXA1 蛋白表达水平与NC 组间无明显差异。提示miR-584-5p和miR-211-5p参与FOXA1转录后调控,两者均可下调FOXA1 蛋白的表达,miR-584-5p 和miR-211-5p 下调可能是BaP恶性转化细胞THBEc1 中FOXA1 蛋白表达水平上调的机制之一。而miR-142-5p 不参与FOXA1转录后调控。
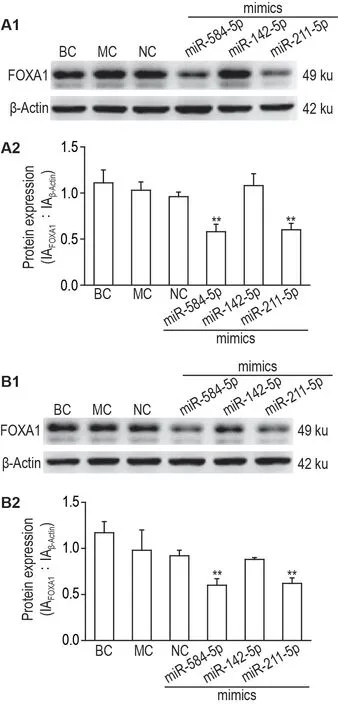
Fig.2 Expression levels of FOXA1 after transfection of miRNA mimics in THBEc1 cells for 48 h(A)and 72 h(B)by Western blotting.See Fig.1 for the cell treatment.BC:blank control cells;MC:mock control cells treated with Lipofection® 2000 reagent;NC:negative control cells transfected with negative mimics miR-584-5p:THBEc1 cells transfected with miR-584-5p mimics;miR-142-5p:THBEc1 cells transfected with miR-142-5p mimics;miR-211-5p:THBEc1 cells transfected with miR-211-5p mimics.A2 and B2 were the semi-quantitative results of A1 and B1,respectively.IA:integrated absorbance.±s,n=3.**P<0.01,compared with NC group.
2.3 预测和筛选FOXA1的潜在靶基因
通过检索hTF,JASPAR 和ENCODE 数据库,分别检索到17 450,1 442 和11 209 个基因含FOXA1 结合位点。将3 个数据库预测到的基因与THBEc1-ΔFOXA1-c34 和THBEc1-ctrl 细胞间的转录组测序后发现的1 195个差异表达基因(different expression genes,DEG)取交集,共发现20个基因在3个数据库中均被预测为FOXA1的潜在靶基因,并且在THBEc1-ΔFOXA1-c34和THBEc1-ctrl细胞间差异表达,结果如图3A所示。
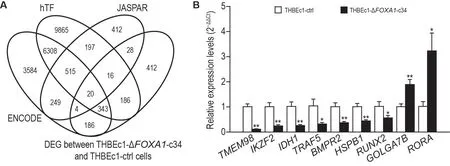
Fig.3 lntersection set of potential target genes of FOXA1 predicted by hTF,JASPAR,ENCODE databases and DEGs between THBEc1-ΔFOXA1-c34 and THBEc1-ctrl cells (A) and mRNA expression levels of indicated genes in THBEc1-ΔFOXA1-c34 and THBEc1-ctrl cells(B).THBEc1-ΔFOXA1-c34:monoclonal cell lines obtained after THBEc1 cells knocked out FOXA1;THBEc1-ctrl:THBEc1 cells transfected with negative control plasmid.±s,n=3.*P<0.05,**P<0.01,compared with THBEc1-ctrl cells.
本课题组前期工作证实了FOXA1在BaP恶性转化细胞THBEc1中发挥促进裸鼠体内成瘤及THBEc1细胞体外增殖和迁移的作用。在上述20个FOXA1的潜在靶基因中,TMEM98,IKZF2,IDH1,TRAF5,BMPR2,HSPB1,RUNX2,GOLGA7B和RORA参与肿瘤的发生发展有文献支持,故将这9 个基因作为候选基因,进一步研究FOXA1敲除对其mRNA表达水平的影响。结果如图3B 所示,FOXA1 蛋白表达缺失后,TMEM98,IKZF2,IDH1,TRAF5,BMPR2,HSPB1和RUNX2mRNA 表达水平均下调(P<0.05,P<0.01),GOLGA7B和RORAmRNA表达水平均上调(P<0.01,P<0.05)。
2.4 构建FOXA1 过表达细胞THBEc1-ΔFOXA1-c34-oe
Western 印迹结果(图4)显示,与THBEc1-ΔFOXA1-c34-ctrl 细胞相比,THBEc1-ΔFOXA1-c34-oe 细胞中FOXA1 蛋白表达恢复(P<0.01)。但THBEc1-ΔFOXA1-c34-oe细胞中FOXA1表达水平低于THBEc1-ctrl细胞(P<0.01);THBEc1-ΔFOXA1-c34 和THBEc1-ΔFOXA1-c34-ctrl 细胞中均未检出FOXA1 蛋白表达。由此表明,稳定表达FOXA1 的THBEc1-ΔFOXA1-c34-oe细胞模型构建成功。
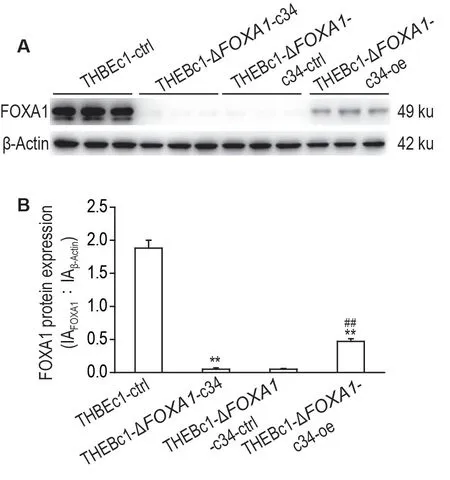
Fig.4 Expression levels of FOXA1 protein in THBEc1-ctrl,THBEc1-ΔFOXA1-c34,THBEc1-ΔFOXA1-c34-ctrl and THBEc1-ΔFOXA1-c34-oe cells by Western blotting(A).THBEc1-ΔFOXA1-c34-ctrl:THBEc1-ΔFOXA1-c34 transfected with negative control plasmid;THBEc1-ΔFOXA1-c34-oe:THBEc1-ΔFOXA1-c34 transfected with human FOXA1 gene ORF cDNA clone expressional plasmid.B was the semi-quantitative result of A.±s,n=3.**P<0.01,compared with THBEc1-ctrl cells;##P<0.01,compared with THBEc1-ΔFOXA1-c34-ctrl cells.
2.5 FOXA1过表达对THBEc1-ΔFOXA1-c34细胞中FOXA1潜在靶基因mRNA水平的影响
RT-qPCR 结果(图5)所示,THBEc1-ΔFOXA1-c34-oe 细胞中IDH1和HSPB1mRNA 表达水平较对照细胞THBEc1-ΔFOXA1-c34-ctrl上调(P<0.01),余7个基因的mRNA表达水平无明显差异。

Fig.5 mRNA expression levels of indicated genes in THBEc1-ΔFOXA1-c34-ctrl and THBEc1-ΔFOXA1-c34-oe cells by RT-qPCR.±s,n=3.**P<0.01,compared with THBEc1-ΔFOXA1-c34-ctrl cells.
2.6 敲除FOXA1 对THBEc1 细胞HSPB1 和lDH1蛋白表达的影响
Western 印迹结果(图6)所示,与THBEc1-ctrl细胞相比,THBEc1-ΔFOXA1-c34 细胞中IDH1 和HSPB1 表达水平显著下调(P<0.01);与THBEc1-ΔFOXA1-c34-ctrl 细胞相比,THBEc1-ΔFOXA1-c34-oe 细胞中IDH1 和HSPB1 表达水平显著上调(P<0.01)。表明FOXA1 表达水平的改变可影响IDH1和HSPB1的表达。
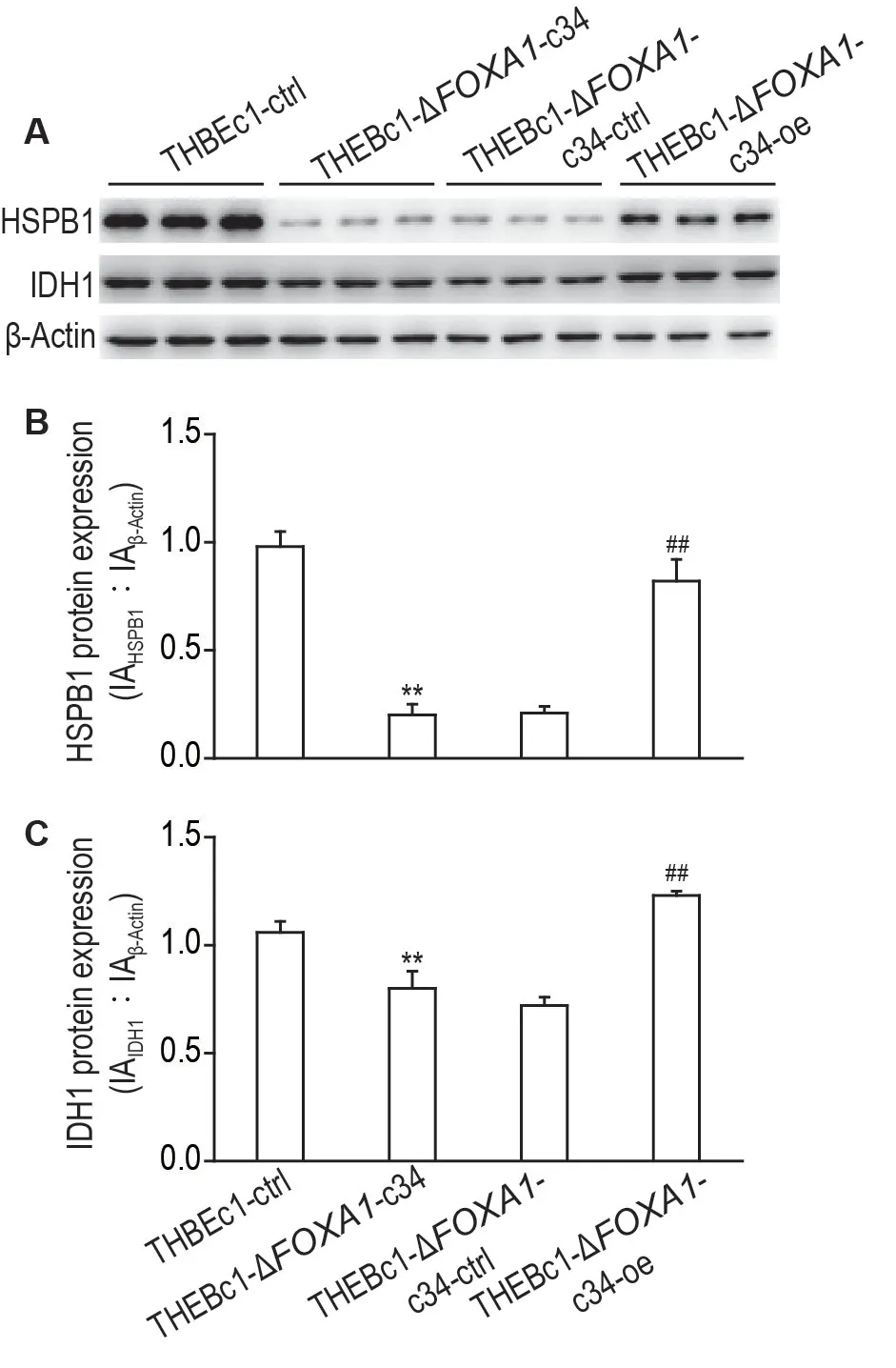
Fig.6 Expressions of HSPB1 and lDH1 in THBEc1-ctrl,THBEc1-ΔFOXA1-c34,THBEc1-ΔFOXA1-c34-ctrl and THBEc1-ΔFOXA1-c34-oe cells by western blotting(A).See Fig.4 for the cell treatment.B and C were the semi-quantitative results of A.±s,n=3.**P<0.01,compared with THBEc1-ctrl cells;##P<0.01,compared with THBEc1-ΔFOXA1-c34-ctrl cells.
3 讨论
本研究结果表明,在THBEc1 细胞中表达下调的miR-584-5p 和miR-211-5p 对FOXA1基因发挥转录后调控作用。通过对FOXA1敲除细胞THBEc1-ΔFOXA1-c34 与对照细胞THBEc1-ctrl 进行mRNA表达差异分析,以及对THBEc1-ΔFOXA1-c34 细胞进行FOXA1 功能回补,发现了可能受FOXA1 调控的2 个潜在靶基因,IDH1和HSPB1,提示miR-584-5p / miR - 211 - 5p-FOXA1-IDH1 /HSPB1轴可能在BaP致癌中发挥作用。
目前已发现多种miRNA 在多种肿瘤中表达失调,且影响肿瘤细胞的增殖、迁移和凋亡等生物学事件。miRNA 表达失调可进一步导致靶基因表达失调,继而影响靶基因参与的信号通路,这可能是miRNA 参与肿瘤发生发展过程的重要方式。鉴于miRNA 在肿瘤发生发展中的重要作用,本研究重点关注了FOXA1的miRNA 调控,以探究BaP 恶性转化细胞THBEc1 中FOXA1 蛋白表达水平上调的可能机制。已有文献报道,miR-132,miR-200a 和miR-100 等多种miRNA 可通过靶向负调控FOXA1参与甲状腺癌、胶质瘤和乳腺癌等多种肿瘤细胞的增殖、迁移和凋亡等,从而发挥肿瘤抑制因子的作用[18-20]。本研究综合数据库检索、miRNA 测序、RT-qPCR 以及miRNA 模拟物转染实验的证据,首次证实了miR-584-5p 和miR-211-5p 对FOXA1的负调控作用,说明miR-584-5p 和miR-211-5p 下调是导致THBEc1 细胞FOXA1 蛋白表达水平上调的原因之一。miR-584-5p和miR-211-5p已被证实在非小细胞肺癌(non-small-cell lung cancer,NSCLC)、骨肉瘤、胃癌、肝癌等肿瘤中表达下调,并通过靶向相关基因,发挥肿瘤抑制因子作用,从而影响肿瘤的发生发展[21-23]。如miR-584-5p 在NSCLC 中表达下调,并通过靶向负调控YKT6 和基质金属蛋白酶14 抑制NSCLC 的迁移、侵袭和血管生成[21-22]。下调miR-584-5p 可导致胃癌细胞中WW 结构域E3 泛素蛋白连接酶1 过表达,从而激活肿瘤生长因子-β 信号通路,促进增殖并抑制凋亡[23]。另外,在肝癌细胞中miR-584-5p 亦参与对细胞周期蛋白依赖性激酶16 的调控[24]。有关miR-211-5p,已有文献报道其参与调控肿瘤相关的增殖、迁移、侵袭、血管生成和凋亡等,在肾细胞癌、胶质瘤、肝癌、骨肉瘤和三阴性乳腺癌等肿瘤中常表达下调[25-29]。在肾细胞癌中,过表达miR-211-5p 可导致上皮间充质转化(epithelial-mesenchymal transition,EMT)关键转录因子蜗牛家族转录抑制因子1(encoding snail family zinc finger 1,SNAI1)表达下调,从而抑制肿瘤细胞体外迁移和侵袭及体内转移[25]。在胶质瘤细胞中,miR-211-5p可以负调控同源盒基因C8 的表达,影响迁移和增殖[26]。体外研究表明,miR-211-5p 可通过负调控酰基辅酶长链家族成员4抑制肝癌细胞增殖、迁移和侵袭[27]。在骨肉瘤中,miR-211-5p 可通过负调控富含脯氨酸蛋白11,抑制肿瘤细胞迁移、侵袭,同时促进肿瘤细胞凋亡[28]。在三阴性乳腺癌中,miR-211-5p可通过靶向负调控沉默信息调节因子1,抑制肿瘤细胞增殖、侵袭、迁移和转移[30]。亦有证据显示,miR-211-5p 在前列腺癌、宫颈癌、甲状腺癌和胶质母细胞瘤中可分别对壳多糖酶3 样蛋白1、性别决定区Y 框蛋白4、丙酮酸脱氢酶激酶5 和阴阳-1 发挥转录后调控作用[30-33]。在上述文献报道的miR-211-5p 的靶基因中,SNAI1 在BaP 恶性转化细胞THBEc1 中mRNA表达水平较对照细胞16HBE 上调1.48 倍(P<0.01),提示miR-211-5p/SNAI1 轴可能是THBEc1细胞呈高迁移和侵袭表型的机制之一。值得注意的是,课题组前期工作已证实ALCAM 受miR-211-5p 调控,敲除ALCAM可抑制THBEc1 细胞体外增殖和裸鼠体内成瘤,但促进THBEc1 细胞的体外迁移和体内转移[6]。本研究证实,FOXA1亦是miR-211-5p 的下游靶基因,而敲除FOXA1可抑制THBEc1 细胞体外增殖、迁移以及裸鼠体内成瘤和转移[15]。由此推断,以miR-211-5p 为靶点,通过上调其表达将可能同时对FOXA1和ALCAM发挥负调控作用,抑制肿瘤细胞增殖而不增加转移风险,相关研究工作值得开展。
研究发现,敲除FOXA1可导致BaP 恶性转化细胞THBEc1 转录组显著改变[17]。上述发现虽然提示FOXA1 直接或间接参与多种生物学事件,但欲阐明其直接参与的信号通路或网络,则有赖于对FOXA1靶基因的鉴定。本研究在对FOXA1敲除细胞THBEc1-ΔFOXA1-c34 与对照细胞THBEc1-ctrl转录组差异分析的基础上,通过对THBEc1-ΔFOXA1-c34 细胞进行FOXA1 功能回补,发现IDH1和HSPB1可能是受FOXA1 调控的2 个潜在靶基因。
IDH1 主要催化异柠檬酸氧化脱羧生成α-酮戊二酸。IDH1基因编码的蛋白质是在细胞质和过氧化物酶体中发现的NADP+依赖性IDH,在细胞质NADPH 产生中起着重要作用。IDH1异常表达见于多种肿瘤。研究发现,IDH1在原发性胶质瘤中表达上调,并且其过表达可促进肿瘤细胞迁移[34]。Chen 等[35]通过对139 例NSCLC 患者血清IDH1 水平检测发现,NSCLC 患者血清中IDH1 水平显著高于健康对照和良性肺部疾病患者,提示IDH1 可能作为NSCLC 早期诊断的潜在标志物。Yang 等[36]研究发现,IDH1在结直肠癌中高表达并指示高级别肿瘤,而且IDH1 的高表达与结直肠癌对5-氟尿嘧啶的耐药性有关。Zheng 等[37]研究发现,高IDH1水平与高骨肉瘤患者预后不良有关,HSP90 ATP酶活性激活因子1 可通过正向调节IDH1 促进骨肉瘤细胞生长和转移。Charitou 等[38]研究发现,在宫颈癌细胞中敲低叉头框O蛋白后过表达IDH1,可逆转α-酮戊二酸和NADPH/NADP+水平下调。本研究发现IDH1受FOXA1 正调控,且IDH1在BaP 恶性转化细胞THBEc1中mRNA表达水平是对照细胞16HBE 的1.69 倍(P<0.01),提示FOXA1 可能通过上调IDH1发挥其癌基因作用。
HSPB1是本研究发现的另一个受FOXA1调控的潜在靶基因。该基因编码小热休克蛋白家族的一个成员,亦称HSP27。在应对环境应激时,HSPB1蛋白从细胞质转移到细胞核,作为分子伴侣促进其他蛋白质的正确折叠,从而参与蛋白的质量控制[39]。HSPB1基因的表达与多种人类癌症的不良临床预后相关,HSPB1蛋白可能促进癌细胞增殖和转移,同时保护癌细胞免于凋亡[40-41]。多种肿瘤中HSPB1表达失调已有文献报道。Huang 等[42]研究发现,HSPB1 在NSCLC 患者癌组织和血清中均上调,而且HSPB1 上调与肿瘤分化不良、淋巴转移和不良预后有关。Sun 等[43]研究发现,在肿瘤细胞中敲低HSBP1可促进铁死亡诱导剂Erastin引起的铁死亡,提示HSPB1 可能是肿瘤细胞铁死亡的负调节因子,在铁代谢中发挥作用。此外,研究亦发现,HSPB1 与胃癌、肝癌、前列腺癌、肺癌和结直肠癌等多种肿瘤的耐药性有关[44]。如在卵巢癌细胞中,HSPB1的过表达通过抑制P21从细胞核转位至细胞质,从而诱导细胞对顺铂的耐药性[45]。在前列腺癌中,HSPB1通过调节STAT3/Twist参与白细胞介素6 介导的EMT 从而驱动EMT,而其减弱逆转EMT 并降低细胞迁移、侵袭和基质金属蛋白酶活性[46]。在胃癌细胞中,FYN 过表达且可以通过FYN/杀伤性T 细胞来源的蛋白激酶HSPB1 轴介导细胞增殖和侵袭[47]。本研究结果表明,敲除FOXA1后HSPB1表达下调,而FOXA1回补可使HSPB1表达上调,提示FOXA1对HSPB1具有调控作用。值得注意的是,与对照细胞16HBE 比较,在FOXA1 表达上调的THBEc1 细胞中,HSPB1mRNA 表达水平无明显改变(差异倍数为0.87,P=0.283),但HSPB1 蛋白表达水平显著降低(差异倍数为0.14,P=0.001),提示除FOXA1 外,可能其他机制如miRNA、泛素降解系统等对HSPB1 的调控在THBEc1 细胞中发挥主导作用,相关机制值得深入研究。
综上所述,BaP 恶性转化细胞THBEc1 中miR-584-5p/miR -211-5p-FOXA1 轴参与IDH1和HSPB1转录调控。BaP 可能在诱发细胞恶性转化过程中引起miR-584-5p 和miR-211-5p 表达下调,继而导致FOXA1 蛋白表达上调。上调IDH1可能是FOXA1 在THBEc1 细胞中发挥癌基因作用的机制之一。BaP 诱导miR-584-5p 和miR-211-5p 表达下调的机制及IDH1 在THBEc1 细胞恶性表型中的作用仍需进一步研究。

