T-2毒素抗人食管癌细胞EC1的活性及其机制
马永成,范霞霞,苏楠
(1.河南省人民医院药学部,郑州大学华中阜外医院药学部临床药理室,河南 郑州 450003;2.河南牧业经济学院食品与生物工程学院,河南 郑州 450011)
恶性肿瘤是威胁人类健康的重大疾病。国家癌症中心最新发布的《2022年全国癌症报告》显示,我国恶性肿瘤发病率及死亡数持续上升,每年恶性肿瘤所致的医疗花费超过2200亿[1]。由此可见,继续研发新的高效抗癌药物仍十分迫切。真菌来源的天然产物具有广泛的生物活性,是活性天然产物及临床药物研发的重要分子库和灵感来源。T-2 毒素属于镰刀菌(Fusarium)所产生的单端孢霉烯族毒素,是该类毒素中毒性最强的一种毒素[2]。T-2毒素结构中含有氧环和双键活性单元,化学性质稳定,室温下放置7 年毒性不减[3]。近年研究表明,其通过抑制蛋白质和DNA 合成,对胸腺、骨髓、肝、脾和生殖腺等细胞分裂旺盛的脏器毒性明显;此外,T-2 毒素还可引起细胞DNA 单链断裂以及线粒体损伤,诱导细胞凋亡[4]。癌细胞也具有旺盛分裂的特征,推测T-2 毒素对肿瘤细胞可能具有较强的抑制活性。本研究从细胞增殖、细胞凋亡、细胞周期阻滞和蛋白表达等水平研究T-2 毒素的抗癌作用,并探讨其可能的作用机制。
1 材料与方法
1.1 药品、试剂和主要仪器
T-2 毒素(纯度98%,批号902030),北京百灵威科技有限公司,使用二甲亚砜(DMSO)配成50 mmol·L-1的储备液,使用前用培养基稀释至所需浓度(使DMSO 终浓度<0.1%)。MTT、活性氧(reactive oxygen species,ROS)检测试剂2,7-二氯荧光素二乙酸酯(2',7'-Dichlorodihydrofluorescein diacetate,DCFH-DA)、线粒体膜电位检测试剂JC-1和线粒体提取试剂盒,上海碧云天生物技术有限公司;胎牛血清,美国Gibco 公司;青链霉素混合液(100×)、FITC-annexin Ⅴ/PI 双染细胞凋亡检测试剂盒和碘化丙啶(PI),北京索莱宝科技有限公司;兔抗人GAPDH(AB-P-R001)多克隆抗体,杭州贤至生物科技公司;兔抗人多聚ADP-核糖聚合酶(poly ADP-ribose polymerase,PARP)(46D11)、P21(12D1)和磷酸化的组蛋白2A 家族X 成员(phosphorylated H2A histone family member X,γ-H2AX)(Ser139,20E3)单克隆抗体,美国CST公司;小鼠抗人P53(6C4B6)、Bax(4G5E8)、细胞色素c(2D8D11)、细胞色素c 氧化酶Ⅳ(cytochrome c oxidase Ⅳ,COXⅣ)(2A7B2)、胱天蛋白酶3(2G4B2)和胱天蛋白酶7(3C9H4)单克隆抗体,美国Proteintech 公司;辣根过氧化酶标记的羊抗鼠/兔IgG 抗体(二抗),中杉金桥公司;ECL 发光液,美国Advansta公司。
多功能酶标仪(Meta-Ready),德国BMG公司;实时无标记动态细胞分析(real time cell analysis,RTCA)仪(xCELLigence RTCA DP),美国Agilent公司;流式细胞仪(Accuri C6 Plus),美国BD公司;荧光显微镜(Eclipse Ni-U),日本Nikon公司;凝胶成像系统(Tanon4600SF),上海天能生命科学有限公司。
1.2 细胞和细胞培养
人食管癌细胞EC109 和EC1,人胃癌细胞MGC-803 和人肺癌细胞H460 购自中国科学院典型培养物保藏委员会细胞库;人正常胃黏膜细胞GES-1 由本实验室传代冻存。于RPMI 1640培养基中分别加入胎牛血清(体积比10%)、青霉素(终浓度为1×108U·L-1)和链霉素(终浓度为100 g·L-1),配制完全培养液。所有细胞均使用该完全培养基在37 ℃,CO2细胞培养箱中培养。
1.3 MTT法测定细胞存活率
将人食管癌细胞EC109 和EC1,人胃癌细胞MGC-803 和人肺癌细胞H460,以及人正常胃粘膜细胞GES-1,以每孔5×103细胞接种于96 孔板,培养细胞至充分贴壁,加入T-2 毒素,使终浓度分别为0.375,0.75,1.5,3.0,6.25,12.5,25,50 和100 nmol·L-1,每浓度设6复孔。作用24,48或72 h后,加入MTT 溶液(终浓度为0.5 g·L-1),孵育4 h后,去除原培养基,加DMSO(每孔150 μL),室温摇动15 min;充分溶解紫色结晶物后,使用酶标仪于490 nm 处测定吸光度(A490nm)值。细胞存活率(%)=(T-2 组A490nm-空白组A490nm/细胞对照组A490nm-空白组A490nm)×100%。
1.4 RTCA法实时分析EC1细胞增殖和迁移
1.4.1 细胞增殖实验
参照文献[5],利用RTCA 技术进行细胞增殖分析。将EC1细胞以每孔4×103接种于RTCA专用板E-Plate 中,每孔加入RPMI 1640 完全培养基150 μL 后置于RTCA 设备中。将上述装有E-Plate板的设备放入培养箱中,24 h 培养贴壁后,将细胞分为细胞对照组和T-2 毒素5,10 和20 nmol·L-1组,每组3 复孔。给药后将RTCA 设备再次放入细胞培养箱中,设定RTCA 每30 min 检测1次细胞指数(cell index,CI)值,于72 h 后停止检测。CI 值越低,说明细胞增殖程度越小。
1.4.2 细胞迁移实验
取对数生长期EC1 细胞,以无血清培养基制成细胞悬液,并调整细胞密度为1×108L-1,取160 μL细胞悬液接种至专用板上室中(CIM-Plate 16),下室中加入120 μL 含血清培养基。将细胞分为细胞对照组和T-2毒素5和10 nmol·L-1组。细胞迁移通过微孔膜,然后沉积到金阻抗电极上,使用RTCA每隔3 h记录1次CI值,至48 h。
1.5 流式细胞仪检测EC1 细胞早期凋亡率、细胞周期和ROS水平
T-2 毒素5,10 和20 nmol·L-1作用EC1 细胞48 h 后,离心收集细胞。按照试剂盒说明书进行FITC-annexinⅤ和PI荧光染料双染色,通过流式细胞仪分析细胞凋亡率。使用预冷的70%乙醇垂悬细胞,4 ℃放置12 h。弃去上清液,PBS 洗2 遍后,利用荧光染色液(含有RNA 酶和100 mg·L-1PI)室温避光染色30 min。流式细胞仪检测DNA 含量,FlowJo 软件分析细胞周期。加入适当体积无血清培养基配制的ROS 检测探针DCFH-DA(10 μmol·L-1),在培养箱中孵育30 min。使用无血清培养基洗涤细胞,去除未结合的DCFH-DA,流式细胞仪检测荧光值,以与细胞对照组荧光强度比值表示ROS水平。
1.6 荧光显微镜和流式细胞仪分别检测EC1 细胞线粒体膜电位
参照文献[6],将EC1 细胞接种于6 孔板,使用T-2毒素5,10,20 nmol·L-1分别作用细胞48 h;将细胞离心收集于1.5 mL EP 管中,每管样品中加入适量体积的JC-1 溶液(PBS稀释至终浓度10 mg·L-1)垂悬细胞,置于细胞培养箱中荧光染色15~30 min;用荧光显微镜或流式细胞仪分别对MMP 进行定性和定量分析。
1.7 Western 印迹法检测细胞质和线粒体中细胞色素c含量及细胞中PARP、P21、γ-H2AX、P53、Bax和胱天蛋白酶3/7蛋白表达水平
将EC1 细胞以每孔6×104接种于6 孔板,细胞分为细胞对照组和T-2 毒素5,10 和20 nmol·L-1组,T-2 毒素作用细胞48 h 后,①参照线粒体分离试剂盒操作说明,提取各组细胞线粒体并保留胞质部分;②所得样品分别经SDS-PAGE 电泳后,电转印到醋酸纤维素膜;利用5%脱脂奶粉室温膜封闭2 h,加入一抗(①抗细胞色素c、COX Ⅳ和GAPDH抗体;②抗PARP,P21,γ-H2AX,P53,Bax,胱天蛋白酶3/7 和GAPDH 抗体,均1∶1000 稀释),4 ℃孵育过夜;充分洗膜后,加二抗(1∶6000)室温下孵育2 h,加ECL 发光液,利用凝胶成像系统拍照保存结果。利用Image J 软件测定目标蛋白积分吸光度值(integrated absorbance,IA),以目标蛋白IA 与内参蛋白IA比值表示目标蛋白的表达水平。
1.8 统计学分析
实验结果数据以±s表示,采用GraphPad 6.0软件进行统计分析和作图。多组间样本均数比较采用单因素方差分析,两组间比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 T-2毒素对4种癌细胞存活的抑制活性
如图1A 所示,T-2 毒素显著抑制4 种癌细胞存活,且在0~25 nmol·L-1浓度范围内,细胞生存率随着T-2 浓度升高而降低。T-2 毒素对EC109,EC1,MGC-803 和H460 细胞的IC50值分别为6.34,5.54,6.94 和5.96 nmol·L-1,对GES-1 的IC50值为16.4 nmol·L-1;在1.5~25 nmol·L-1范围内,上述4种癌细胞存活率与GES-1 存活率相比明显降低(P<0.01)。图1B显示,T-2对EC1细胞的抑制作用呈现明显的时间依赖性,24,48 和72 h 的IC50值分别为77.8,11.4 和6.0 nmol·L-1。由于EC1 相对敏感,后续研究皆以EC1为细胞模型;同时根据上述IC50值,选择T-2 毒素5,10 和20 nmol·L-1作用该细胞48 h进行研究。
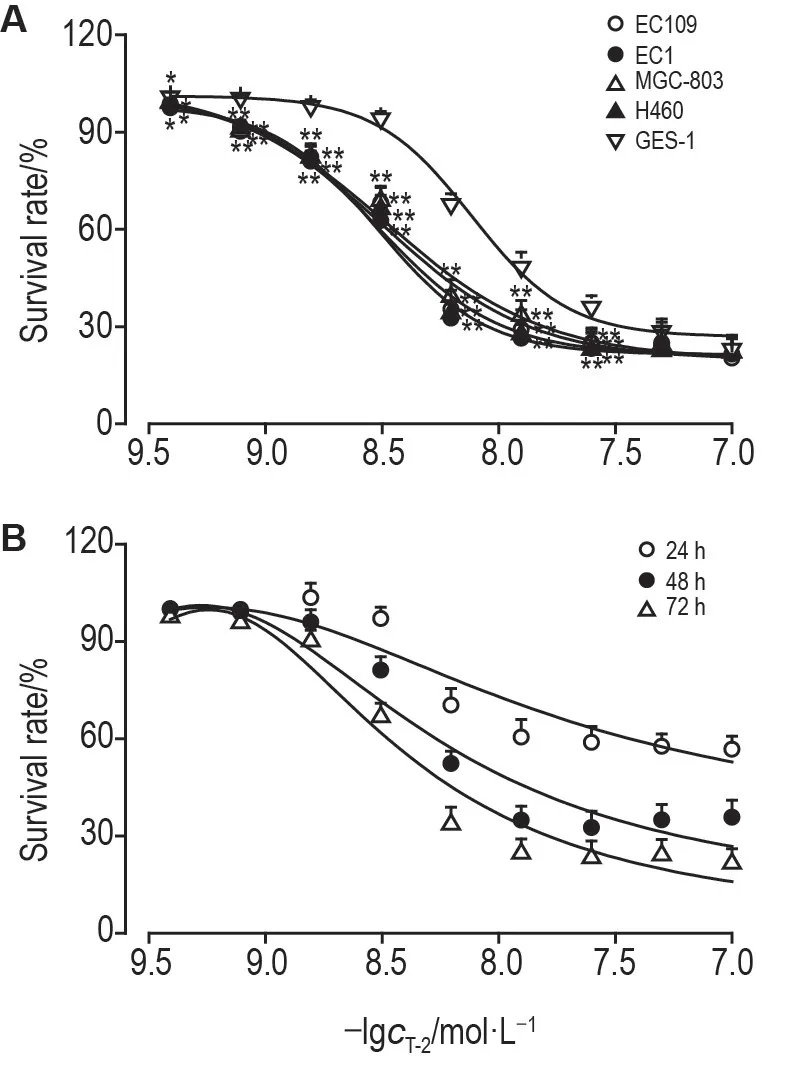
Fig.1 Effect of T-2 toxin on survival rate of four cancer cells and GES-1 cells by MTT assay.A:four cancer cells,EC109,EC1,MGC-803 and H460,as well as human gastric epithelial cells GES-1 were treated with T-2 toxin 0.375-100 nmol·L-1 for 72 h,respectively.B:the survival rate of EC1 cells after being treated by T-2 toxin for 24,48 h or 72 h.±s,n=6.*P<0.05,**P<0.01,compared with GES-1.
2.2 T-2毒素抑制EC1细胞增殖和迁移
由图2A 可见,24 h 时加入T-2 毒素5,10 和20 nmol·L-1,从36 h 开始至检测结束,各浓度组细胞活力(CI)值均明显小于细胞对照组,且浓度越高,CI 值越小;在48 h 后,各浓度组CI 值与细胞对照组比较明显降低(P<0.01)。由图2B 可见,T-2毒素处理组CI值显著低于细胞对照组(P<0.01),提示T-2 毒素处理组细胞迁移通过微孔膜的细胞数下降。表明T-2毒素抑制EC1细胞的生长和迁移。
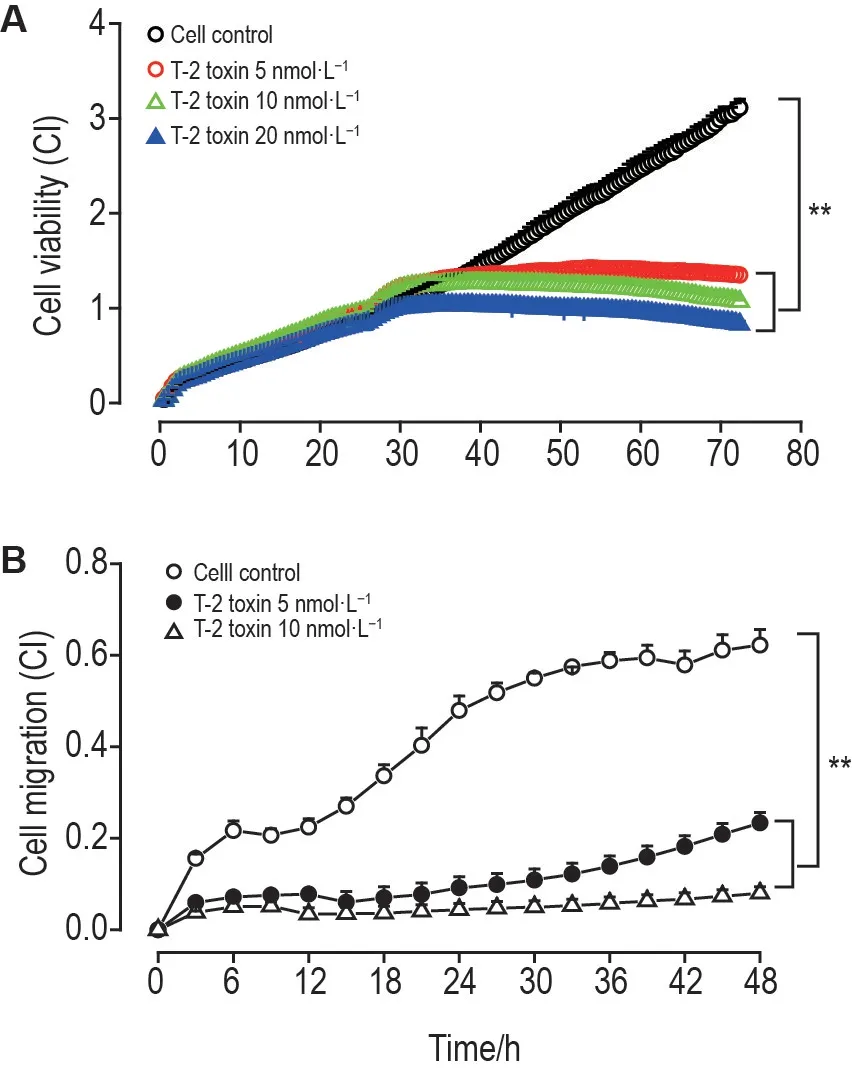
Fig.2 Effect of T-2 on cell viability(A)and cell migration(B)of EC1 cells.EC1 cells were treated with T-2 toxin and the viability and migration were measured by real time cell analysis (RTCA).CI:cell index.±s,n=3.**P<0.01,compared with cell control group.
2.2 T-2毒素诱导EC1细胞凋亡
图3A 结果显示,与细胞对照组相比,T-2 毒素5,10 和20 nmol·L-1组细胞早期凋亡率和晚期凋亡率均显著升高(P<0.01);Western 印迹结果表明,与细胞对照组相比,T-2 毒素各浓度组细胞内酶原形式PARP明显减少,剪切形式PARP显著增加(图3B,P<0.01)。表明T-2毒素可诱导EC1细胞凋亡。
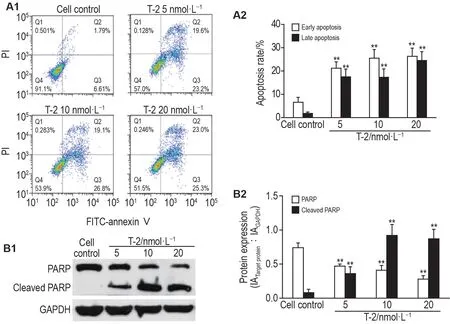
Fig.3 Effect of T-2 toxin on apoptosis in EC1 cells.After treatment with T-2 toxin for 48 h,EC1 cells were stained with FITCannexin V/PI and analyzed by flow cytometry(A),or were extracted with proteins,and the cleavage of PARP was detected by Western blotting(B).A2 and B2 were the quantitative results of A1 and B1,respectively.IA:integrated absorbance.±s,n=3.**P<0.01,compared with cell control group.
2.3 T-2毒素诱导EC1细胞周期阻滞
图4A 结果显示,T-2 毒素5,10 和20 nmol·L-1组G2/M 期细胞比例分别为(12.5±3.3)%,(18.7±3.8)%和(24.7±2.7)%,与细胞对照组(7.5±2.7)%相比显著升高(P<0.01);与细胞对照组相比,T-2毒素可明显上调周期抑制蛋白P21 的表达(P<0.01)(图4B)。表明T-2 毒素可将细胞周期阻滞于G2/M期,其机制可能与P21表达上调有关。
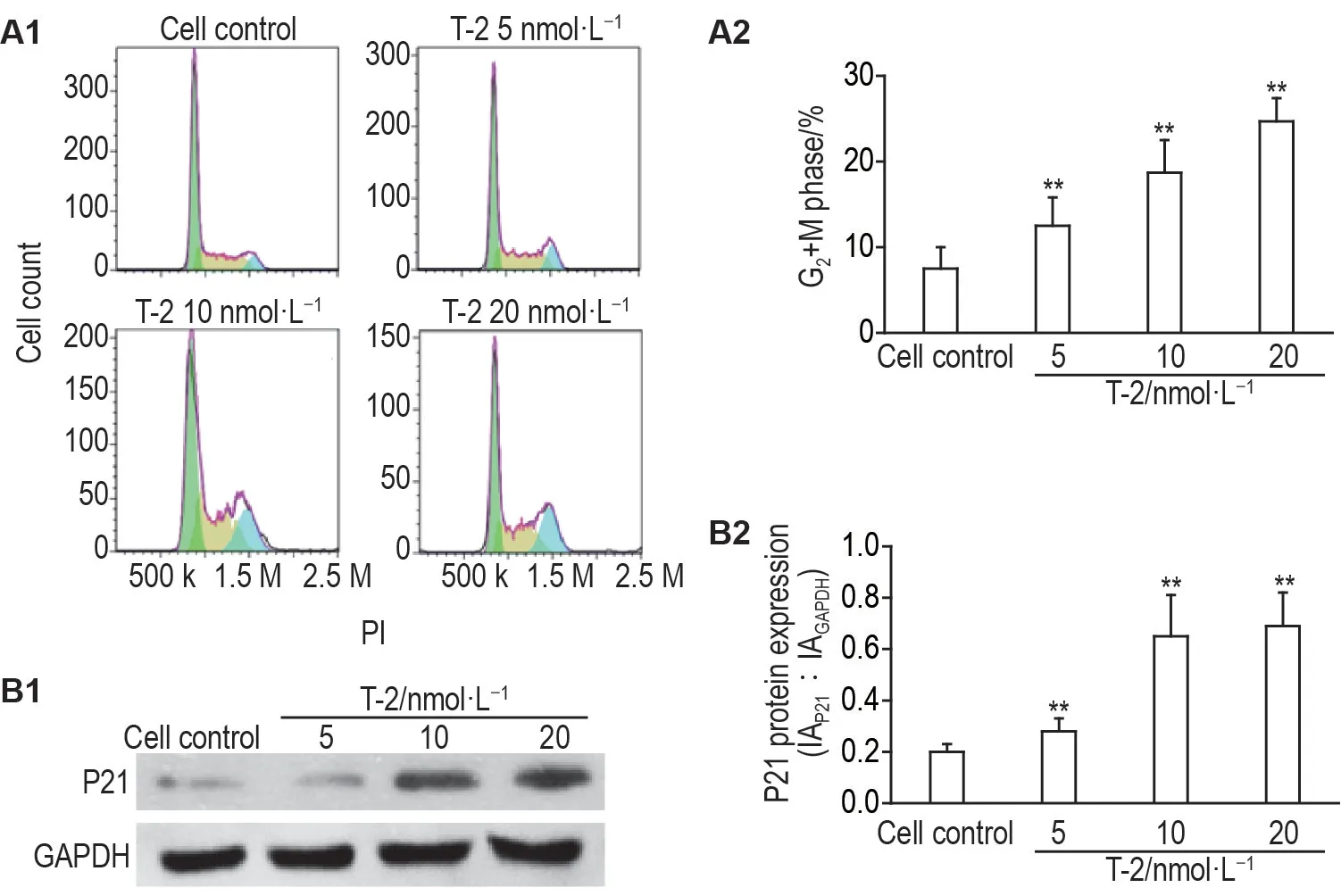
Fig.4 Effect of T-2 toxin on cell cycle distribution in EC1 cells.See Fig.3 for the cell treatment PI.A:cell cycle distribution detected by flow cytometry,A2 was the quantitative result of A1.B:P21 expression detected by Western blotting,B2 was the semiquantitative result of B1.±s,n=3.**P<0.01,compared with cell control group.
2.4 T-2毒素诱导EC1细胞线粒体膜电位降低
图5A 结果显示,细胞对照组呈现强红橙色荧光,而T-2毒素组橙色荧光减弱且绿色荧光增强,表明T-2 毒素诱导了MMP 下降;与细胞对照组相比,T-2 毒素5,10 和20 nmol·L-1组MMP 显著下降(P<0.01)(图5B)。Western 印迹实验结果(图5C)显示,与细胞对照组相比,T-2 毒素组线粒体中细胞色素c 显著下降(P<0.01),而细胞质中细胞色素c 含量却显著增加(P<0.01)。上述结果表明,T-2 毒素可使EC1 细胞MMP 下降,使细胞色素c 释放,这可能是其诱导细胞凋亡的原因之一。

Fig.5 Effect of T-2 toxin on mitochondrial membrane potential(MMP)of EC1 cells.See Fig.3 for the cell treatment.A:the drop of MMP in EC1 cells imaged by fluorescence microscopy(200×).B1:the changes of MMP quantified by flow cytometry,numbers in the bottom right gate represented the percentage of cells with low MMP;B2 was the statistical result of B1.C1:cytochrome c(Cyt c)release determined by Western blotting;C2 and C3 were the semi-quantitative results of C1.Cyt c oxidase Ⅳ(COX Ⅳ)and GAPDH were used as loading controls in mitochondria and cytoplasm,respectively.±s,n=3.**P<0.01,compared with cell control group.
2.5 T-2 毒素对EC1 细胞ROS 水平,γ-H2AX,P53和Bax表达及对胱天蛋白酶3/7活化的影响
图6A 结果显示,与细胞对照组相比,T-2 毒素可增加EC1 细胞内ROS 水平(P<0.01)。Western印迹结果(6B 和6C)显示,与细胞对照组相比,T-2毒素组γ-H2AX,P53 和Bax 表达增加(P<0.05,P<0.01),并诱导了胱天蛋白酶3/7 剪切活化增加(P<0.05,P<0.01)。表明T-2毒素诱导的MMP下降和细胞凋亡可能与上述结果有关。
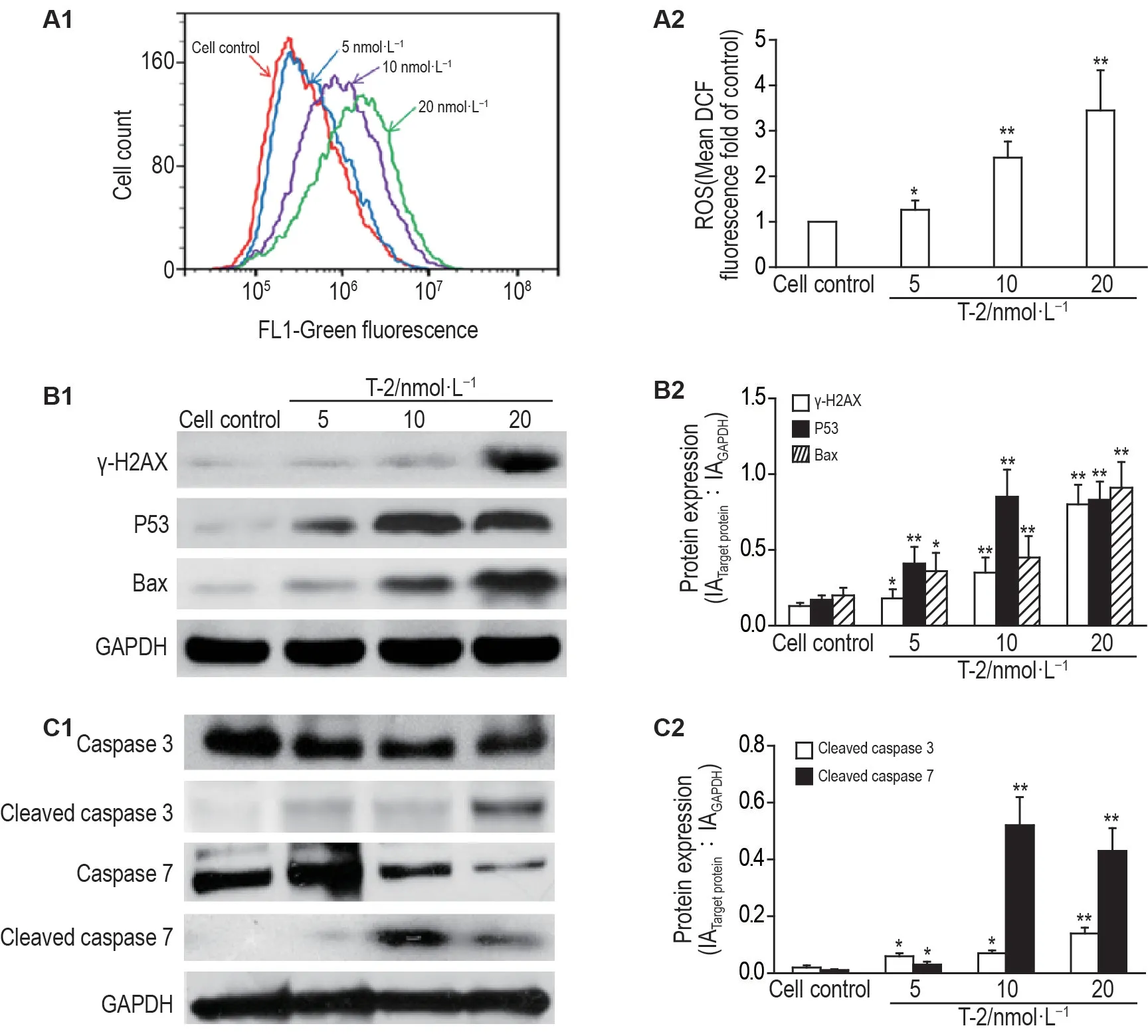
Fig.6 Effects of T-2 toxin on levels of ROS and protein expressions of γ-H2AX,P53,Bax and caspase3/7 in EC1 cells.See Fig.3 for the cell treatment,except that the cells were stained with DCFH-DA.A1:the intracellular levels of ROS determined by flow cytometer;A2 was the statistical analysis result of A.B1 and C1:protein levels measured by Western blotting.B2 and C2 were the semi-quantitative results of B1 and C1,respectively.±s,n=3.*P<0.05,**P<0.01,compared with the cell control group.
3 讨论
本研究结果表明,T-2毒素可通过诱导凋亡和周期阻滞方式抑制癌细胞增殖,浓度在0.75 nmol·L-1时即展现出明显抗癌活性。机制研究提示,T-2 毒素增加胞内ROS 水平,致使DNA 氧化损伤,激活转录因子P53表达,从而激活其靶基因p21(周期抑制因子)和Bax(线粒体靶向蛋白)的转录表达,最终引起癌细胞周期阻滞和线粒体参与的细胞凋亡。
相对于正常细胞,癌细胞更加依赖胞内氧化还原系统的平衡[7]。本研究结果也表明,正常胃黏膜细胞GES-1对T-2毒素的敏感性弱于癌细胞。T-2毒素结构中的氧环和双键倾向与细胞内含巯基的蛋白分子、多肽或氨基酸结合,如半胱氨酸和谷胱甘肽等,从而可引起氧化还原系统的失衡,导致ROS水平的升高与累积[3]。过量ROS 可引起DNA 损伤,继而诱导p53和其下游基因的表达[8]。本研究亦发现,T-2 毒素可导致EC1 细胞ROS 增多,过量ROS导致DNA的氧化损伤(γ-H2AX增多),从而诱导抑癌因子P53表达,继而转录激活P21、Bax等靶基因的表达,引起细胞周期阻滞和凋亡的发生。因此推测,氧化还原系统可能是T-2 毒素的一个重要靶点,但具体作用于哪个环节需进一步研究。
虽然本研究结果表明,T-2 毒素抑制癌细胞的IC50值低至纳摩尔级,较临床现有的多种化疗药物表现出更强的细胞毒性[9],但T-2 毒素的肿瘤选择性仍然较差,其对人体正常组织的不良反应不容忽视。为解决这一问题,研究人员已做了一些有意义的工作,如对其结构进行修饰以降低系统毒性[10]、利用肿瘤特异性单克隆抗体[11-12]或pH 敏感的脂质体包载T-2毒素[13]以提高肿瘤细胞的靶向性。这些研究为T-2 毒素未来的开发应用提供了技术手段,也为本文提供了理论支撑。
总之,T-2 毒素具备良好的抗癌潜力,对其进行深入研究或寻找类似结构的新型抗癌药物具有重要的科研和应用价值。

