加热-超声-pH 偏移联合改性大豆球蛋白纳米颗粒的制备及稳定性研究
李春强,刘 俊,赵虹霏,谢文茹,邵俊花,张铭芸
(沈阳农业大学食品学院 沈阳 110866)
乳液是由两种互不相容的液体借助乳化剂形成的亚稳态体系,乳化剂因能降低自由能,减少界面张力,故常用于稳定乳液体系。Pickering 乳液是由纳米级/微米级的固体颗粒直接吸附在油-水界面的稳定乳液[1-2]。相较小分子表面活性剂,固体颗粒更容易吸附在油-水界面上,可抑制奥斯瓦尔德熟化,使液滴间形成物理屏障,稳定乳液[1,3-5],具有安全性高、兼容性强、易生物降解等优势[6],广泛应用于替代脂肪[7],包埋、输送活性物质[8],延长食品保质期等方面[9]。食品级Pickering 乳液中固体颗粒的主要原料是来源广泛且廉价的蛋白质、淀粉、脂肪等材料,通过物理方法(如加热、超声、高压均质)[10-11]或化学方法(如糖基化、pH 偏移)[12]等进行表面修饰以提高其乳化性能。例如,加热能使蛋白表面疏水基团暴露出来[13];pH 偏移可改变蛋白间静电斥力,提高空间位阻[14-16];超声处理引起空化效应使聚集的蛋白分散,暴露出更多活性基团,改善理化和功能特性[17-19]。采用单一方法改性植物蛋白的技术虽然相对成熟,但是改性结果并不理想。有学者尝试利用多种改性技术来改性蛋白,获得的大豆蛋白颗粒具备良好的热稳定性[20]。
本文以大豆球蛋白(SG)为研究对象,通过单因素及响应面试验探究加热、超声、pH 偏移联合改性制备SG 纳米颗粒的最佳条件,以及体系环境(离子强度、二次热处理、pH 值、冻融循环)对改性SG 纳米颗粒稳定性的影响,为其更好地应用于食品级Pickering 乳液生产及功能性食品开发提供技术参考。
1 材料与方法
1.1 材料与试剂
低温脱脂豆粕,山东万得福生物科技有限公司;亚硫酸氢钠(NaHSO3)、氢氧化钠、盐酸、磷酸氢二钠(Na2HPO4·12H2O)、磷酸二氢钠(NaH2PO4·H2O)、氯化钠、8-苯胺基-1-萘磺酸钠(ANS-),国药集团化学试剂有限公司;牛血清白蛋白(BSA)、考马斯亮蓝G-520,索莱宝生化试剂有限公司。
1.2 仪器与设备
摇摆式高速中药粉碎机,天津市泰斯特仪器有限公司;Starter2100 pH 计,奥豪斯仪器有限公司;DJ-1 大功率磁力搅拌器,常州荣华仪器制造有限公司;BL-500 电子天平,上海亚津电子科技有限公司;AUY120 万分之一电子天平,日本岛津公司;CR21N 高速冷冻离心机,日本Hitachi 公司;LG-0.2 真空冷冻干燥机,沈阳航天新阳速冻设备制造有限公司;DK-S26 水浴锅,上海精宏试验设备有限公司;VCX750 超声波细胞破碎仪,美国Sonics 公司;Zetasizer Nano ZS 纳米粒度电位仪,马尔文仪器有限公司;Cary50 紫外可见光分光光度计,美国Varian 公司;F-4600 荧光光谱仪,日本Hitachi 公司;SIM-F140adl 制冰机,松下电器产业株式会社;TSE SERIES 立式超低温冰箱,美国赛默飞世尔科技公司;HH 数显恒温油浴槽,金坛市正基仪器有限公司。
1.3 方法
1.3.1 SG 的提取 SG 的提取参考Takao 等[21]的方法并稍加改动。脱脂豆粕用去离子水溶解,料水比为1∶15(g/mL),将pH 值调至7.5 后充分搅拌2 h(25 ℃),于9 000×g 离心20 min,取上清液加入终质量浓度为1.04 g/L 的NaHSO3,调至pH 值至6.4,在4 ℃水化整夜。翌日,于8 000×g 离心20 min(4 ℃),沉淀用去离子水稀释溶解,调pH 7.5透析48 h(4 ℃),冻干后即得SG。经测定该SG 中蛋白质含量为96.72%(GB/T 5009.5-2016,凯氏定氮法)、脂肪含量为0.28%(GB/T 5009.6-2016,索氏抽提法)、水分含量为3.3%(GB/T 5009.3-2016,直接干燥法),总灰分为3.1%(GB/T 5009.4-2016)。
1.3.2 联合改性SG 纳米颗粒的制备
1.3.2.1 单因素实验 取适量冻干SG 粉末溶解于去离子水,充分搅拌2 h(25 ℃),于4 ℃水化18 h,调pH 值至7.0,在8 000×g 离心20 min(4 ℃),将上清液稀释为2 mg/mL,采用Bradford 法测定蛋白浓度[22]。将SG 溶液利用热处理(Heating,H)、超声处理(Ultrasound,U)和pH 偏移处理(pH,P)进行联合改性,依次确定最佳改性顺序(HUP、HPU、UHP、UPH、PHU、PUH)、加热时间、超声振幅和超声时间。加热条件:在95 ℃水浴中加热SG 溶液5,10,15,20,30 min;超声条件:在额定功率750 W,输出频率20 kHz 条件下以30%,40%,50%,60%,70%振幅处理1,3,6,9,12 min;pH 偏移 条件:将SG 溶液pH 值调至12.0,于25 ℃缓慢搅拌1 h 后,将pH 值调至7.0,维持1 h。
1.3.2.2 响应面试验 利用响应面分析法进一步优化改性条件,以表面疏水性为响应值,响应面设计因素及水平如表1 所示。

表1 响应面试验设计因素及水平Table 1 Design factors and levels of the response surface experiment
1.3.3 粒径和Zeta-电位测定 去离子水稀释SG纳米颗粒溶液至1.0 mg/mL,采用马尔文Zetasizer Nano ZS 纳米粒度电位仪测定。参数设置:散射角为173°,水系折光系数1.33,测量温度25 ℃。样品测定3 次并计算平均值。
1.3.4 表面疏水性测定 采用ANS-荧光探针法测定SG 纳米颗粒表面疏水性[23]。将SG 纳米颗粒溶解在磷酸盐缓冲液(pH 7.0)进行一定梯度的稀释(0.04~0.2 mg/mL),4 mL 样品与20 μL 8 mmol/L ANS-(pH 7.0)充分混合,避光反应2 min 后于F-4600 荧光光谱仪测定。参数设置:激发波长390 nm,发射波长470 nm,狭缝宽5 nm。以SG 浓度为横坐标,荧光强度为纵坐标绘图,样品表面疏水性由初始斜率表示。
1.3.5 外观变化观察 制得SG 纳米颗粒溶液倒入10 mL 透明螺口试剂瓶,4 ℃贮藏,并拍照观察。
1.3.6 溶解度测定 参考Samoto 等[24]的方法测定SG 溶解度。将未经处理SG 溶液稀释至固定浓度,并按照试验要求进行处理。于12 000×g 离心20 min,采用Bradford 法测定上清液中蛋白含量。以离心后上清液中的蛋白质量与样品所含蛋白总质量的比值表示SG 溶解度。计算公式如下:
1.3.7 稳定性测定 以粒径、Zeta-电位、溶解度、乳液外观为评价指标,探究离子强度(NaCl 终浓度0,0.1,0.2,0.3,0.4,0.5,0.6 mol/L,反应2 h)、热处 理(100,110,120,130,140,150 ℃,反 应20 min)、pH 值(2,4,6,8,10,反应1 h)、冻融循环(-20 ℃/-80 ℃冷冻24 h,室温放置4 h 解冻,重复5 次)对改性SG 稳定性的影响。
1.3.8 统计分析 本试验所有结果均为3 次重复试验平均值,使用SPSS 2017 进行方差和显著性分析(LSD 法);使用Origin 2018 绘图,标记字母以区分数据间的显著性;使用Design-Expert 8.0.6.1 进行响应面试验设计及结果分析。
2 结果与分析
2.1 改性顺序对SG 纳米颗粒的影响
2.1.1 粒径和Zeta-电位 加热、超声和pH 偏移联合处理可能产生协同作用,改善SG 的功能性质,也可能相互抗衡削弱改性效果,因此改性顺序对改性效果具有重要影响。颗粒粒径大小与蛋白功能性质相关,粒径越小,界面吸附效率越高,Pickering 乳液稳定越好[25-26]。如图1a 所示,样品UHP 的粒径显著大于其它样品(P〈0.05),样品HPU、PHU、PUH 的粒径较低,样品HUP 的粒径介于二者之间。Zeta-电位表征颗粒稳定性,Zeta-电位的绝对值越大,颗粒之间静电斥力越强,颗粒稳定性越好[27]。由图1b 可知,样品HUP、PHU、PUH、UPH 和UHP 的粒径绝对值较大,差异不显著(P〉0.05),而样品HPU 的Zeta-电位绝对值最低。

图1 改性顺序对SG 纳米颗粒粒径和Zeta-电位的影响Fig.1 Effect of modification order on the particle size and Zeta-potential of SG nanoparticles
2.1.2 表面疏水性 表面疏水性能反映蛋白疏水基团暴露在环境中的程度,表面疏水性越高,蛋白乳化特性越好[28]。如图2 所示,样品HUP 的表面疏水性最高为2 648.13,而样品HPU 和UHP 表面疏水性最低。

图2 改性顺序对SG 纳米颗粒表面疏水性的影响Fig.2 Effect of modification order on the surface hydrophobicity of SG nanoparticles

图3 改性顺序对SG 纳米颗粒外观变化的影响Fig.3 Effect of modification order on the appearance changes of SG nanoparticles
2.1.3 外观变化 将改性颗粒置于4 ℃观察随时间变化颗粒的稳定性,发现样品HPU 和UHP在第8 天时最先分层,样品UPH 和PHU 在第9天分层,样品PUH 在第10 天分层,而样品HUP在第11 天仍未分层稳定性最好,这与表面疏水性测定结果一致。综上,选定HUP 为最优改性顺序。
2.2 加热时间对SG 纳米颗粒的影响
2.2.1 粒径和Zeta-电位 由图4 可知,随着加热时间的延长,联合改性SG 纳米颗粒的粒径呈先增大再减小的趋势。当加热5~10 min 时,SG 粒径从130.31 nm 显著增加至161.60 nm(P〈0.05),热处理促进SG 颗粒聚集。当加热10~20 min 时,SG粒径显著降低(P〈0.05),这可能是超声处理使蛋白分子间转为以疏水相互作用力主导,因此热聚集体崩溃瓦解[17]。随着加热时间的延长(0~20 min),SG 去折叠,暴露出的活性基团依赖静电相互作用靠拢,形成可溶性聚集体。带电基团在新聚集体表面重新排列,使Zeta-电位绝对值显著增大[29]。当加热20~30 min 时,SG 分子结构更加膨胀,蛋白单位表面积所覆盖的静电荷数量减少,因此SG 的Zeta-电位绝对值显著降低(P〈0.05)。

图4 加热时间对SG 纳米颗粒粒径和Zeta-电位的影响Fig.4 Effect of heating time on the particle size and Zeta-potential of SG nanoparticles
2.2.2 表面疏水性 如图5 所示,在0~20 min 内随加热时间的延长,联合改性SG 纳米颗粒表面疏水性逐渐增强(P〈0.05),并在20 min 达到最大值。一方面加热改变SG 分子构象,使更多包裹在球蛋白内部的疏水基团暴露出来,从而增加ANS-荧光探针的结合位点[30-31],提高样品表面疏水性;另一方面,加热促进蛋白亚基和肽链的裂解[32],同样有利于增强SG 表面疏水性。当加热延长至30 min时,SG 表面疏水性显著降低(P〈0.05),这是由于当加热强度达到一定水平时,蛋白结构会获得最大程度的伸展;若此时进一步加热,更多热能的输入会加剧蛋白分子的运动和碰撞,导致原本裂解的多肽链再次形成聚集体[33],而暴露的疏水基团也被重新包埋到分子内部,从而使表面疏水性降低。

图5 加热时间对SG 纳米颗粒表面疏水性的影响Fig.5 Effect of heating time on the surface hydrophobicity of SG nanoparticles
2.2.3 外观变化 如图6 所示,第6 天时加热5 min 和10 min 的样品最先沉淀,第9 天时加热15 min 的样品沉淀;第11 天时加热30 min 的样品沉淀;加热20 min 的样品稳定时间可达12 d。综合2.2.2 节的结果可得,95 ℃加热20 min 为最优加热时间。

图6 加热时间对SG 纳米颗粒外观变化的影响Fig.6 Effect of heating time on the appearance changes of SG nanoparticles
2.3 超声振幅对联合改性SG 纳米颗粒的影响
2.3.1 粒径和Zeta-电位 采用美国Sonics 公司的VCX750 型超声波细胞破碎仪对SG 进行超声处理,该仪器的超声振幅与超声功率存在一定的正相关性。如图7 所示,随着超声振幅的增加,联合改性SG 纳米颗粒的粒径呈先减小再增大的趋势。较低振幅的超声处理(0%~40%)使SG 纳米颗粒的粒径显著降低(P〈0.05),这可能是由于超声空化作用损坏了蛋白质分子间的非共价键作用,使蛋白球状结构伸展、聚集体破碎,蛋白在溶液中的分布更加均匀[34];然而随超声振幅增强(40%~70%)SG 粒径又显著变大(P〈0.05),高功率的超声处理导致了一系列微射流效应,在改变蛋白二级结构的同时,加速溶液中微小粒子的运动和碰撞,使SG 再次形成了大的聚合体[19]。如图7 所示,SG的Zeta-电位绝对值呈先增大后减小的趋势,在40%振幅时,电位的绝对值最大为20.93 mV,这是由于超声使SG 内部的带电基团暴露出来,增大蛋白分子表面的静电斥力。当超声振幅进一步增大(≥40%),蛋白质因过度变性聚集,带电基团再度裹藏于分子内部,Zeta-电位绝对值也因此减小。
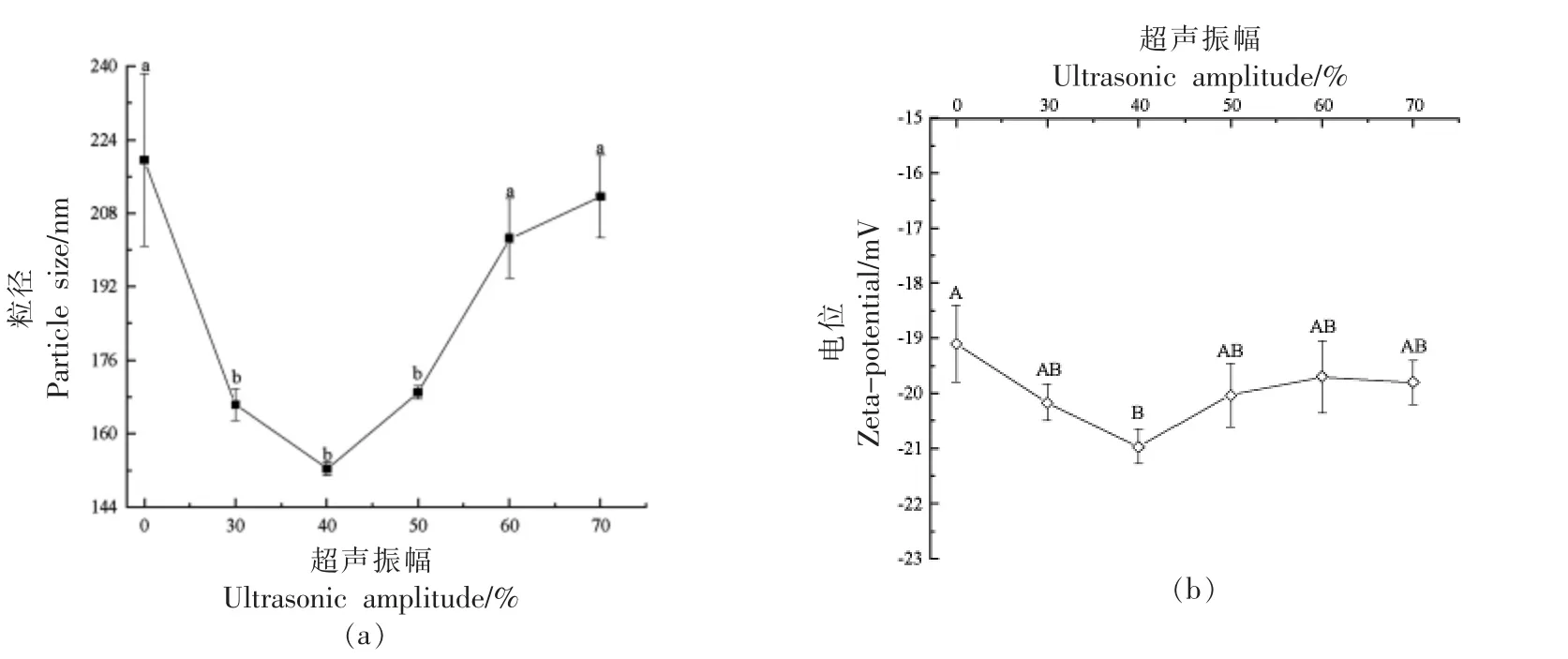
图7 超声振幅对SG 纳米颗粒粒径和Zeta-电位的影响Fig.7 Effect of ultrasonic amplitude on the particle size and Zeta-potential of SG nanoparticles
2.3.2 表面疏水性 表面疏水性关乎蛋白三级结构的稳定,同时对蛋白功能性质有着重要影响。如图8 所示,联合改性SG 纳米颗粒表面疏水性随超声振幅的增大呈先增大后减小的趋势(P〈0.05),这与Zeta-电位绝对值和粒径的测定结果相一致。这是因为未经改性的SG 将疏水基团等非极性基团包裹于蛋白分子结构的内部,超声处理使蛋白结构展开,促进疏水基团的外露[35];而高强度的超声处理会导致部分蛋白分子聚集,从而降低样品表面疏水性。这与Yan 等[36]的报道超声功率对表面疏水性的影响一致。

图8 超声振幅对SG 纳米颗粒表面疏水性的影响Fig.8 Effect of ultrasonic amplitude on the surface hydrophobicity of SG nanoparticles
2.3.3 外观变化 如图9 所示,SG 纳米颗粒经历了高强度超声处理后(60%~70%振幅)在贮藏第8天时最先开始分层;未超声处理及50%超声振幅处理样品在第9 天时分层;30%超声振幅处理样品在第12 天时分层;而40%超声振幅处理样品在第12 天时仍然稳定。综合2.3 节的结果可得,40%超声振幅处理为最优的超声振幅。

图9 超声振幅对SG 纳米颗粒外观变化的影响Fig.9 Effect of ultrasonic amplitude on the appearance changes of SG nanoparticles
2.4 超声时间对联合改性SG 纳米颗粒的影响
2.4.1 粒径和Zeta-电位 由图10 可知,超声时间对联合改性SG 纳米颗粒的影响与图7 中超声振幅对样品影响近似。0~6 min 超声处理使蛋白球状结构展开,带电基团外露,从而使SG 的粒径显著减小(P〈0.05),而Zeta-电位的绝对值增加。随着超声时间的进一步延长(6~12 min),SG 再次聚集形成可溶聚合体,SG 的粒径显著增大(P〈0.05),而Zeta-电位的绝对值减小。Hu 等[37]研究发现,长时间的超声处理仍会形成大尺寸的颗粒,可能是蛋白分子间通过疏水相互作用聚集有关。这与Zhou等[38]的研究结果一致。

图10 超声时间对SG 纳米颗粒粒径和Zeta-电位的影响Fig.10 Effect of ultrasonic time on the particle size and Zeta-potential of SG nanoparticles
2.4.2 表面疏水性 由图11 所示,0~12 min 的超声处理没有对SG 表面疏水性造成显著影响可能是短时的原因。超声处理6 min 时SG 纳米颗粒表面疏水性最大。
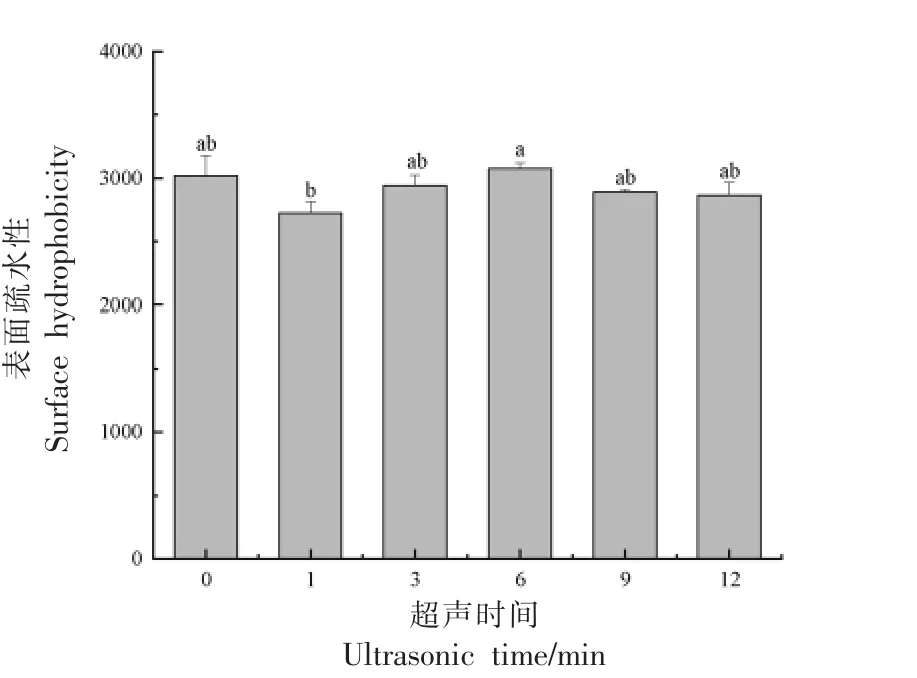
图11 超声时间对SG 纳米颗粒表面疏水性的影响Fig.11 Effect of ultrasonic time on the surface hydrophobicity of SG nanoparticles
2.4.3 外观变化 从图12 可知,未经超声处理样品和超声处理9 min 样品在贮藏第8 天时最先沉淀;超声处理12 min 样品第9 天沉淀;超声处理1 min 样品第10 天沉淀;超声处理3 min 样品第12天沉淀;而超声处理6 min 样品第12 天时仍然未出现分层。综合2.4 节的结果可知,超声处理6 min 为最优的超声时间。

图12 超声时间对SG 纳米颗粒外观变化的影响Fig.12 Effect of ultrasonic time on the appearance changes of SG nanoparticles
2.5 响应面结果分析
2.5.1 响应面设计及结果 在最优改性顺序(HUP)下,通过响应面试验,探究加热时间(A),超声振幅(B),超声时间(C)对表面疏水性的影响,优化SG纳米颗粒联合改性的条件。响应面因素及水平见表1,响应面试验设计及响应值见表2。
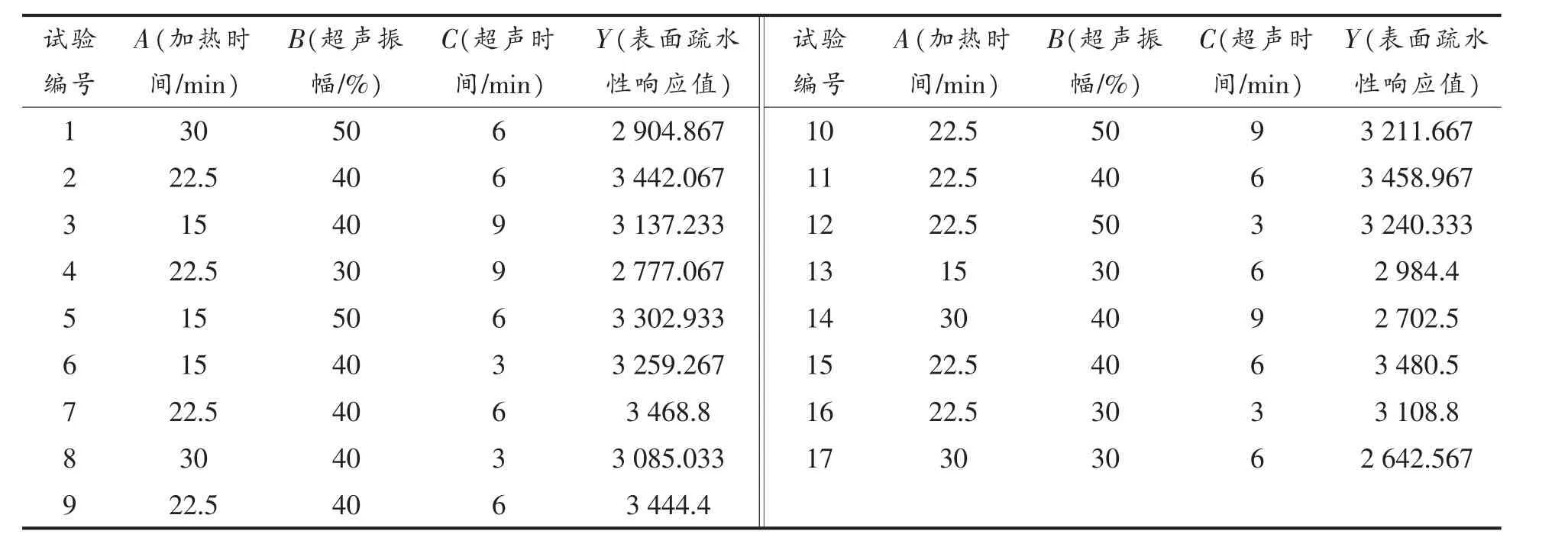
表2 响应面试验设计及表面疏水性的响应值Table 2 Design of response surface experiments and response values of surface hydrophobicity
对试验结果进行多元回归拟合,得到回归方程:Y=3458.95-168.61A+143.37B-108.12C-14.06AB-65.12AC+75.77BC-269.36A2-230.90B2-143.58C2。表面疏水性回归模型方差分析结果见表3。

表3 表面疏水性回归模型方差分析结果Table 3 Analysis of variance results of surface hydrophobicity regression model
由表3 可知,该模型极为显著(P〈0.01),失拟项不显著(P〉0.05)。该模型的变异系数(C.V.%)为0.91%(小于10%);信噪比为36.073(大于4);R2为0.9952,Adj-R2为0.989(均大于0.8 且接近于1)。综上,该试验精确性较高,模型拟合情况较好,是理想的拟合模型,预测联合改性SG 纳米颗粒表面疏水性的实际变化情况真实可靠。一次项加热时间(A)、超声振幅(B)、超声时间(C)和二次项A2、B2、C2均极显著(P〈0.01),交互项中AC 和BC极显著(P〈0.01)。由F 值可知,各因素对联合改性SG 纳米颗粒表面疏水性的影响大小为:加热时间〉超声振幅〉超声时间。
2.5.2 响应面分析 由图13 可直观地看到各因素对表面疏水性的影响。由响应面趋势可知,AC和BC 因素间交互作用对表面疏水性影响显著;由等高线可知最佳表面疏水性对应的三因素水平范围,分析结果与试验结果一致。在此改性条件下,经3 次以上试验测定表面疏水性平均值为3 548.77,相对误差较小,说明模型准确性高,是预测联合改性SG 纳米颗粒表面疏水性的可靠模型。由响应面分析法得到的优选加热-超声-pH 偏移联合改性条件为Step1:95 ℃加热20 min 19 s。Step2:在43%振幅下超声5 min 17 s(750 W,20 kHz)。Step3:pH 12 条件下处理1 h,联合改性SG纳米颗粒表面疏水性为3 516.16。
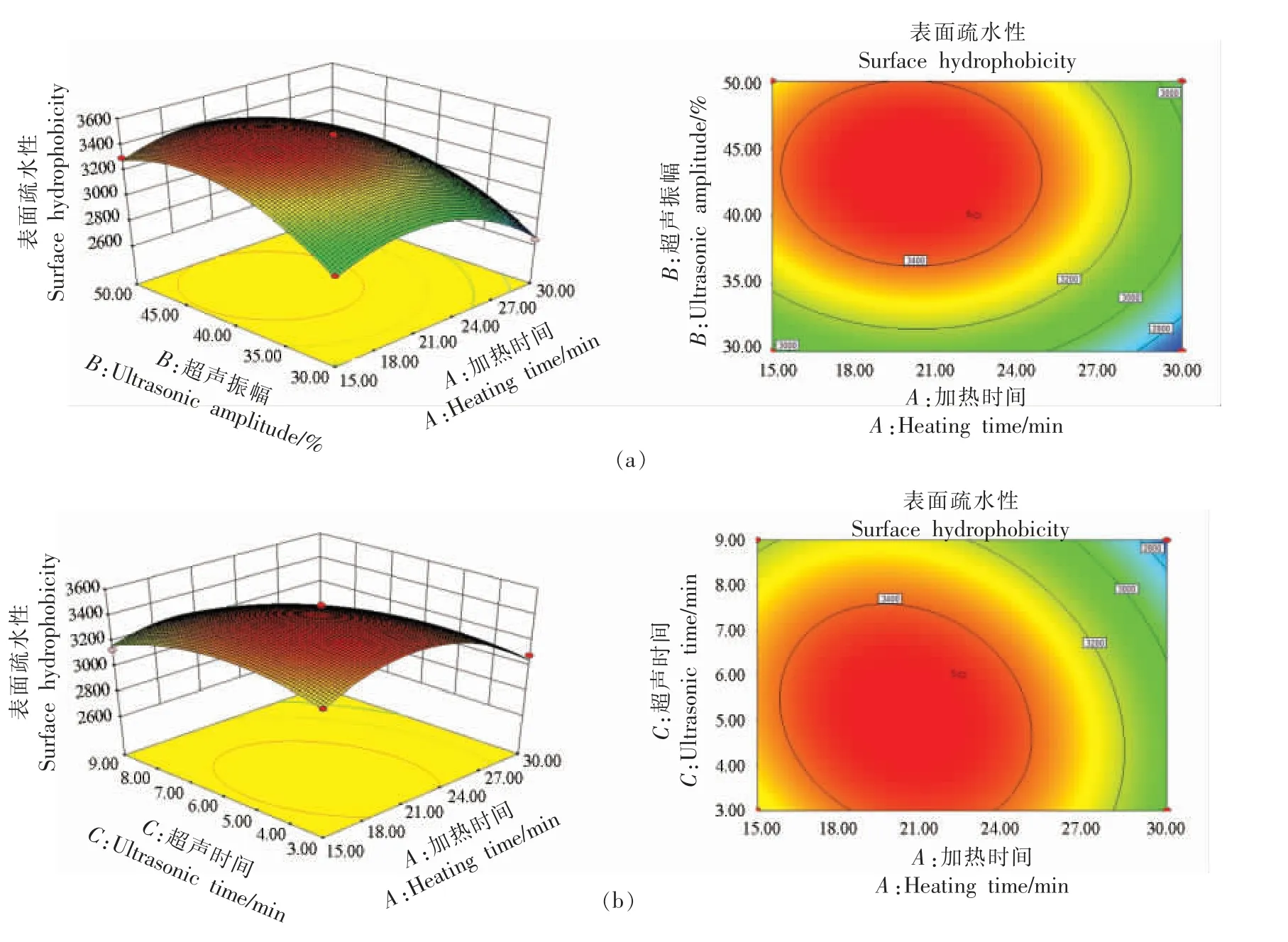
图13 三因素间两两交互的响应面及等高线图Fig.13 The response surface and contour plot of the interaction among various factors
2.6 联合改性SG 纳米颗粒稳定性的研究
2.6.1 离子强度对联合改性SG 纳米颗粒的影响
2.6.1.1 粒径和Zeta-电位 如图14 所示,随着盐浓度增加,SG 纳米颗粒的粒径显著增大(P〈0.05)。这可能是因为溶液中的盐离子屏蔽SG 纳米颗粒表面电荷,减小颗粒间的静电斥力;或是盐离子与蛋白分子竞争结合水的机会,导致蛋白间碰撞机率增大,形成蛋白聚集体。这与Fan 等[39]的研究结果一致。相较未加盐离子的样品,加盐离子后SG纳米颗粒Zeta-电位绝对值显著降低(P〈0.05);随着盐浓度增加(0.1~0.6 mol/L),Zeta-电位绝对值呈越来越小的趋势。这可能是由于Na+引入增加了SG 纳米颗粒表面的阳离子,使其表层的扩散双电层受到挤压,使得Zeta-电位绝对值降低。
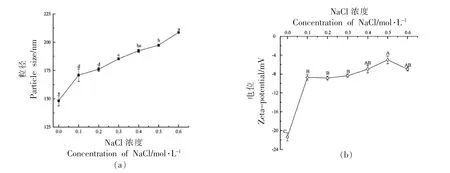
图14 离子强度对联合改性SG 纳米颗粒粒径和Zeta-电位的影响Fig.14 Effect of ionic strength on the particle size and Zeta-potential of co-modified SG nanoparticles
2.6.1.2 溶解度 如图15 所示,盐离子浓度增加显著降低了SG 纳米颗粒的溶解度(P〈0.05),这可能是因为天然SG 是通过疏水相互作用维持的低聚球蛋白,盐离子浓度增加使得单个蛋白质分子内疏水相互作用增强而聚集,产生“盐析效应”,因此溶解度降低[40]。
2.6.1.3 外观变化 如图16 所示,未添加盐离子的SG 纳米颗粒溶液在贮藏第12 天时仍稳定;SG溶液在添加0.1 mol/L 盐离子后,于第7 天开始沉淀;添加0.2~0.4 mol/L 盐离子后,于第8 天沉淀;添加0.5 mol/L 盐离子后,于第12 天沉淀;添加0.6 mol/L 盐离子的SG 溶液与未添加盐离子时,稳定程度相当。由此可知,添加适量的盐离子(≤0.6 mol/L)使联合改性SG 纳米颗粒维持稳定至少6 d,满足肉制品、烘焙食品等基本生产需求。

图16 离子强度对联合改性SG 纳米颗粒外观变化的影响Fig.16 Effect of ionic strength on the appearance changes of co-modified SG nanoparticles
2.6.2 加热对联合改性SG 纳米颗粒的影响
2.6.2.1 粒径和Zeta-电位 为了拓宽联合改性SG 纳米颗粒的应用领域,分别模拟蒸煮(100~110℃)、油炸(120~150 ℃)温度进行20 min 加热处理,探究其能否适应生产加工中的高温条件。图17 可知,联合改性SG 纳米颗粒粒径随加热温度的升高而增大(P〈0.05),这表明加热温度越高使溶液中越多蛋白聚集体形成。而高温加热后SG 纳米颗粒的Zeta-电位绝对值小于低温加热后(100℃)的样品,这也是蛋白相互聚集,外露活性基团减少的表现。

图17 加热对联合改性SG 纳米颗粒粒径和Zeta-电位的影响Fig.17 Effect of heating on the particle size and Zeta-potential of co-modified SG nanoparticles
2.6.2.2 溶解度 加热使蛋白质形成可溶性、不可溶的聚合体,影响蛋白溶解度。如图18 所示,改性后SG 纳米颗粒溶解度随加热温度升高而增大(100~130 ℃),这或许是因为此时蛋白分子间的交联和折叠成为主导,疏水性基团包埋于结构内部,形成一些可溶性聚集体,从而提高样品溶解度。而随加热强度提高(130~150 ℃)改性SG 纳米颗粒溶解度降低,可能是由于此时蛋白分子运动剧烈,形成某些不溶性聚集体。
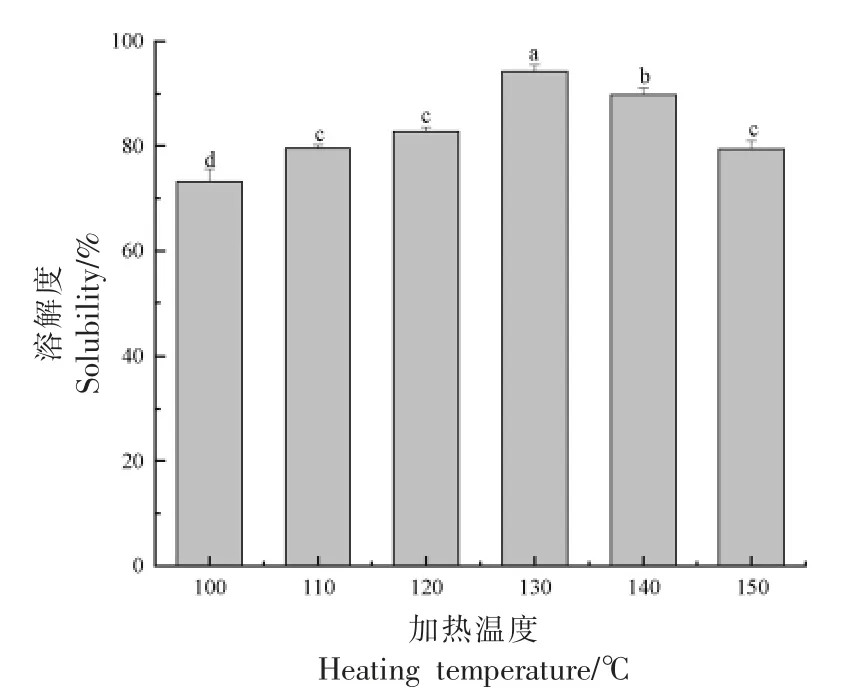
图18 加热对联合改性SG 纳米颗粒溶解度的影响Fig.18 Effect of heating on the solubility of co-modified SG nanoparticles
2.6.2.3 外观变化 图19 可知,改性SG 纳米颗粒溶液经历100 ℃二次加热后,于贮藏第4 天轻微分层;经110~120 ℃后于第5 天沉淀;经历130~150 ℃后于第6 天沉淀。综上,即使经历蒸煮或油炸处理联合改性SG 纳米颗粒仍能维持3~5 d 稳定,基本满足实际生产需求。
2.6.3 pH 值对联合改性SG 纳米颗粒的影响
2.6.3.1 粒径和Zeta-电位 如图20 所示,联合改性SG 纳米颗粒在强酸性环境(pH 2,4)中带正电荷,弱酸及强碱性环境(pH 6,8,10)中带负电荷。当pH 值分别为4 和6 时,改性SG 纳米颗粒的粒径显著大于其它pH 条件下的样品,Zeta-电位绝对值显著低于其它pH 条件下的样品(P〈0.05)。这可能是由于联合改性使得球状SG 的天然结构瓦解、暴露出内部的酸性亚基,pH 4 较接近SG 酸性亚基等电点pH 4.8~5.4,而pH 6 接近于大豆球蛋白等电点pH 6.4,蛋白表面静电荷减少,液滴间静电斥力不足导致。
2.6.3.2 溶解度 图21 可知,pH 值(pH 4,6)接近大豆球蛋白等电点时,联合改性SG 纳米颗粒在水中溶解度显著降低(P〈0.05),在20%以下。pH值远离大豆球蛋白等电点时(如pH 2,8,10)联合改性SG 溶解度均在70%以上。pH 值为10 时,联合改性SG 纳米颗粒溶解度最高为91.05%,说明联合改性SG 在强酸/碱的环境中能保持良好溶解度。
2.6.3.3 外观变化 由图22 可知,当pH 值为4和6 时较接近大豆球蛋白等电点时,由于液滴间静电斥力的减少,在贮藏第1 天时产生肉眼可见的聚集沉降;当pH 值为8 在贮藏第4 天时沉降;当pH 值为10 在第6 天沉降;当pH 值为2 在第20 天沉降。由此可见,联合改性SG 纳米颗粒在极端酸性或碱性的条件下都能保持良好的稳定性(≥3 d)。

图22 pH 对联合改性SG 纳米颗粒外观变化的影响Fig.22 Effect of pH on the appearance changes of co-modified SG nanoparticles
2.6.4 冻融循环对联合改性SG 纳米颗粒的影响
2.6.4.1 粒径和Zeta-电位 联合改性SG 纳米颗粒的粒径在冻融后显著增大(P〈0.05),且随冻融次数的增多粒径越大(图23a),可见冷冻对蛋白结构造成不可逆的伤害。相较-20 ℃冻融处理,-80℃冻融处理后的颗粒粒径更小,Zeta-电位绝对值更大。这是由于-80 ℃条件下水滴转化成冰晶的速率更快,且大体积冰晶生成更少,对蛋白结构的伤害更小。冻融循环后样品的Zeta-电位绝对值整体呈逐渐上升的趋势(图23b),这或许是因为冻融虽然导致部分蛋白的聚集,但在上清中的蛋白颗粒却暴露出更多的带电基团。
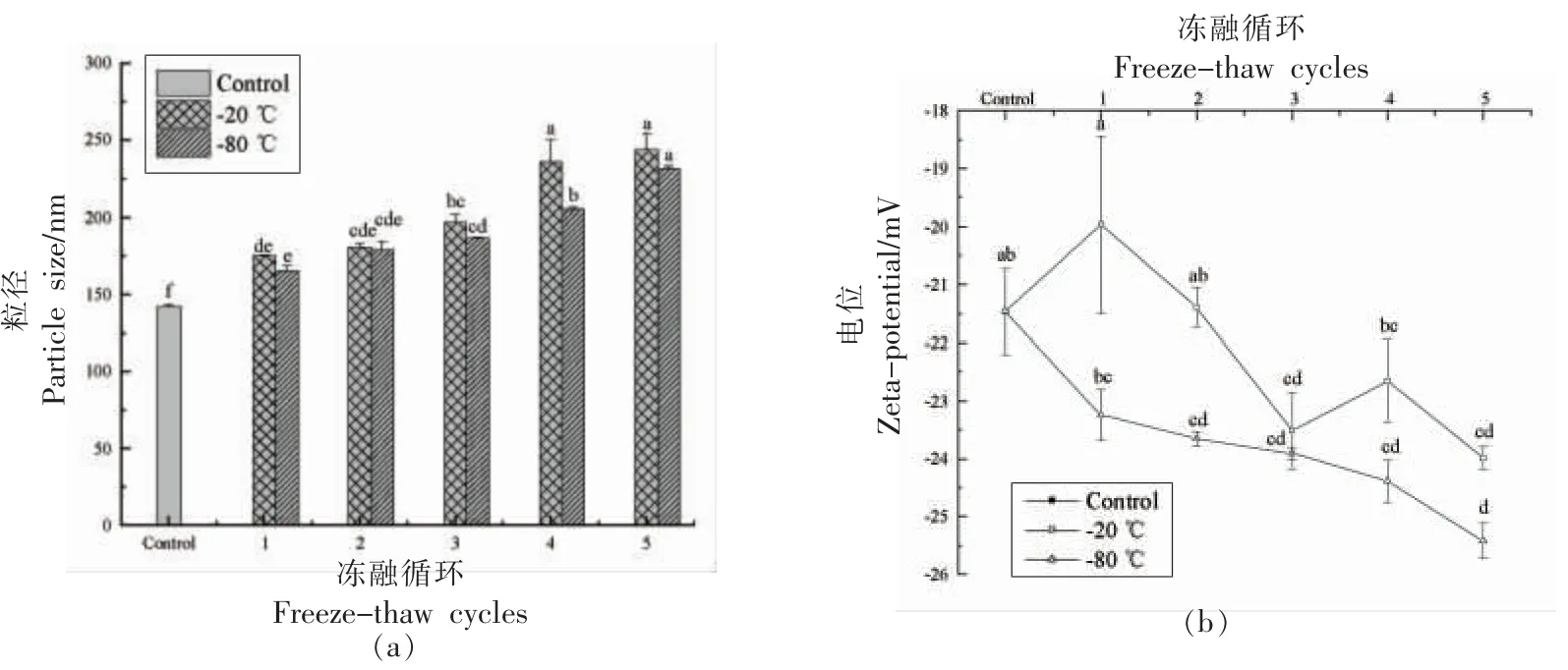
图23 冻融循环对联合改性SG 纳米颗粒粒径和Zeta-电位的影响Fig.23 Effect of freeze-thaw cycles on the particle size and Zeta-potential of co-modified SG nanoparticles
2.6.4.2 溶解度 如图24 所示,联合改性SG 纳米颗粒的溶解度随冻融次数的增加而显著降低(P〈0.05)。在相同次数的冻融循环后,经-80 ℃冻融处理样品溶解度显著高于-20 ℃冻融处理的样品(P〈0.05)。这表明相较-20 ℃冷冻环境,-80 ℃速冻环境对SG 纳米颗粒造成的伤害更小。
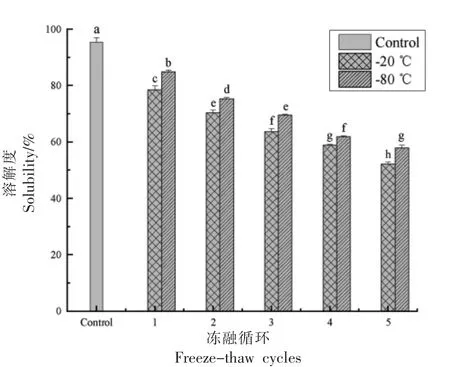
图24 冻融循环对联合改性SG 纳米颗粒溶解度的影响Fig.24 Effect of optimal freeze-thaw cycles on the solubility of co-modified SG nanoparticles
2.6.4.3 外观变化 如图25 所示,在-20 ℃冷冻下,联合改性SG 溶液经历1 次冻融循环出现少量沉淀,且随冻融循环次数增多,沉淀逐渐增多;而在-80 ℃速冻下,联合改性SG 溶液经过2 次冻融循环,只产生极少量沉淀。结合粒径、Zeta-电位、溶解度和贮藏时间综合分析可知,-80 ℃更利于改性SG 纳米颗粒的贮藏。

图25 冻融循环对联合改性SG 纳米颗粒外观变化的影响Fig.25 Effect of freeze-thaw cycles on the appearance changes of co-modified SG nanoparticles
3 结论
以大豆球蛋白(SG)为研究对象,通过单因素实验和响应面试验确定了加热、超声、pH 偏移联合改性的最佳条件:95 ℃加热20 min 19 s;43%振幅超声处理5 min 17 s;pH 12 处理1 h。联合改性有利于减小SG 纳米颗粒的粒径,改善表面疏水性和Zeta-电位,延长贮藏时间。而且,联合改性SG纳米颗粒对高浓度盐离子、高温、极酸极碱环境以及快速冷冻-融化循环具有较好的稳定性。本研究所研制的联合改性SG 纳米颗粒有望成为食品级Pickering 乳液的良好稳定剂,为Pickering 乳液在功能性食品中应用提供技术支持。

