禁牧对内蒙古克氏针茅草原表层土壤细菌群落结构的影响
张晓馥, 白 雪, 张起迪, 李淑芬, 韩 冰,2,3, 赵鸿彬,2,3*
(1. 内蒙古农业大学生命科学学院, 内蒙古 呼和浩特 010010; 2. 麦类种质创新利用自治区高等学校重点实验室, 内蒙古 呼和浩特 010010; 3. 内蒙古自治区生物制造重点实验室, 内蒙古 呼和浩特 010010)
中国草原面积占国土面积的40.9%,其中,内蒙古草原是欧亚草原和中国天然草原的重要组成部分[1]。草原土壤中存在着种类丰富的微生物群落,是草原生态系统不可或缺的部分,通过其自身代谢活动参与调节土壤碳、氮和磷等元素的地球化学循环和有机物降解过程[2]。微生物作为单细胞生物,对环境的细微变化高度敏感,其中气象条件、土壤理化性质和植被特征均可影响土壤微生物的活性、群落构成和代谢活动[3]。土壤微生物中细菌数量最多、分布最广[4],直接参与有机物的分解等过程,促进土壤养分的循环和转化,进而维持草原生态系统的稳定和健康。因此,细菌多样性可以作为评价土壤质量和生态系统服务价值的重要指标[5-6]。
在草原生态系统中,气候变化和过度放牧可导致土壤微生物丰度和多样性变化,影响土壤养分的循环和转化[7-8]。围封禁牧可促进草原植被恢复和生物多样性的提高,从而增加草原生产能力和稳定性[9-10],是草地生态管理调控的重要手段之一[11]。长期禁牧可改变土壤细菌的组成,显著增加植被地上生物量、凋落物量、土壤养分,降低植被多样性[12];而短期禁牧能够改变细菌共生模式、改善草原土壤肥力、植物丰度和多样性[13-14],对土壤细菌多样性表现出一定的负面影响[15]。此外,在草原生态系统中,表层土壤是土壤中营养最丰富的一层,植物根系、凋落物及分泌物较多,有着很密集的微生物共存网络,而且微生物多样性、土壤酶活性和养分水平高于深层土壤[16-18]。长期禁牧对表层土壤细菌丰度、多样性、土壤微生物量有着积极的影响。细菌群落的演替率在表层土壤最高[19],但短期禁牧对表层土壤微生物的影响研究较少,研究禁牧对微生物的影响,可以为草地资源的合理利用提供有用信息。
目前,现有研究主要集中在长期禁牧条件下微生物群落结构变化,而短期禁牧对微生物群落结构变化的影响的研究较少。但是,研究短期禁牧对微生物群落结构的影响有助于了解禁牧对草原生态系统的影响,为管理和保护草原提供理论依据。本研究以内蒙古克氏针茅草原为研究对象,旨在研究草原自然放牧草地转变为禁牧草地初期表层细菌群落的变化,为继续深入研究禁牧后表层土壤细菌群落变化提供理论依据。
1 材料方法
1.1 试验区域概况及样品采集
试验样地位于锡林郭勒正镶白旗的克氏针茅草原,属典型草原,地理位置42°9′14″N,115°14′39″E,海拔高度1 343 m,年均气温1.9℃,多年平均降水量310 mm,属中温带半干旱大陆性气候。土壤类型偏淡栗钙土,优势物种主要为克氏针茅(StipakryloviiRosh)、羊草(Leymuschinensis(Trin.)Tzvel.)、冷蒿(ArtemisiafrigidaWilld.)等[20]。
本试验于2018年在自然放牧草地上分别设置放牧和禁牧2个30 m × 30 m试验样地,在放牧样地内按照每年2.72 羊单位·公顷-1的放牧强度进行放牧,时长5个月(6—10月),禁牧样地利用围栏禁牧,两个样地内部分别设置了3个大小为6 m×6 m的样区,样区之间间隔12 m。试验期间(2018—2020年),每年采集5次土壤样品(6—10月的月初)。采样时,使用直径为8 cm的土钻在每个样区采集3个("S"字形)深度为0~10 cm的土壤样品。采集的土壤样品去除石块、动植物残体等杂质,使用2 mm筛子进行过滤处理。每份土样分为2份,一份置于5 ml无菌冻存管中,放入液氮中进行速冻,并于-80℃保存,用于后续微生物群落总DNA的抽提;另份土壤样本保存于-20℃,用于后续土壤的理化性质的测定。本文仅针对禁牧区分析放牧向禁牧转变初期细菌的变化。
1.2 土壤理化性质的测定
测试前将储存于-20℃的土壤样品取出,并置于通风处风干,再过直径1 mm的筛子。使用ST300 型pH计(美国OHAUS)按土水比1∶2.5测定土壤pH值;使用重铬酸钾外加热滴定法测定有机质含量(Soil organic matter,SOM/g·kg-1)。土壤温度(Soil temperature,ST/℃)、土壤体积含水量(Volumetric water content,VWC)由试验区内设立的CR1000X数据采集器和CS655(Campbell Scientific Inc.,Logo,UT,USA)传感器每日零点监测和记录数据。
1.3 DNA提取、扩增与测序
每个土壤样本中取0.5 g,用MagPure Soil DNA LQ Kit (Magan) 试剂盒进行微生物群落总DNA抽提,后用NanoDrop 2000 (Thermo Fisher Scientific,USA)和琼脂糖凝胶电泳检测DNA的浓度和纯度;使用343F(5′-TACGGRAGGCAGCAG-3′)、798R(5′-AGGGTATCTAATCCT-3′)对细菌V3-V4区进行PCR扩增,扩增程序如下:95℃预变性 3 min,30 个循环(95℃-60 s,55℃-60 s,72℃-60 s),然后 72℃延伸 10 min,在4℃进行保存。PCR反应体系为:基因组DNA 40-60 ng,上下游引物(10 μM) 1.5 μL,PCR buffer 15 μL,dNTP(10 mmol·L-1) 1 μL,Q5高保真DNA聚合酶 0.2 μL,High GC Enhancer 10 μL,ddH2O补足至50 μL,每个样本3个重复。
将同一样本的PCR产物混合后使用2%琼脂糖凝胶回收PCR产物,进行回收产物纯化,2%琼脂糖凝胶电泳检测,并用超微量核酸定量仪对回收产物进行检测定量。通过Illumina MiSeq 2500 平台(Illumina Int.,San Diego,CA,USA)测序生成原始双端序列,对序列进行质控、拼接、剔除嵌合体、根据97%的相似度进行OTU(Operational taxonomic units),即操作分类单元聚类,并比对Silva数据库,对每条序列进行物种分类注释。
1.4 数据分析
在本试验中OTU数代表细菌丰度,Shannon指数代表细菌多样性。试验测定的土壤理化性质和细菌α多样性用SPSS 26.0进行单因素方差分析,差异显著性为95%的置信区间,探讨放牧向禁牧转变初期对土壤理化性质及细菌群落影响及其显著性,其中Chao1、Observed_species、Shannon、Simpson指数作为细菌α多样性的指标;通过R包vegan分析绘制β多样性的PCoA图,观察组间细菌群落组成的差异,采用adonis检验分析不同组间β多样性差异的显著性,采用Galaxy软件的LEfSe组件分析发现不同组间具有统计学差异的物种;使用R包corrplot进行细菌群落属性与土壤因子相关分析。
2 结果与分析
2.1 土壤理化性质和细菌α多样性时间变化分析
随着禁牧时间增长,土壤pH值下降,2020年pH值最低(P<0.05,图1a)。SOM先增加后降低,2019年SOM最高,在2018—2020年间无显著差异(图1b)。VWC在2018—2020年先下降后上升,其中2019年VWC最小,且显著低于2018和2020年(P<0.05),而2018年与2020年间VWC无显著差异(图1c)。ST先增加后降低,在2018—2020年间无显著差异(图1d)。

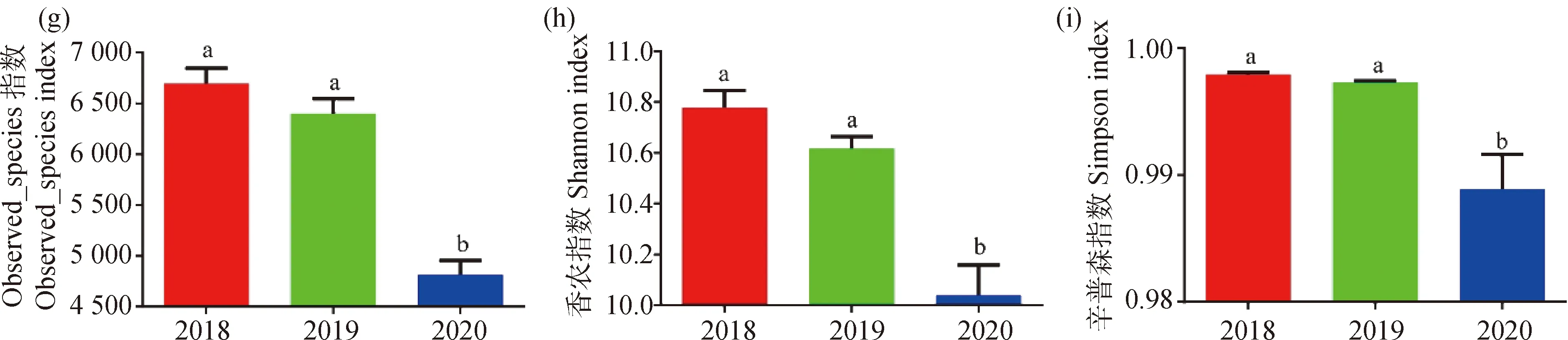
图1 土壤理化和细菌α多样性差异Fig.1 Differences in soil physicochemical and bacterial alpha diversity注:a,pH;b,SOM,土壤有机质,g·kg-1;c,VWC,土壤体积含水量;d,ST,土壤温度,℃;e,分类单元;f,Chao1指数;g,Observed_species指数;h,香浓指数;i,辛普森指数;2018,自然放牧;2019,禁牧1年;2020,禁牧2年。数据间的差异显著水平为P<0.05,下同Note:a,pH;b,SOM,Soil Organic Matter,g·kg-1;c,VWC,Volumetric Water Content;d,ST,Soil Temperature,℃;e,OTU;f,Chao1 index;g. Observed_species index;h,Shannon index;i,Simpson index;2018,Natural Grazing;2019,1 year of grazing prohibition;2020,2 year of grazing prohibition. The significant level of difference between the data is P<0.05,the same as below
细菌OTU数呈单峰趋势,2019年数值最高,在2018—2020年间有显著差异(P<0.05,图1e)。多样性指数(Chao1,Observed_species,Shannon,Simpson)均出现下降趋势(图1f,g,h,i),而且2020年多样性指数与2018年和2019年的多样性指数有显著差异(P<0.05)。
2.2 土壤细菌群落变化及差异分析
2.2.1土壤细菌群落结构变化 对放牧向禁牧转变初期表层土壤细菌物种组成变化进行分析发现,在门水平上,表层土壤细菌群落以放线菌门(Actinobacteria,31.56%~60.81%)、变形菌门(Proteobacteria,20.90%~35.81%)、拟杆菌门(Bacteroidetes,2.43%~14.27%)、酸杆菌门(Acidobacteria,2.30%~11.98%)为主(74.90%~92.86%)。2019年,放线菌门的丰度最大,与2018年相比升高53.60%,在2020年,变形菌门丰度超过放线菌门丰度;变形菌门、拟杆菌门的丰度随着禁牧时间的延长而增加,在2019年分别增加26.08%,38.27%,在2020年分别增加71.33%,487.24%;酸杆菌门在2018年相对丰度最高,2019年、2020年相对丰度分别减少80.55%,80.80%(图2a)。

图2 细菌群落组成Fig.2 Bacterial community composition注:a,门水平下细菌群落组成的变化;b,属水平下细菌群落组成的变化。2018,自然放牧;2019,禁牧1年;2020,禁牧2年Note:a,Changes in bacterial community composition at the phylum level;b,Changes in bacterial community composition at the genus level. 2018:Natural grazing;2019,1 year of grazing prohibition;2020,2 year of grazing prohibition
在属水平上,表层土壤细菌群落以鞘脂单胞菌属(Sphingomonas1.65%~6.48%)、Gaiella(2.23%~2.97%)、红色杆菌属(Rubrobacter1.80%~3.16%)、土壤红杆菌属(Solirubrobacter0.80%~3.13%)为优势菌属,鞘脂单胞菌属的丰度随着禁牧时间的延长,在2019年和2020年,其丰度分别增加了55.15%和292.12%;相比于2018年,Gaiella和土壤红杆菌属的丰度在2019年呈增加趋势,分别增加了22.73%和151.20%,在2020年出现了下降情况均小,Gaiella的丰度下降了7.85%,土壤红杆菌属的丰度下降了36.00%;红色杆菌属的丰度在2019年中增加了74.59%,在2020年出现了下降趋势,其相对丰度较2018年有所增加,但增幅为0.56%(图2b)。
2.2.2表层土壤细菌群落β多样性 采用Bray-Curtis方法,进行主坐标分析(PCoA),第一坐标轴(PC1)和第二坐标轴(PC2)可以解释细菌组成的53.75%的组间差异,其中,PC1和PC2分别解释了34.56%和19.19%的差异,2018年和2019年之间的差异小于2018年和2020年之间的差异。采用adonis分析确定了自然放牧向禁牧转变初期表层土壤细菌群落组成有显著差异(R2=0.47,P=0.001)(图3)。
2.2.3表层土壤细菌群落结构差异分析 通过对表层土壤细菌丰度差异进行LEfSe分析发现,在LDA Score >4.0,P<0.05水平下,从2018年至2020年中相对丰度存在显著差异的细菌共有46种。2018年酸杆菌门(Acidobacteria)、绿弯菌门(Chloroflexi)、疣微菌门(Verrucomicrobia)等15种细菌与2019年和2020年存在显著差异;禁牧后,在2019年,与2018年和2020年相比,放线菌门(Actinobacteria)等13种细菌的相对丰度存在显著差异;在2020年,与2018年和2019年相比,变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)等18种细菌的相对丰度存在显著差异(图4)。

图4 细菌群落组成差异Fig.4 Differences in bacterial community composition注:2018,自然放牧;2019,禁牧1年;2020,禁牧2年Note:2018,Natural grazing;2019,1 year of grazing prohibition;2020,2 year of grazing prohibition
2.3 表层土壤细菌群落属性-土壤理化关系分析
采用Pearson相关分析方法,探究土壤理化性质与土壤细菌群落之间的相关关系,发现在2018年自然放牧环境下,BO分别与VWC和ST存在显著的负相关和正相关关系(P<0.01),BS与VWC显著负相关(P<0.05)(图5a);禁牧后(2019—2020年)影响BO的主要因素发生了显著变化,BS的相关因素也发生了一定的变化,BO与pH、SOM、ST显著正相关(P<0.05),与VWC显著负相关(P<0.05),BO与pH的相关性显著增强;BS与SOM、VWC显著相关(P<0.05),其中,BS与VWC的相关性增强(图5b)。

图5 放牧向禁牧转变初期的细菌群落属性-土壤理化相关性分析Fig.5 Analysis of bacterial community properties-soil physicochemical correlation in the early stage of grazing to grazing prohibition注:a,基于Pearson算法,自然放牧环境中(2018年)微生物与土壤因子的相关关系;b,基于Pearson算法,禁牧环境中(2019—2020年)微生物与土壤因子的相关关系。BO,细菌OTU,表示细菌丰度;BS,细菌Shannon指数,表示细菌多样性。图中蓝色表示显著正相关,红色表示显著负相关,颜色越深相关性越大,数字为相关性系数;空白表示P>0.05,无显著相关关系;“*”,P<0.05;“**”,P<0.01;“***”,P<0.001Note:a,The correlation between microorganisms and soil factors in a natural grazing environment(2018) based on the Pearson algorithm. b,The correlation between microorganisms and soil factors in a restricted grazing environment(2019-2020) based on the Pearson algorithm. BO,Bacterial OTU,indicating bacterial abundance;BS,Bacterial Shannon index,indicating bacterial diversity. Blue color in the graph indicates significant positive correlation,red color indicates significant negative correlation,the darker the color the greater the correlation,the number is the correlation coefficient;blank indicates P>0.05,no significant correlation. “*”,P<0.05;“**”,P<0.01;“***”,P<0.001
3 讨论
禁牧对过度放牧草地土壤微生物群落的恢复可产生积极的影响[21],本研究结果显示放牧向禁牧转变初期,表层土壤细菌中优势菌组成没有显著改变,仍以放线菌门和变形菌门为主,但细菌的相对丰度产生变化,放线菌门相对丰度先增加后减少,而变形菌门相对丰度逐年增加。这可能是因为在放牧向禁牧的转变过程中,土壤中微生物可利用的营养逐渐增加,导致微生物群落从寡养类群转变为共养类群。放线菌门属于寡养类群,通常更适应养分低的环境,并能耐受干旱[19],而变形菌门属于共养类群,其丰度与碳水化合物和氨基酸代谢之间存在正相关关系,通常更适应于养分高的环境[22]。因为禁牧会使某些特定的微生物生境受到限制,进而导致某些微生物物种数量减少,并降低了细菌的α多样性[14],这与本研究中禁牧后细菌α多样性下降结果一致。但在朱怡等[23]的研究中,禁牧条件下细菌α多样性高于放牧条件,由于其研究区域在江苏大丰麋鹿保护区,地区、天气等因素对细菌α多样性也会产生一定的影响,因此,其中的机制需进一步探究。
土壤pH是影响细菌群落组成变化的一个重要因素[24]。在自然放牧条件下,牛羊排泄物可能会使土壤pH升高成碱性[25]。在本研究结果中,禁牧初期由于缺乏牛羊排泄物(粪便和尿液)的输入,土壤pH呈下降趋势。同时,在本样地的其他研究数据表明,2018年降雨量为309 mm,2019年降雨量198.3 mm,2020年降雨量164.6 mm[26]。禁牧1年没有牲畜啃食,植被有所恢复,并且这一年度降雨量减少,地下、地上生物量的增加同时消耗大量水分,所以导致VWC在2019年呈下降趋势。禁牧2年植物根系更旺盛、完整,吸水能力增强,所以在禁牧2年,土壤水分有所回升[27]。由于土壤水分的变化,BO与VWC的显著负相关关系减弱,BS与VWC的显著负相关关系增强,对土壤微生物群落结构产生了直接的影响,并且不同的细菌对水分的响应不同,一般来说革兰氏阳性菌比革兰氏阴性菌耐旱性更强;其中,绿弯菌门、疣微菌门对水分变化敏感,短暂的干旱胁迫会导致其丰度降低,即便再复水也无法恢复到先前水平[28]。在本研究中,BS、BO与SOM均存在显著正相关关系,BO与ST存在显著正相关关系,这可能是因为禁牧条件下植物多样性、丰富度和总盖度增高,从一定程度上增加了土壤覆盖率、抵御了太阳辐射,使土壤温度降低[29]。温度可通过影响土壤酶活性、土壤养分分解,进一步影响微生物群落尤其是细菌群落[30]。温度对细菌丰度有显著的影响,如厚壁菌门相对丰度随着土壤温度的升高而降低[31]。土壤有机质积累的主要驱动因素包括微生物残体,微生物群落的组成和丰度也会受到有机物分解程度的影响,土壤碳与微生物群落多样性有显著相关关系,对草原生态系统的健康有重要的意义[32-33]。
4 结论
在放牧向禁牧转变的初期,内蒙古克氏针茅草原的土壤pH呈下降趋势,有机质、温度先增加后降低,体积含水量先降低后增加。细菌群落优势菌种未发生改变,为放线菌门和变形菌门,优势菌种的相对丰度发生变化,放线菌门相对丰度先升高后降低,变形菌门相对丰度呈上升趋势,细菌α多样性下降。放牧向禁牧转变初期,细菌群落结构组成存在显著的差异,细菌丰度易受外部环境的影响。本研究的结果为草地管理模式改变初期对表层土壤细菌的影响提供了有用的数据信息和新的见解。

