羊粪中纤维素降解菌的筛选、鉴定及评价
周 泽, 付卫刚, 雷 杨, 李青璞, 姚 拓
(甘肃农业大学草业学院/草业生态系统教育部重点实验室, 甘肃 兰州 730070)
随着市场经济的蓬勃发展,畜牧业得到了发展,规模化、集中化、产业化的养殖水平不断提高。畜禽养殖量不断增加,甘肃省作为全国第三养羊大省,2019年末羊存栏量达到1 987.1万只[1]。根据羊粪便排污指数估算[2],全国羊粪便产量达到了9 548.53万吨,仅甘肃省占据其中的6.6%。全国近40%的畜禽粪便未得到无害化处理或资源化利用[3]。如果羊粪不加处理随意堆放,会造成空气、水体、土壤的污染[4],且造成羊粪内的致病菌在空气中传播。大量未加处理的养殖废弃物成为危害环境,破坏生态的源头,废弃物无害化处理成为当前农业面源污染治理的一大难题。
因此,遵循国务院“关于加快推进畜禽养殖废弃物资源化利用”的粪污治理原则,开展对羊粪资源化综合利用、促进农业可持续发展的研究具有重要实践意义。资源化利用羊粪使其转化为有机肥是目前比较理想的处理方法[5]。资源化利用不但能消除羊粪对环境的污染,满足保护环境的需求,还能将羊粪再利用,使其转化为有机肥,加快传统畜牧业向新型现代循环农业模式的转变。新鲜羊粪中含有大量的寄生虫卵、病原菌、重金属和有毒有害物质,且植物可利用营养元素N,P,K释放缓慢,容易造成“烧苗”,不宜直接施用[6,7]。将其好氧堆肥化处理,使其转变为性质稳定的有机肥料,则可直接施用于土壤中。但羊为典型的草食性家畜,相较于其他动物,羊粪中纤维素和半纤维素含量高,不易降解,成为制约其好氧堆肥高效处理的主要原因之一[8]。在羊粪好氧堆肥过程中,加入纤维素降解菌,能够显著提升羊粪发酵堆肥的腐熟效率[9]。
纤维素分布广泛,是一种优良的资源,但难以降解成为制约纤维素广泛使用的瓶颈,纤维素类物质的主要处理方法有生物法、物理法和化学法[10]。相较于物理化学方法,生物法具有成本低,污染小等特点[11]。已有研究筛选了牛粪和猪粪中纤维素降解菌,但针对羊粪的研究较少,从羊粪中分离筛选菌株,能减少堆肥中外源添加菌株与土著菌株的拮抗作用[12,13]。本研究以新鲜羊粪和堆肥升温期羊粪为研究对象,借助滤纸条崩解试验及刚果红染色法,筛选具有优良纤维素降解能力的菌株,测定其产纤维素酶能力及秸秆降解能力,通过分子生物学鉴定,确定其分类学地位,最后对菌株的产酶活性与秸秆降解效果之间的关系及其贡献程度进行解析,以期为羊粪发酵菌剂的制作提供优良菌种资源。
1 材料与方法
1.1 试验材料
1.1.1样品采集 羊粪样品采集于武威普康养殖有限公司、金昌怡泉新禾农牧股份有限公司、甘肃欣海牧草饲料科技有限公司。取羊养殖场新鲜羊粪和堆肥升温期羊粪样品,带回实验室后4℃保存备用。
1.1.2培养基 羧甲基纤维素钠(CMC-Na)培养基[14],赫奇逊氏(Hutchinson)培养基[15],LB培养基[16],产酶培养基[17]。
1.2 试验方法
1.2.1纤维素降解菌的富集 称取采集的样品10 g,加入至90 mL无菌生理盐水中,28℃、140 r·min-1摇床振荡2 h,静置30 min后,吸取10 mL上清液,加入至90 mL赫奇逊氏培养基中,传代培养,直至滤纸条崩解效果稳定。
1.2.2纤维素降解菌的分离纯化 取降解滤纸条效果稳定的培养液,使用无菌生理盐水分稀释1 000倍,稀释完成后,移取130 μL涂布于LB培养基上。倒置于28℃恒温培养箱中,黑暗条件下培养,待平板长出菌落后,挑取单菌落于LB培养基上,通过四区划线法进行分离、纯化培养。
1.2.3纤维素降解菌的初筛 将已经纯化的菌株接种于CMC-Na培养基中,每个菌株3个重复。在28℃下培养生长出菌落,使用1 mg·mL-1的刚果红溶液染色20 min,倒去刚果红溶液,加入1 moL·L-1的NaCl溶液,15 min后倒去NaCl溶液,观察并记录培养基上透明圈直径(D)与菌落(d)直径,初步筛选出具有纤维素降解能力的菌株。
1.2.4纤维素降解菌滤纸崩解试验 取初筛得到的纤维素降解菌接种于赫奇逊氏培养基中,加入1 cm×5 cm无淀粉滤纸条(Whatman),每个菌株3次重复。28℃,150 r·min-1摇床培养7 d,依据滤纸条崩解程度,筛选优良纤维素降解菌。
1.2.5纤维素降解菌酶活力测定 取筛选出的菌悬液以1%接种量接种于产酶培养基中,28℃,180 r·min-1培养4 d,发酵液4 000 r·min-1离心10 min后取上清液作为粗酶液。粗酶液与无淀粉滤纸(Whatman)、脱脂棉、羧甲基纤维素钠(CMC-Na)和水杨苷四种底物反应的产物与3,5-二硝基水杨酸(DNS)溶液发生氧化还原反应,在540 nm波长下比色测定还原糖量,根据线性关系测定全酶(FPA)、外切葡聚糖酶(C1)、内切葡聚糖酶(CX)和β-葡萄糖苷酶(β-Gase)活力,改进已有的方法[18],酶活力单位为U·mL-1,定义为每分钟转化底物生成1 mmol葡萄糖所需的酶量。
1.2.6秸秆降解率测定 将小麦秸秆50℃烘干至恒重,粉碎过40目筛,以2%的量在产酶培养基中加入秸秆,接种10%菌液,28℃,150 r·min-1培养30 d。每个菌株3次重复,设置不加菌悬液为空白对照。将培养物5 000 r·min-1离心10 min,弃上清液,用蒸馏水反复清洗,直至无菌体,80℃烘至恒重,使用失重法计算秸秆降解率。
1.3 优良纤维素降解菌株初步鉴定
选取筛选的优良纤维素降解菌株,使用TaKaRa Lysis Buffer for Microorganism to Direct PCR试剂,提取DNA并进行PCR扩增[19]。扩增产物由北京擎科生物科技有限公司测序。将测序结果与NCBI(https://www.ncbi.nlm.nih.gov/)数据库中已有序列进行比对,利用MEGA 11软件构建系统发育树,明确菌株分类学地位,并将序列上传至NCBI GenBank获取登录号。
1.4 数据分析
使用Excel 2021软件整理数据,Origin 2021绘图,采用SPSS 26.0软件对数据进行One-Way ANOVA统计分析和Duncan极差法进行差异显著性检验。数据为平均值±标准误。相关性分析采用线性回归(y=ax+b)及多元回归(y=ax1+bx2+cx3+d)。
2 结果与分析
2.1 纤维素降解菌的富集、分离与纯化
以无淀粉滤纸条作为唯一碳源传代驯化培养,待降解滤纸条效果稳定之后,对菌液进行稀释涂布分离,将分离得到的单菌株进行四区划线纯化,共得到26株纯化菌株,将菌株接种于斜面培养基中,保存。
2.2 纤维素降解菌的初筛
接种菌株于CMC-Na培养基中,刚果红染色后,发现共有7株菌透明圈直径与菌株直径比值大于3,1株菌透明圈直径与菌株直径比值大于5。D/d比值越大,说明该菌株产纤维素酶活性较高或该菌株产酶量较大,该比值可作为初步筛选优良纤维素降解菌株的依据,由表1可知,菌株n3-6、Jc、En1-1、L3-1、n3-3、n3-4和Ja菌落直径与透明圈直径比值较高,相较于其他菌株,产纤维素酶能力更高或产酶量更大,选择上述菌株进一步测定产酶能力及秸秆降解率。

表1 纤维素降解菌初筛结果Table 1 Results of the initial screening of cellulose degrading bacteria
2.3 滤纸条崩解试验
由表1可知,菌株Ja与菌株En1-1对滤纸条的降解效果最好,降解后滤纸条呈现糊状;菌株L3-1、n3-3、n3-4、Jc和n3-6对滤纸条的降解效果次之,滤纸条降解效果呈不定状,大部分已被降解。滤纸条降解效果还受到降解时间的影响,菌株n3-6与菌株Jc培养2 d后开始逐步降解,4 d后滤纸条已降解为近似糊状,6 d时,滤纸条已完全降解,呈现糊状。其他5株菌在第4 d时滤纸条开始逐步降解,分解为片状,7 d时降解为不定状,80%被降解。
2.4 纤维素降解菌酶活力的测定
纤维素类物质的降解主要依靠纤维素酶的作用,由图1可知,全酶活性最高的菌株为En1-1,达到2.83 U·mL-1,其次为菌株Jc,两菌株全酶活性差异显著(P<0.05)。菌株n3-3全酶活性最低,为1.03 U·mL-1。菌株En1-1外切酶活性最高,为5.78 U·mL-1,与其他菌株外切酶活性均差异显著(P<0.05),其次为菌株L3-3与菌株Ja,但两菌株外切酶活性无显著性差异,菌株n3-3外切酶活性最低为3.42 U·mL-1。内切酶活性最高的为菌株En1-1,值为3.25 U·mL-1,菌株n3-3内切酶活力最低为1.24U·mL-1。菌株En1-1内切酶活性与其他菌株内切酶活性具有显著差异(P<0.05)。β-葡萄糖苷酶活性最高的菌株为En1-1,与其他菌株β-葡萄糖苷酶活性差异显著(P<0.05),β-葡萄糖酶活性最低的菌株为n3-3。
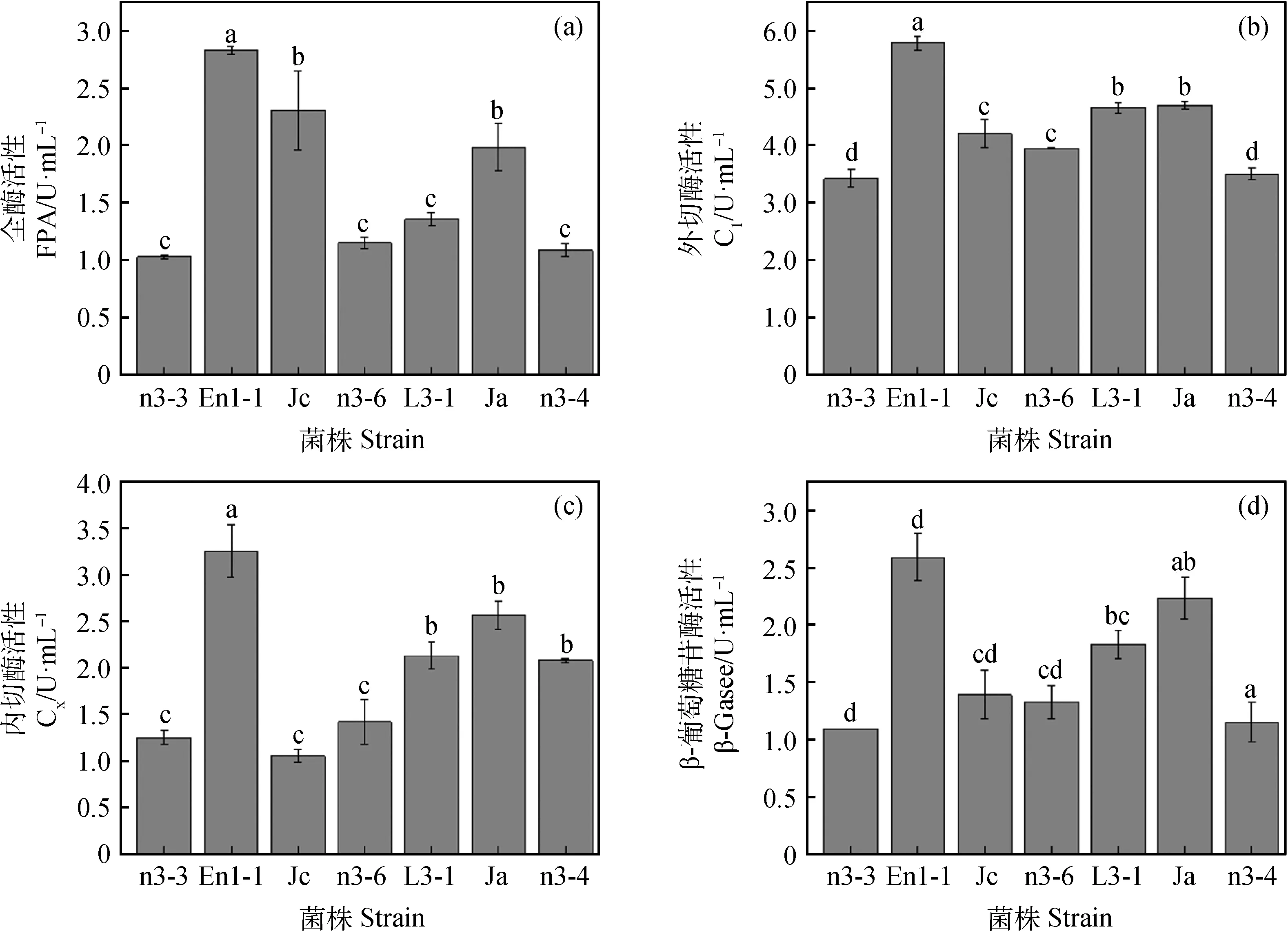
图1 菌株酶活性Fig.1 Enzyme activity of strains注:误差线为标准误。不同小写字母表示差异显著(P<0.05)。下同Note:The error line is standard error. Different lowercase letters indicate a significant difference between different strains.The same as below
2.5 秸秆降解测定
由图2可知,菌株En-1秸秆降解率显著高于其他菌株,值为28.53%(P<0.05)。菌株Ja秸秆降解率次之,为24.58%,除L3-1外与其他菌株秸秆降解率均差异显著(P<0.05)。其次为菌株L3-1,降解率为23.17%。菌株n3-3秸秆降解率最低,为19.36%。

图2 菌株秸秆降解率Fig.2 Straw degradation rate of strains
2.6 优良纤维素降解菌株鉴定
对筛选得到的7株优良纤维素降解菌株进行16S rRAN鉴定,比对同源序列,并构建系统发育树。菌株L3-1基因序列与S.kummerowiaeCCBAU 25048T相似度高达99.27%、菌株n3-4基因序列与S.yambaruensisMS4T相似度达97.91%、菌株Jc基因序列与S.terraesubsp.UmmariensisUI2T相似度达98.77%、菌株n3-6基因序列与S.terraesubsp.TerraeNBRC 15098T相似度达98.70%、菌株n3-3基因序列与P.suwonensis4M1T相似度达97.79%、菌株Ja基因序列与C.udaDSM 20107T相似度达97.79%、菌株En1-1基因序列与D.fermentansDSM18053T相似度高达99.05%。
2.7 菌株纤维素酶活性与秸秆降解率相关性分析
相关性分析表明(图4),菌株对秸秆的降解率与菌株产4种纤维素酶的活性呈正相关关系,酶活性越高,降解率越高。其中,菌株秸秆降解率随外切酶活性的增加,增长幅度最大(y=3.58x+7.14,R2=0.79,P<0.000 1);随内切酶活性的增加,增长幅度次之(y=3.20x+16.33,R2=0.6,P<0.000 1);随β-葡萄糖苷酶活性的增加,增加幅度(y=4.41x+15.31,R2=0.66,P<0.000 1);随全酶活性的增加,增加幅度最小(y=3.44x+16.85,R2=0.561 9,P<0.000 1)。对4种酶与降解率进行多元回归分析发现,菌株秸秆降解能力与4种酶活性存在密切相关(R2=0.80,P<0.000 1),其中,内切酶(P=0.09)与外切酶(P=0.10)对菌株秸秆降解能力的贡献较大,而全酶(P=0.27)与β-葡萄糖苷酶(P=0.50)贡献较小。因此,纤维素内切酶与外切酶是菌株降解秸秆的主要驱动力。
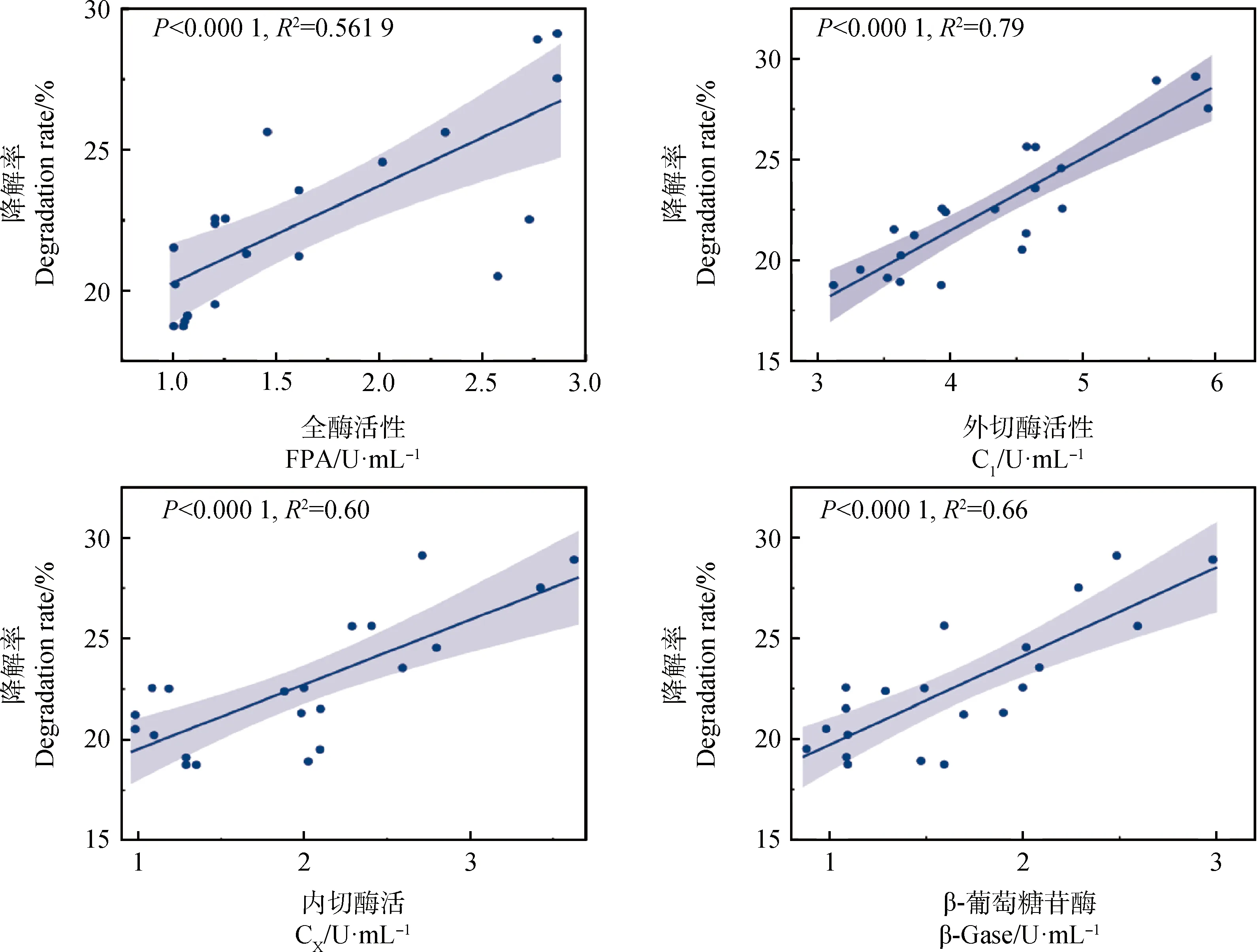
图4 菌株秸秆降解率与纤维素酶活性相关性分析Fig.4 Correlation analysis between straw degradation rate and cellulase activity of strains
3 讨论
传统堆肥主要依赖堆体内部的微生物,通过添加外源微生物菌剂,能够在一定程度上改善堆肥初始时期微生物的数量与结构,从而加快堆肥进程[20-21]。添加外源微生物,可影响堆肥过程中微生物的代谢,进而提升堆肥产品的品质。筛选具有优良纤维素降解能力的菌株,可以显著提升堆肥过程中纤维素类物质的降解速率[22]。本研究从新鲜羊粪中共分离出26株具有纤维素降解能力的菌株,通过刚果红染色法及滤纸条崩解试验,筛选出7株具有较高纤维素降解能力的菌株,对其秸秆降解能力测定,发现其降解能力均在15%以上。滤纸是一类具有较为适中聚合度和结晶度的天然结晶类纤维素,在纤维素类降解菌的筛选中被广泛使用[23]。滤纸中的结晶纤维素的结晶区是一种不溶性的刚性结构,相较于一般的天然纤维素类物质更难以降解,因此,利用结晶纤维素为唯一碳源并通过测定菌株的秸秆降解率,来检验其降解纤维素类物质的真实能力。菌株通过产生的细胞表面酶对纤维素类物质进行降解,但需要附着在纤维素类物质表面才能降解[24]。因此,菌株的纤维素酶活力大小只能反映出其胞外酶活力大小,不能反映真实的纤维素降解能力。需通过测定菌株的秸秆降解能力,来反映菌株真实的纤维素降解能力[25]。纤维素是一系列通过β-1,4糖苷键连接在一起的葡萄糖基长链,其中各个葡萄糖基与相连的其他葡萄糖基呈 180°夹角,纤维素聚合体长链中重复的最小单位是纤维二糖[26]。Ries等[27]发现纤维素酶主要由三种类型组成,包括内切葡聚糖酶(CX酶)、外切葡聚糖酶(C1酶)和β-葡萄糖苷酶,3种酶组成复合酶系。在酶活性测定过程中,一般测定其中某一特定成分,而实际的降解过程则有多种组分共同催化水解的结果[28]。本研究对菌株酶活性测定发现,菌株En1-1全酶活力最高,其次为菌株Jc,滤纸条降解能力最高的为菌株En1-1,但秸秆降解率除En1-1菌株外,降解效果最好的为菌株Ja。刘东阳等[29]发现蜡状芽孢杆菌降解小麦秸秆的能力最强,但其纤维素酶活力并不高,由此可知,纤维素酶活力与纤维素降解能力并不一定相同。其原因可能为菌株在不同生长基质中,产纤维素酶能力并不相同。滤纸与天然的纤维素类物质仍然存在一定的差异。因此,菌株的降解性能仍需要通过其他指标,如秸秆降解率等来进行综合的分析评价。外切酶中,菌株En1-1外切酶活性最高,内切酶与β-葡萄糖苷酶活性中,最高的也为菌株En1-1。通过对纤维素降解率与纤维素酶活性相关性分析,发现纤维素降解过程中,纤维素内切酶与纤维素外切酶为主要的驱动因素。这与梅新兰等[30]的研究结果相似,江高飞等[31]则认为纤维素内切酶是菌株降解玉米秸秆的关键驱动因素。
通过对菌株进行分子生物学鉴定发现,7株菌中具有较强的纤维素降解能力的菌株L3-1与n3-4为山原申氏菌和鸡眼草申氏菌[32]。本研究发现申氏杆菌具有较强的纤维素降解能力,有研究报道,申氏杆菌具有降解N-酰基高丝氨酸内酯的能力,对植物的病害具有一定的防控能力[33]。菌株En1-1鉴定为植物内生成对杆菌,有研究首次从母乳喂养的婴儿粪便中分离,发现其具有降低胆固醇和一定的抗癌活性,对人体无致病性[34]。菌株Ja鉴定为潮湿纤维单胞菌,纤维单胞菌是一类革兰氏阳性细菌,好氧或兼性厌氧细菌,该类菌株不但能产生多种纤维素相关酶类,还具有沉淀重金属离子等功能,具有优良的纤维素降解能力,能够应用与堆肥试验中[35-36]。菌株n2-3与菌株n3-6鉴定为鞘氨醇菌属,孙元烽[37]在羊粪中分离出鞘氨醇菌属菌株,应用与羊粪堆肥发酵过程中,显著缩短了堆肥发酵周期,提升了总养分含量,具有较好的应用潜力。菌株n3-3鉴定为水原假黄单胞菌,Weon等[38-39]从棉花废弃物堆肥中分离出假单胞菌属。本试验发现,假单胞菌属具有一定的纤维素降解能力,能够应用于后续堆肥试验中,且对人体无致病性。菌株Ja与菌株n3-3具有一定的纤维素降解能力,菌株En1-1具有较高的纤维素产酶能力及秸秆降解能力,后续可以应用于羊粪堆肥发酵中,或与其他菌株复配为复合菌系,提升降解效果。
4 结论
本试验共分离出26株菌,复筛得到7株,测定其产酶能力以及秸秆降解能力,发现7株菌均具有较好的降解性能,降解率均在15%以上。经鉴定分别为山原申氏菌、鸡眼草申氏菌、土地鞘氨醇盒菌、植物内生成对杆菌、潮湿纤维单胞菌、水原假黄单胞菌。试验分析了菌株产纤维素酶活性与秸秆降解效果之间的关系,明确纤维素内切酶与外切酶是菌株降解秸秆的主要驱动因素。本试验筛选的菌株可为堆肥微生物菌剂的制作提供良好的菌剂储备资源,有望应用于羊粪堆肥中并取得较好的效果。

