不同调强放疗技术在局部晚期非小细胞肺癌根治性放疗中的剂量参数比较
关明丽,雷亚楠,李 贺
(河南科技大学第一附属医院肿瘤放疗科,河南 洛阳 471000)
肺癌不仅是当前我国最多见的恶性肿瘤之一,且其发病率与死亡率在近些年来均表现为逐年增高趋势。根据中国国家癌症登记中心(NCCR)2015年的国家癌症统计数据,当年我国新诊断肺癌患者约733 300例,肺癌死亡病例为610 200例(发病率为35.92/100 000,死亡率为28.02/100 000)[1]。而国际癌症研究机构报告统计数据显示,2020年中国新发肺癌约820 000例,肺癌相关死亡为715 000例[2-3]。在全部肺癌病理类型中,非小细胞肺癌(NSCLC)占80%~85%[4]。文献报道显示,其中30.2%~39.8%的NSCLC 为局部晚期[5]。多数局部晚期NSCLC患者错过了手术切除的最佳时机,其主要治疗手段为放化疗联合治疗,旨在最大程度帮助患者改善临床症状并延长生存期,然而整体疗效及中位生存期仍不十分理想。目前,相关学者普遍认为NSCLC的局部控制率及患者的死亡率均可通过提高放疗剂量获得一定程度提高,但由于控制病灶周边的正常组织和器官在放疗过程中的不良反应也是十分必要的,这势必也会限制放疗剂量的提升阈值。如何增加靶区照射剂量,且避免对周边正常组织与器官造成不良放射反应,成为当前研究热点。近20年来,随着放疗设备、计算机及医学影像学相关技术的不断发展与进步,临床放射治疗技术也不断有所突破,当前已迈入“精准放疗”时代,多种先进的调强放疗技术已在临床得到广泛应用,如固定野调强放射治疗(IMRT)、容积弧形调强放射治疗(VMAT)和螺旋断层放疗系统(TOMO)等。目前,关于以上3种不同调强放疗技术在局部晚期NSCLC患者中应用的剂量学参数比较的报道较少。鉴于此,本研究选取96例局部晚期NSCLC患者为研究对象,通过对比分析该3种不同调强放疗技术在局部晚期NSCLC患者根治性放疗中的计划靶区及危及器官的剂量参数,从而为临床应用提供依据。
1 资料与方法
1.1一般资料 选取2020年9月至2022年9月本院收治的局部晚期NSCLC患者96例。纳入标准:(1)经组织学或细胞学证实为局部晚期NSCLC;(2)TNM分期为ⅡB、ⅢA、ⅢB不可切除或拒绝手术;(3)入组本研究前未接受过放化疗治疗;(4)ECOG体能状态评分为0~1分;(5)预期生存时间大于3个月。排除标准:(1)Ⅲ~Ⅳ级心功能不全;(2)已明确有远处转移;(3)合并其他恶性肿瘤或具有恶性肿瘤病史;(4)肝、肾等重要器官严重不全;(5)合并有其他任何放化疗禁忌的疾病或状况,如感染活跃期、心肌梗死后未超过6个月及其他症状性心脏病等;(6)对放射治疗不耐受。96例患者中男60例,女32例;年龄42~70岁,平均(60.52±8.68)岁;TNM分期:ⅡB期9例、ⅢA期49例、ⅢB期34例;疾病类型:腺细胞癌45例,鳞状细胞癌47例;原发灶部位包括左上叶26例,左下叶9例,右上叶38例,右中叶13例,右下叶10例;原发灶类型包括中央型35例,周围型61例;计划靶区(PTV)容积311.95(89.12~647.37)cm3。本研究已通过医院医学伦理委员会审批(2020-HNKJDXYFY 064),且患者或其直系亲属知情并签署同意书。
1.2方法
1.2.1放疗定位与CT模拟定位 患者取仰卧位,双手放于头顶,以真空垫固定体位。引导患者呼吸平稳后行平扫和增强扫描。对全部患者均行4DCT扫描,将获取的CT图像采用软件根据呼吸相的不同进行拆分,共拆分为十套图像,最后将该十套图像均传送至Raystation和TomoTherapy计划系统工作站。
1.2.2放疗靶区与周围危及器官勾画 大体肿瘤体积(GTV)勾画:GTV为CT扫描可见肿瘤,于肺窗条件下勾画肺部肿瘤,并在纵隔窗条件下勾画正常组织器官、纵隔阳性淋巴结、纵隔边界肿瘤;临床靶体积(CTV)勾画:于GTV基础上参照肿瘤病理类型,向外放0.6~0.8 cm,包括部分高危淋巴结引流区;PTV勾画:参照肿瘤位置,于CTV基础上向外放1.0~1.5 cm,并勾画周边危及器官,主要包括双肺、心脏、脊髓、食管。
1.2.3靶区剂量与危及器官剂量限制 所有患者均采用直线加速器6MV X线照射进行治疗,PTV采用统一照射剂量,200 cGy/F,每天1次,每周5次,DT:6 000 cGy/30F。危及器官剂量限制参考《中国非小细胞肺癌放射治疗临床指南(2020版)》[6]并结合本单位具体情况建立如表1所示的剂量限制标准。
1.2.4治疗计划设计 全部患者所采用的CT模拟图像、靶区及关键器官的勾画均保持一致。在Raystation和TomoTherapy计划系统上对每一例患者相同PTV分别设计IMRT、VMAT和TOMO计划。3种计划所设定的优化目标和剂量限制条件均相同。最后将计划剂量均归一为95%以上体积的PTV覆盖6 000 cGy的照射剂量,同时计算PTV和相关危及器官剂量体积的直方图(DVH)。IMRT应用固定野静态调强技术,根据患者的具体情况采用5~7野角度均分的共面照射野;VMAT采用机架旋转模式治疗,以个体化病灶具体情况设双弧,每2度给1个照射野;TOMO采用螺旋断层调强技术,每个螺旋包括51个射束。每种技术均优化选取放疗计划。
1.2.5治疗计划评估 靶区剂量评估指标:靶区剂量适形度指数(CI)、不均匀度指数(HI)、最大剂量(Dmax)、平均剂量(Dmean),1%、2%、50%、95%、98%、99%靶区体积所受剂量D1、D2、D50、D95、D98、D99,95%、100%、105%处方剂量所围体积占比V95、V100、V105。CI=(VROI,pres)2/(VROI×Vbody,pres),其中VROI,pres为处方剂量覆盖的PTV容积,VROI为PTV容积,Vbody,pres为处方剂量覆盖的总容积。CI值越趋近1表示计划适形度越高。HI=(D2-D98)/Dpres,其中D2和D98分别代表覆盖2%及98%PTV的照射剂量,Dpres代表PTV的处方剂量。HI越低表明剂量分布更理想。危及器官评估指标:双肺的Dmean、V5、V10、V20、V30、V40及V50(VD:接受DGy或以上的靶器官占总容积的比例);心脏Dmean、V5、V10、V20、V30、V40及V50,食管Dmean和Dmax;脊髓Dmax。

2 结 果
2.13种不同调强放疗技术的PTV剂量比较 与IMRT和TOMO比较,VMAT的CI显著更高,与TOMO比较,VMAT的HI显著更低,差异均有统计学意义(P<0.05);与TOMO比较,IMRT的HI显著更低,差异有统计学意义(P<0.05);与IMRT和TOMO比较,VMAT的Dmean显著更低,差异有统计学意义(P<0.05);在高剂量区(D1、D2)和低剂量区(D98、D99)及V95、V105等方面,TOMO较IMRT和VMAT两种技术均显著更低,差异均有统计学意义(P<0.05)。见表2。
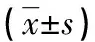
表2 3种不同调强放疗技术的PTV剂量参数比较
2.23种不同调强放疗技术的危及器官剂量比较 双肺、心脏、脊髓、食管的各剂量详见表3。3种不同调强放疗技术下的全肺Dmean、V5、V10、V40及V50比较,差异均无统计学意义(P>0.05);与IMRT比较,TOMO的全肺V20及V30显著更低,差异均有统计学意义(P<0.05)。与TOMO比较,IMRT的心脏Dmean、V5、V10及V20显著更低,差异均有统计学意义(P<0.05)。3种不同调强放疗技术下的脊髓Dmax及食管Dmax、Dmean比较,差异均无统计学意义(P>0.05)。
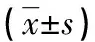
表3 3种不同调强放疗技术的危及器官剂量比较
2.33种不同调强放疗技术对不同原发灶部位NSCLC的剂量比较 在左肺NSCLC患者中,与IMRT和VMAT比较,TOMO在正常肺组织的剂量相对更低;尤其与IMRT相比,TOMO的V20和V30显著更低,差异均有统计学意义(P<0.05);但VMAT在心脏的剂量低于IMRT和TOMO,尤其与TOMO相比,VMAT的Dmean、V10、V20、V30均显著更低,差异均有统计学意义(P<0.05)。在右肺NSCLC患者中,与IMRT和TOMO比较,VMAT的CI和HI数据明显更优,差异均有统计学意义(P<0.05);与IMRT比较,TOMO对正常肺组织的Dmean、心脏V5及V10均显著更高,差异均有统计学意义(P<0.05)。见表4。
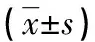
表4 3种不同调强放疗技术对不同原发灶部位NSCLC的剂量比较
2.43种不同调强放疗技术对不同PTV容积NSCLC的剂量比较 参考全部患者的中位PTV 容积[311.95(89.12~647.37) cm3],将大于或等于311.95 cm3者和小于311.95 cm3者分别定义为大靶区和小靶区。在纳入大靶区的患者中,VMAT的CI明显优于IMRT,HI明显优于TOMO,差异均有统计学意义(P<0.05);与TOMO比较,IMRT的心脏Dmean、V5、V10、V20显著更低,差异均有统计学意义(P<0.05)。在纳入小靶区的患者中,3种不同调强放疗技术的CI数据基本接近,与IMRT和VMAT比较,TOMO的HI显著更高,差异有统计学意义(P<0.05),TOMO的心脏V5高于IMRT和VMAT,其中与IMRT比较,差异有统计学意义(P<0.05)。见表5。
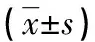
表5 3种不同调强放疗技术对不同PTV容积NSCLC的剂量比较
2.53种不同调强放疗技术对不同原发灶类型NSCLC的剂量比较 在中央型NSCLC患者中,与IMRT比较,TOMO的V20显著更低,但V5却显著更高,差异均有统计学意义(P<0.05);在周围型NSCLC患者中,VMAT的CI高于IMRT和TOMO,其中与IMRT比较,差异有统计学意义(P<0.05),见表6。
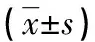
表6 3种不同调强放疗技术对不同原发灶类型NSCLC的剂量比较
3 讨 论
在当前,局部晚期NSCLC的治疗依然是肿瘤学学者面临的最大挑战之一。放疗联合化疗是不可切除肿瘤的晚期NSCLC患者的标准治疗方法,但放疗的潜在毒性作用仍然是一个重大问题,杀瘤剂量可能高于邻近关键结构的耐受性,包括健康肺实质、食管、心脏和脊髓等[7-9]。这也往往是导致同步放化疗治疗局部晚期 NSCLC的疗效仍然较差的重要原因。随着相关领域的技术进步,虽然已进入放射肿瘤学最激动人心的“精准放疗”时代,继而能够一定程度实现在周围正常组织暴露有限的情况下获得更准确的辐射输送,但各种新兴放疗技术仍存在平台期,整体临床结局也尚不令人满意。放疗相关的剂量学因素在肺癌的放疗过程中起着至关重要的作用。鉴于此,通过研究新的放疗技术,以确保有效控制癌周正常组织受照剂量的同时,最大限度提高靶区的受照剂量具有重要临床意义。
IMRT技术作为当前放疗技术革命性发展的成果之一,其在我国的各大肿瘤中心均获得了较为广泛的推广应用,该技术集合了多种先进技术或装备,其中主要包括精密二维和三维剂量验证设备、新型加速器及逆向优化治疗计划设计软件等,可在尽量减少正常组织照射体积和剂量的同时,最大限度提升病灶靶区的适形度并相应增高照射剂量[10]。然而IMRT的操作过程相对较耗时,这可能会导致相对生物效应降低,同时全程可发生更多体位变化及器官蠕动等,均可增加靶区改变的风险,这些因素可导致最终的治疗精度降低。另外,由于靶区形态的不规则性导致其常会与正常肺组织交织,继而增加了IMRT计划设计难度,妨碍理想射野角度的选择[11]。VMAT技术是近几年放疗技术领域另一项先进的技术突破,其较传统的固定野静态调强治疗模式最大的特点在于引入了动态治疗的理念。具体而言,在VMAT放疗方案中,剂量率、多叶光栅叶片位置、备份光栅位置、准直器角度、机架角度及旋转速度等均是连续动态变化的,故与常规IMRT相比,其在剂量分布与输出,以及缩短治疗过程耗时等方面具有一定优势[12]。VALAKH等[13]的研究表明,单弧共面360°VMAT(360-VMAT)计划与IMRT计划相比,360-VMAT的剂量适形度与均匀度显著更高,且明显减少了食管的受照剂量。在AHMAD等[14]的研究中,VMAT的D95比IMRT提高2.68%,D99增加3.65%,但VMAT的危及器官剂量较低,脊髓Dmax、食管及肺V20分别降低24.1%、22.1%和16.3%,另外3 mm的γ通过率较IMRT相差了3%。该结果表明在γ通过率相同的情况下,VMAT在靶区剂量覆盖、危及器官剂量及传输时间等方面均较IMRT更佳。在本研究中,VMAT相较IMRT在CI和HI方面均明显更好,尤其对于中央型、大靶区及右侧肺癌而言更明显。
TOMO是一种新型的调强放疗方式,其能在空间及时间2个层面对治疗光束进行调制,并能在图像引导下完成调强放射治疗,如此可最大限度提升针对病灶的输送剂量,同时有效减少正常组织的剂量[15]。TOMO实现了对肿瘤靶区的360°环绕聚焦,可确保在肿瘤表面均匀分布剂量,对于形状复杂、程度较高的病灶具有更好的适形度。当前,已有不少的学者开展了TOMO与其他放疗方式的计量学对比研究,且多数研究结论支持TOMO具有更明显的计量学优势,尤其在剂量分布均匀性及剂量梯度陡峭性方面优势相对更明显[16]。在本研究中,与TOMO和IMRT两种技术比较,VMAT的CI更高且HI更低,表明其PTV剂量曲线适形度和剂量分布均匀度均相对更好。另外,VMAT在平均CI上均显著优于TOMO或IMRT;VAMT和IMRT在平均HI上也显著好于TOMO,差异均有统计学意义(P<0.05)。VMAT技术在PTV的Dmean与TOMO和IMRT相比均显著降低,差异均有统计学意义(P<0.05)。在高剂量区(D1、D2)和低剂量区(D98、D99)、V95、V105等方面,TOMO与其他2种技术相比明显较低(P<0.05),说明TOMO计划在局部晚期NSCLC患者中的剂量分布或差于VMAT和IMRT。
关于针对心脏的放射性损伤相关计量学参数目前鲜有研究报道。国外文献资料显示,相较于3D-CRT技术,VMAT技术在心脏Dmean、V40、V45、V60方面均未显示明显的计量学优势[17-18]。由于脊髓为串联器官,其所受到的放射损伤通常与最大照射剂量相关。在本研究中,在心脏Dmax、V5、V10和V20等参数方面,IMRT较TOMO均更具优势(P<0.05)。同时3种技术在食管Dmean、脊髓、食管Dmax方面均不存在明显差异(P>0.05)。
综上所述,与TOMO和IMRT相比,VMAT在靶区适形度和剂量均匀性方面均具有更大的优势,而TOMO在减少正常肺组织(以V20和V30为主)剂量方面效果更好,但在肺低剂量区和心脏照射剂量方面高于VMAT和IMRT。在3种调强放疗技术中,从物理学参数角度看,VMAT似乎是最适合局部晚期NSCLC患者(尤其对中央型、大靶区和右侧肺癌)放疗的照射计划。

