基于Triangle理论的延续性护理对胰腺癌患者术后营养不良发生风险及程度的影响
盛秋,张灿,陈沛
江苏省苏北人民医院 肝胆胰中心,江苏 扬州 225001
胰腺癌是临床上恶性程度极高的一种消化系统肿瘤,其5年生存率仅为10%;在国内所有肿瘤中胰腺癌的发生率排第9位,病死率排第6位[1-2]。根治术是胰腺癌主要的治疗手段,但患者术后多会发生不同程度的营养不良,导致机体免疫功能下降,术后感染率高、预后较差[3]。相关报道指出,胰腺癌术后给予有效的营养支持,对患者术后免疫抑制具有较好的改善效果[4]。延续性护理是由医院延续至家庭的一种护理模式,包括制定出院计划、患者转诊、回归社区或家庭的持续性指导与随访[5]。Triangle慢性疾病分层管理模型,通过将患者分为平稳、高危以及重症等层级,随后根据各层级的需要给予按比例分配的授权管理、自我管理以及专业护理,形成一个金字塔形式的管理结构[6]。本研究旨在分析基于Triangle理论的延续性护理对胰腺癌患者术后营养不良发生风险和程度的影响,以期为临床护理工作提供参考,现报道如下。
1 资料和方法
1.1 一般资料
本项回顾性研究经江苏省苏北人民医院医学伦理委员会审批(批号:2023ky202)后,回顾性纳入于2021年7月2022年12月收治入院的156例胰腺癌患者作为研究对象。根据胰腺癌术后护理方式的不同,将患者分为常规组(n=84)和Triangle组(n=72)。
纳入标准:(1)符合胰腺癌相关诊断标准[7];(2)接受根治性切除术;(3)采取常规或者基于Triangle理论的延续性护理;(4)临床资料完整。排除标准:(1)存在顽固性腹泻、吞咽困难等影响患者术后肠内营养(EN)的其他疾病;(2)存在其他严重肿瘤;(3)存在严重心、肝功能障碍;(4)长期服用激素类药物或者免疫抑制剂;(5)术前存在重度营养不良。
1.2 研究方法
1.2.1 延续性护理
(1)常规组患者进行常规延续性护理,持续干预3个月。具体见表1。
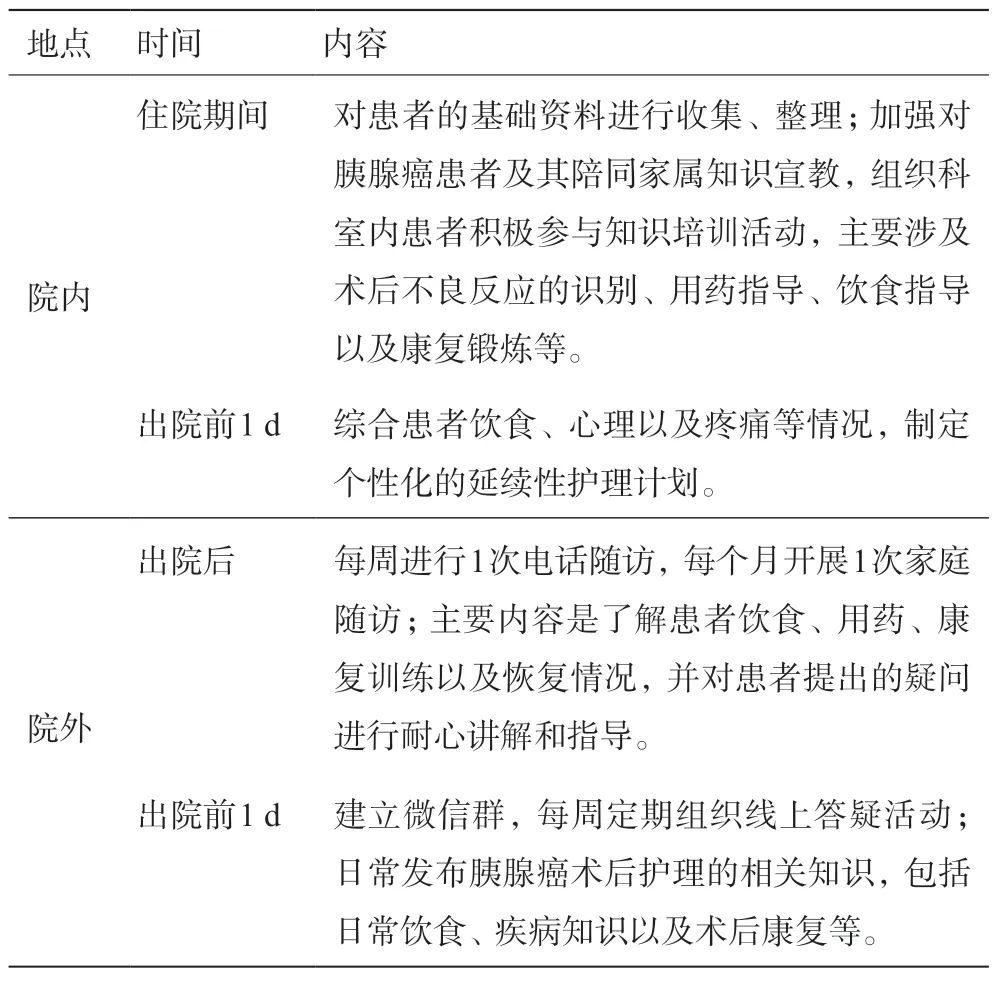
表1 常规延续性护理
(2)Triangle组患者进行基于Triangle理论的延续性护理。出院前1 d,结合患者营养风险给予营养支持,采用欧洲肠内肠外营养协会(ESPEN)推荐的营养风险筛查(Nutrition Risk Screening,NRS 2002)量表[8]评估风险,分为3部分内容。第一部分为营养状态评估,评分为0~3 分;第二部分为疾病严重程度评估,评分为0~3 分;第三部分为年龄评分,评分为0~1分。NRS 2002总分为0~7分。具体干预措施见表2。其余同常规组。

表2 基于Triangle理论的延续性护理
1.2.2 患者临床资料收集 运用电子病历档案收集所有患者的临床资料,主要包括延续性护理方式,术后营养不良发生情况、严重程度,营养相关指标,营养风险,肿瘤大小,淋巴结转移以及肿瘤位置等。营养相关指标:术后1 d与术后10 d,检测患者血清总蛋白(serum total protein,STP)、白蛋白(albumin,ALB)以及血红蛋白(hemoglobin,HB)。出院前1 d,采用NRS 2002 量表对患者进行营养风险评估,分值<3 分提示无营养风险,≥3 分提示存在营养风险。
1.2.3 术后营养不良患者分组 术后3 个月采用患者主观全面评价(patient generated subjective global assessment,PG-SGA)量表[9],对患者营养状态进行评估,量表主要涉及体质量丢失、代谢应激、疾病状态以及体格检查评分4 部分内容,根据最后评分可分为营养正常(0~1分)、轻度营养不良(2~9分)以及重度营养不良(>9分)。以PG-SGA 1分为界判定术后是否发生营养不良。
1.3 质量控制
由两名工作人员严格依据相关纳入、排除标准选择研究对象,由两名工作人员按照统一标准对研究数据进行收集、整理、剔除以及统计。采用Epidata软件并使用双平行录入法录入整理好的数据,以确保收集数据的真实性和准确性。
1.4 统计学分析
采用SPSS 23.0软件对相关数据进行统计处理。计量资料以()表示,组间比较采用t检验;计数资料以[例(%)]表示,组间比较采用χ2检验;采用Kaplan-Meier曲线分析基于Triangle理论的延续性护理与术后营养不良发生风险的相关性;采用单因素Logistic回归法分析胰腺癌术后营养不良严重程度的影响因素。P<0.05表示差异具有统计学意义。
2 结果
2.1 常规组与Triangle组营养相关指标对比
术后1 d,常规组与Triangle组STP、ALB及HB水平对比,差异均无统计学意义(P>0.05);术后10 d,Triangle组STP、ALB及HB水平明显高于常规组(P<0.05)。见表3。
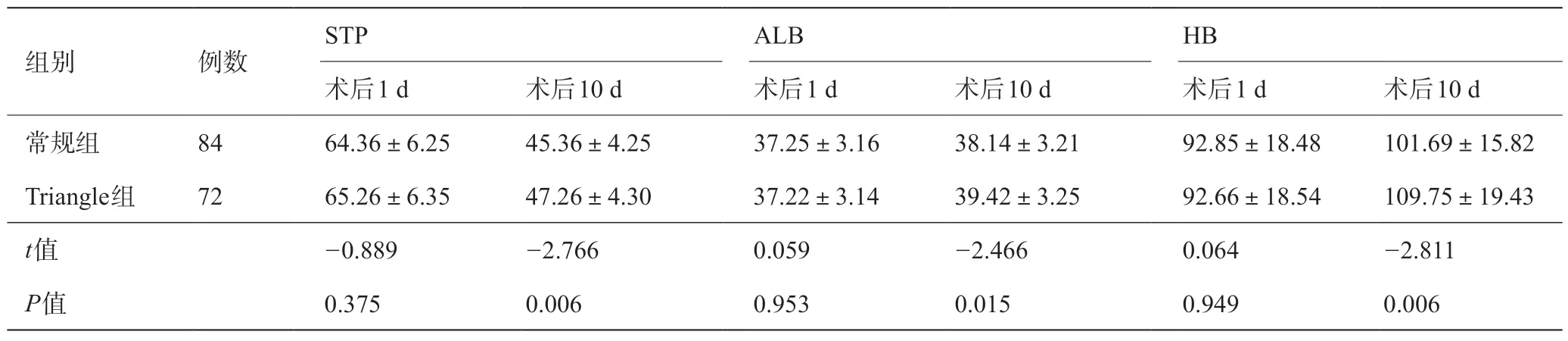
表3 常规组与Triangle组营养相关指标对比(g/L)
2.2 常规组和Triangle组患者术后营养不良的风险分析
在为期3个月的随访中,常规组发生术后营养不良41例(48.81%),Triangle组发生术后营养不良23例(31.94%)。Kaplan-Meier曲线分析显示:Triangle组与未发生术后营养不良明显相关[Log-rank(Mantel-Cox)=16.755,P<0.05]。见图1。
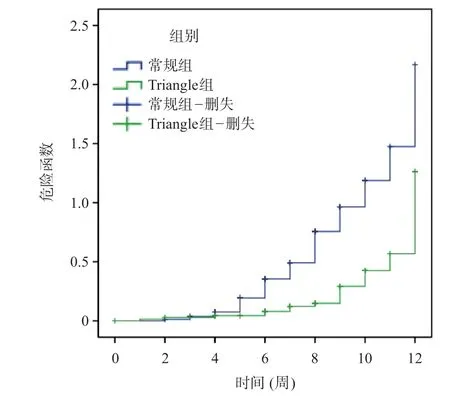
图1 常规组和Triangle组术后营养不良的Kaplan-Meier分析
2.3 术后轻度营养不良组与严重营养不良组临床资料对比
在156 例患者中,共64 例患者发生术后营养不良,其中有29例PG-SGA为2~9分,被划为轻度营养不良组,35 例PG-SGA>9 分,被划为重度营养不良组。两组在延续性护理方式与禁食时间方面对比,差异具有统计学意义(P<0.05);其余临床资料对比差异无统计学意义(P>0.05)。见表4。
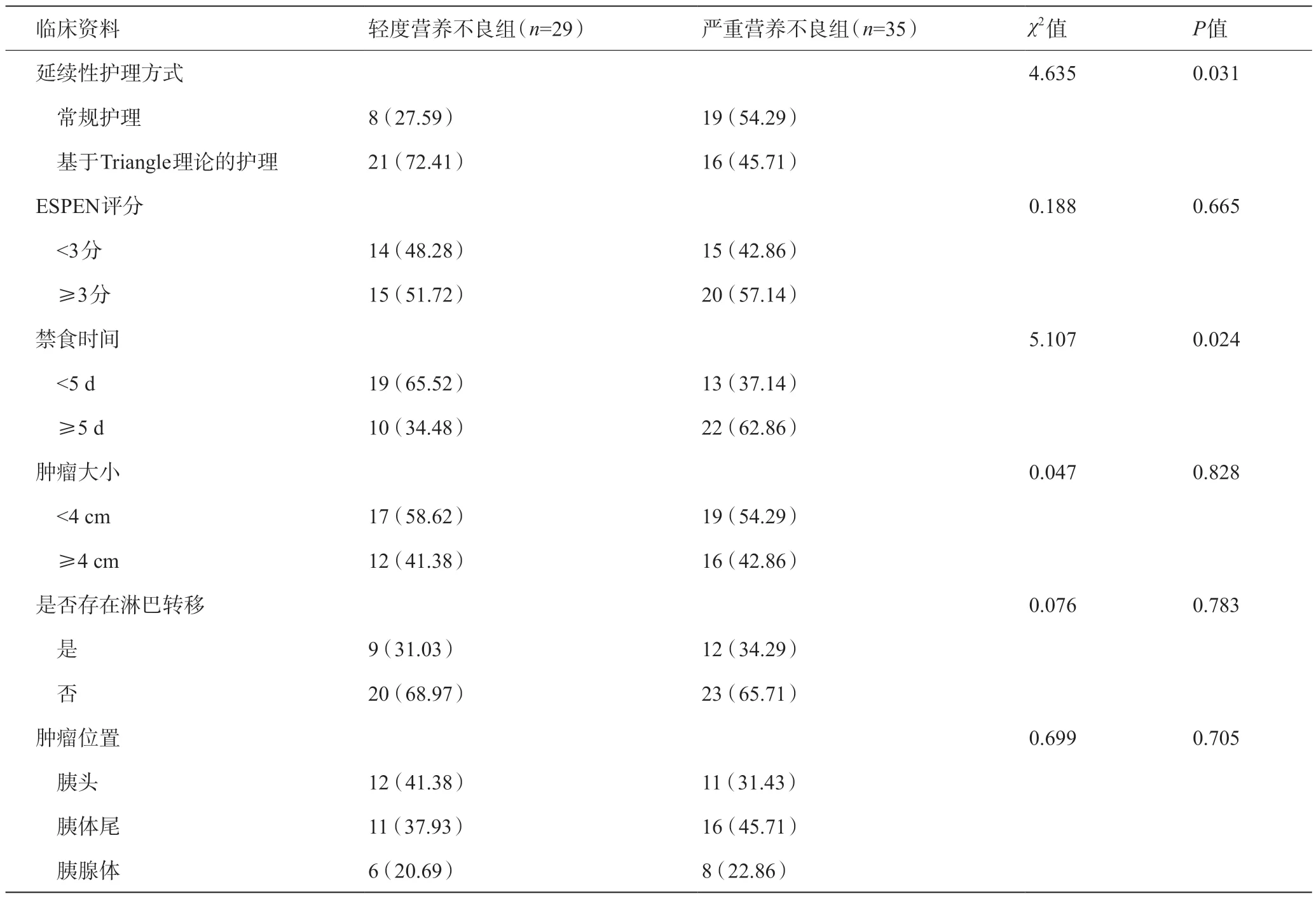
表4 轻度营养不良组与严重营养不良组临床资料对比[例(%)]
2.4 影响胰腺癌患者术后营养不良程度的单因素分析
以PG-SGA评分为因变量,以相关影响因素为自变量,采用单因素Logistic回归系数分析后,结果显示:延续性护理方式和禁食时间是胰腺癌患者术后营养不良程度的影响因素。见表5。
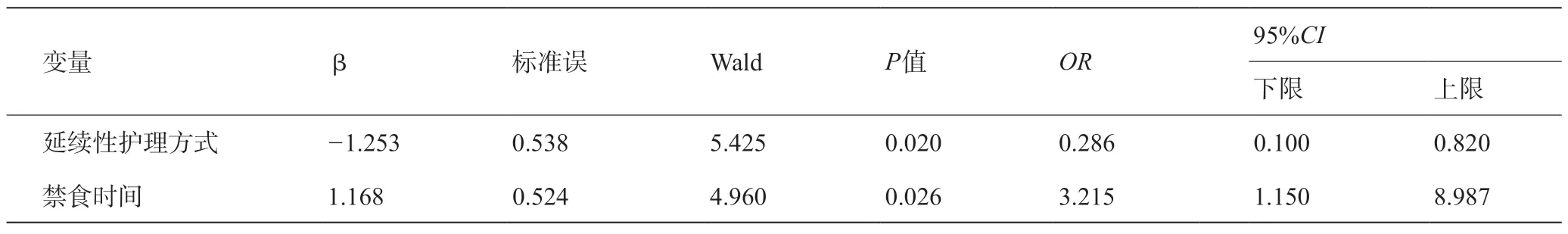
表5 胰腺癌患者术后营养不良程度的单因素Logistic回归分析
3 讨论
胰腺癌本身是一种消耗性疾病,加上手术创伤更易使患者出现蛋白质-热量缺乏型的营养不良,同时还会影响患者的机体免疫能力,进而造成术后复发率高、生存率低、预后差等不良后果[10-11]。延续性护理是医院内护理的延续,可在患者出院后给予系统性的护理服务,以满足患者居家期间的护理需求,其应用价值已在临床中得到广泛认可[12-14]。近年来大量研究指出,Triangle理论可在高血压、2型糖尿病等多种疾病的延续性护理中产生积极影响[15-16]。关于Triangle理论应用于胰腺癌术后的报道鲜见,因此本研究探讨了Triangle理论的延续性护理对胰腺癌患者术后营养不良发生风险及程度的影响,以期为临床护理工作提供参考。
3.1 基于Triangle理论的延续性护理可降低胰腺癌患者术后营养不良发生率
本研究中,胰腺癌患者术后10 d,Triangle组STP、ALB及HB水平显著高于常规组(P<0.05);Kaplan-Meier曲线显示,Triangle组与未发生术后营养不良明显相关;这提示,与常规延续性护理相比,基于Triangle理论的延续性护理有助于改善患者营养相关指标。胰腺癌术后需要根据患者情况禁食,期间可能引起机体免疫功能紊乱,进而影响患者营养吸收及胃肠功能。术后早期通过NRS 2002评估患者营养风险,并结合评估结果有针对性地给予营养支持,可通过维持患者肠道的淋巴结组织,进而促使IgA产生,有助于保护胃肠黏膜的完整性,减轻肠道菌群平衡失调,同时也可加快机体对相关营养物质的吸收。袁伟蓉等[17]在一项关于延续性护理干预维持性血液透析患者的研究中显示,观察组营养不良发生率显著低于对照组(P<0.05),与本结果具有一致性。
3.2 延续性护理方式和禁食时间是胰腺癌术后营养不养严重程度的影响因素
本研究中,延续性护理方式、禁食时间是胰腺癌术后营养不良严重程度的影响因素。分析原因:胰腺癌术后随着禁食时间增加,患者其肠道长期处于休息状态,而使肠道黏膜缺少食物的有效刺激,引起绒毛萎缩与黏膜薄弱,进而导致患者自身修复能力降低[18]。此外,长时间禁食会减少消化液分泌,导致肠道内杀菌效果降低,影响胃肠道正常菌群,出现胃肠道功能异常,加重营养不良[19]。相关研究报道指出,消化道肿瘤患者在接受延续性护理后,能够满足患者居家的护理需求,改善其心理状态与生活质量[20]。另有,戴安妮等[21]在干预下肢静脉溃疡患者的研究中指出,基于Triangle理论的护理效果明显优于常规延续性护理。本研究中,Triangle组根据每周对患者营养风险评估结果,计算患者每日所需要的营养量,并按照递增的方式进行营养供给,对患者肠道功能所产生的刺激是循序渐进的,在降低对患者肠道黏膜细胞损伤的同时可调节患者的胃肠分泌功能,促进营养物质的吸收。
综上所述,基于Triangle理论的延续性护理应用于胰腺癌患者术后管理,发生营养不良的风险更低;延续性护理方式与禁食时间是胰腺癌患者术后营养不良严重程度的影响因素。本研究结果有待加大样本量进一步验证。

