逍遥丸对非酒精性脂肪性肝炎大鼠粪便代谢组学和PPARα、PGC1α的影响❋
张玉伟,孟雅楠,张馨月,苗宇船,△
(1.山西省中医药研究院,太原 030000;2.山西中医药大学,山西晋中 030619)
近年来随着人们饮食结构的巨大变化,代谢相关性疾病逐渐呈现出全球性大流行的态势,其中非酒精性脂肪性肝炎(nonalcoholic steatohepatitis, NASH)的发病率更是居高不下。运用代谢组学技术可以对样本进行高通量检测,筛查与NASH相关的差异代谢物与代谢途径,为NASH的基础研究寻找新靶点、开拓新思路[1-2]。课题组前期研究发现,逍遥丸具有疏肝解郁、养血健脾的功效,能够减少肝细胞内脂肪蓄积,治疗NASH,然而其作用机制尚不明确[3-5]。本研究建立大鼠NASH模型,运用高通量液相色谱-质谱联用(liquid chromatography mass spectrometry, LC-MS)技术,观察逍遥丸对NASH模型大鼠粪便代谢产物及相关代谢通路的影响,从分子生物学角度揭示逍遥丸治疗NASH的潜在靶点,可为阐明NASH的发病机制、治疗途径及药物研发提供依据。本实验已通过山西中医药大学动物伦理委员会审批,编号:2021081001。
1 材料
1.1 动物
SPF级雄性SD大鼠24只,体质量(220±20)g,购自湖南斯莱克实验动物有限公司,许可证号:SXK(湘)2019-0004,饲养于江西中洪博元生物技术有限公司实验动物中心,温度(22±2)℃,湿度50%~60%,12 h光照。
1.2 药物
四氯化碳(carbon tetrachloride,CCl4)购自天津大茂化学试剂有限公司,货号:AR-M1896。 逍遥丸购自太极集团重庆中药二厂有限公司,规格:1.24 g/3丸,国药准字:Z50020454。
1.3 主要试剂
大鼠丙氨酸氨基转移酶(alanine aminotransferase,ALT)试剂盒(货号C009-2-1)、总胆固醇(total cholesterol,T-CHO)试剂盒(货号A111-1-1)、甘油三酯(triglycerides,TG)试剂盒(货号A110-1-1)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)试剂盒(货号A113-1-1),南京建成生物工程研究所;大鼠白介素(interleukin,IL)-1β试剂盒(货号RA20020)、IL-6试剂盒(货号RA20607)、IL-10试剂盒(货号RA20090),武汉贝茵莱生物科技有限公司;苏木精-伊红(hematoxylin and eosin,HE)染色液(货号DH0006),北京雷根生物技术有限公司;饱和油红O染色液(货号G1260),北京索莱宝科技有限公司;双巯基苯甲酸(bicinchoninic acid,BCA)试剂盒(货号AR0146)、二抗(货号BA1054),武汉博士德生物工程有限公司;SDS-PAGE凝胶配制试剂盒(货号P0012A),碧云天生物技术有限公司;GAPDH(货号AP0063),美国Bioworld公司;过氧化物酶体增殖物激活受体α(peroxisome proliferator-activated receptor alpha,PPARα)抗体(货号ab227074),英国Abcam公司;过氧化物酶体增殖子活化受体γ共激活因子(peroxisome proliferator-activated receptor gamma coactivator,PGC)-1α抗体,货号(A12348),武汉爱博泰克生物科技有限公司;超敏增强型化学发光(enhanced chemiluminescence,ECL)显色液(货号MAO186),大连美仑生物技术有限公司。
1.4 主要仪器
SpecfraMay型全波长酶标仪,美国Molecular Device公司;EG115型石蜡包埋机、RM223型切片机、CM1950型冰冻切片机、DM40008型正置荧光显微镜,德国Leica公司;164-5050型电泳仪、165-6001型电泳槽、170-3930型转印槽,美国 Bio-Rad 公司;ChampChemi professional型全自动多色荧光及化学发光凝胶成像系统,北京赛智创业科技有限公司。
2 方法
2.1 分组与干预
24只雄性SD大鼠,适应性饲喂1周后随机分为对照组、模型组与治疗组,每组各8只。对照组大鼠饲喂基础饲料;模型组和治疗组大鼠饲喂高糖高脂饲料,并于第3周开始以0.2 mL/100 g剂量在背部皮下注射CCl4豆油溶液(CCl4:豆油=2:3),每周2次,共注射2周。第5周开始停止造模,同时给予对照组和模型组大鼠0.9%氯化钠溶液2 mL灌胃,治疗组大鼠给予等体积逍遥丸水溶液灌胃,连续给药4周。逍遥丸水溶液按成人每日所需药量换算为大鼠等效药量,即成人每日需服用浓缩丸9丸(1次3丸,1日3次),重3.72 g,大鼠每日所需药量则为3.72 g×0.018/0.2 kg=0.3348 g/kg(0.018为大鼠体表面积转换系数)。每周称取大鼠体质量并相应调整药量。
2.2 取材
末次给药后所有大鼠均禁食禁饮12 h,戊巴比妥钠(30 mg/kg)腹腔注射麻醉,腹主动脉取血,收集上清于-80 ℃备用;称取各组大鼠肝脏质量并记录;各组大鼠部分肝脏用4%多聚甲醛固定,4 ℃备用;部分肝脏组织于-80 ℃保存备用。收集新鲜粪便标本,迅速液氮淬灭,-80 ℃冰箱保存,足量干冰低温送检。
2.3 指标检测
2.3.1 一般情况 观察并记录各组大鼠的精神状态、活动度、毛发、摄食量、粪便等。
2.3.2 肝指数和体质量指数 计算各组大鼠肝指数和体质量指数。肝指数=肝脏(kg)/体质量(kg)×100%。体质量指数=体质量(kg)/身长2(m2)。
2.3.3 肝脏组织病理学观察 取出固定液中的肝脏,石蜡包埋、切片,HE染色观察肝细胞形态;取出-80 ℃保存的部分肝脏,制备冰冻切片,油红O染色观察肝细胞内脂滴数量。
2.3.4 血清实验室指标检测 比色法、ELISA法检测各组大鼠血清ALT、T-CHO、TG、LDL-C、IL-1β、IL-6、IL-10含量。
2.3.5 LC-MS检测粪便代谢物谱
2.3.5.1 LC-MS备样 取大鼠粪便样本0.2 g,加400 μL预冷的80%乙腈混匀,离心后取上清过滤,装入液相小瓶。每个样本取10 μL混合制成质控(quality control,QC)样本。
2.3.5.2 LC-MS实验条件设置 液相条件:Waters Acquity UPLC HSS T3色谱柱(2.1 mm×100 mm,1.7 μm)。流动相:A(0.1%甲酸水),B(0.1%甲酸,乙腈);流动相梯度:0~2 min,98%~98% A;2~3 min,98%~65% A;3~17 min,65%~30% A;17~18 min,30% A;18~29 min,30%~2% A;29~31 min,2%A;31~33 min,2%~98% A;33~35 min,98% A。进样量:5 μL,流速:0.2 mL/min,柱温:40 ℃。
质谱条件:采用电喷雾离子源(ESI),正负离子模式采集,full scan/dd-MS2扫描模式,扫描范围100~1 500 m/z;喷雾电压3.5 kV(ESI+)和2.5 kV(ESI-);毛细管温度320 ℃;加热器温度300 ℃;鞘气流速35 arb,辅助气流速10 arb;分辨率为MS full scan 35 000FWHM以及MS/MS17 500FWHM,NCE12.5、25和37.5 eV。
2.3.5.3 数据分析 运用SIMCA-P 14.1软件进行多元统计分析,不同组间的分离度用偏最小二乘法判别分析(partial least squaresdiscriminate analysis,PLS-DA)展示,模型验证通过置换测试的响应值以及R2(模型适应度)和Q2(预测能力)进行,验证200次。正交偏最小二乘法判别(orthogonal PLS-DA,OPLS-DA)分析对照组与模型组之间的代谢差异,S-plot曲线中,距离原点越远,贡献越大。差异代谢物筛选标准为变量重要性值投影(variable importance in projection,VIP)>1和P<0.05。进一步根据MetaboAnalyst 5.0通路富集分析Pvalues值和通路拓扑学分析Impact values筛选最相关的作用通路。
2.3.6 Western blot检测肝组织PPARα、PGC1α蛋白表达 取大鼠部分肝脏组织,冰上快速提取蛋白,BCA法测定蛋白浓度,电泳分离条带,转膜,封闭,分别加入一抗PPARα(1:1 000)、PGC1α(1:1 000)、GAPDH(1:10 000),4 ℃孵育过夜,二抗(1:10 000)室温摇床孵育2 h, ECL 化学发光法显影,ImageJ 软件分析目的条带灰度值。
2.4 统计学方法
3 结果
3.1 一般情况比较
给药期间,对照组大鼠精神佳,毛发细腻光泽,活动灵敏,食量、二便未见异常;模型组大鼠毛发晦暗、枯燥,早期暴躁、易激惹,后期情绪低落、食量下降、倦怠少动,大便稀溏;治疗组较模型组大鼠一般情况有明显改善。
3.2 各组大鼠肝指数、体质量指数、血清生化指标比较
与对照组比较,模型组大鼠肝指数、ALT、T-CHO、TG及LDL-C含量显著升高,体质量指数显著下降(P<0.01);与模型组比较,治疗组大鼠肝指数、ALT、T-CHO、TG及LDL-C含量均显著下降,体质量指数显著升高(P<0.05),见表1。
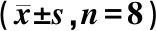
表1 各组大鼠肝指数、体质量指数及血清ALT、T-CHO、TG、LDL-C含量比较
3.3 各组大鼠肝组织病理比较
3.3.1 HE染色结果
光镜下观察HE染色大鼠肝组织石蜡切片,对照组大鼠肝细胞结构完整,核清晰,细胞索排列有序,中央静脉向四周呈放射状排列,肝窦正常;与对照组比较,模型组大鼠肝细胞结构紊乱、体积增大,细胞内可见大量脂肪空泡、细胞核被挤压至边缘,炎性细胞浸润明显,未见明显的纤维化和假小叶形成;与模型组比较,治疗组大鼠肝细胞结构较为完整,肝细胞内脂肪空泡减少,炎性细胞浸润明显减轻,见图1。
3.3.2 油红O染色结果
光镜下观察油红O染色大鼠肝组织冰冻切片,对照组大鼠肝组织未见异常;与对照组比较,模型组大鼠肝组织可见大量的红色脂滴,大小不等,甚至融合成片;与模型组比较,治疗组大鼠肝组织脂滴含量显著减少,见图2。
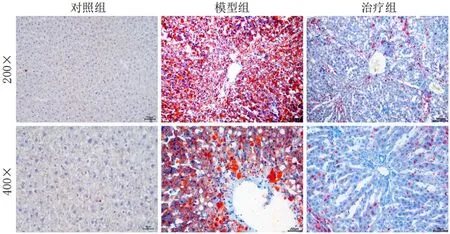
图2 各组大鼠肝组织冰冻切片油红O染色
3.4 各组大鼠血清炎症因子含量比较
与对照组比较,模型组大鼠血清IL-1β、IL-6含量显著升高,IL-10含量显著降低(P<0.01);与模型组比较,治疗组大鼠血清IL-1β、IL-6含量显著降低,IL-10含量显著升高(P<0.05),见表2。
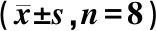
表2 各组大鼠血清IL-1β、IL-6及IL-10含量比较
3.5 各组大鼠粪便代谢组学检测结果
3.5.1 代谢轮廓分析
PLS-DA结果显示,对照组和模型组大鼠粪便样本数据区分明显,提示NASH模型复制成功,见图3A。PLS-DA模型验证采用排列实验(permutation test),设定检验次数为200,R2和Q2的所有排列值均小于原始值或Q2的回归线与纵轴相交数值小于零,且R2和Q2值均接近于1,证明实验模型稳定可靠,见图3B。对所有组别进行PLS-DA分析,3组大鼠数据均能明显分开,表明逍遥丸对NASH引起的大鼠代谢功能紊乱有一定的改善作用。且PLS-DA的QC样本聚在一起,表明系统的稳定性良好,见图3E。
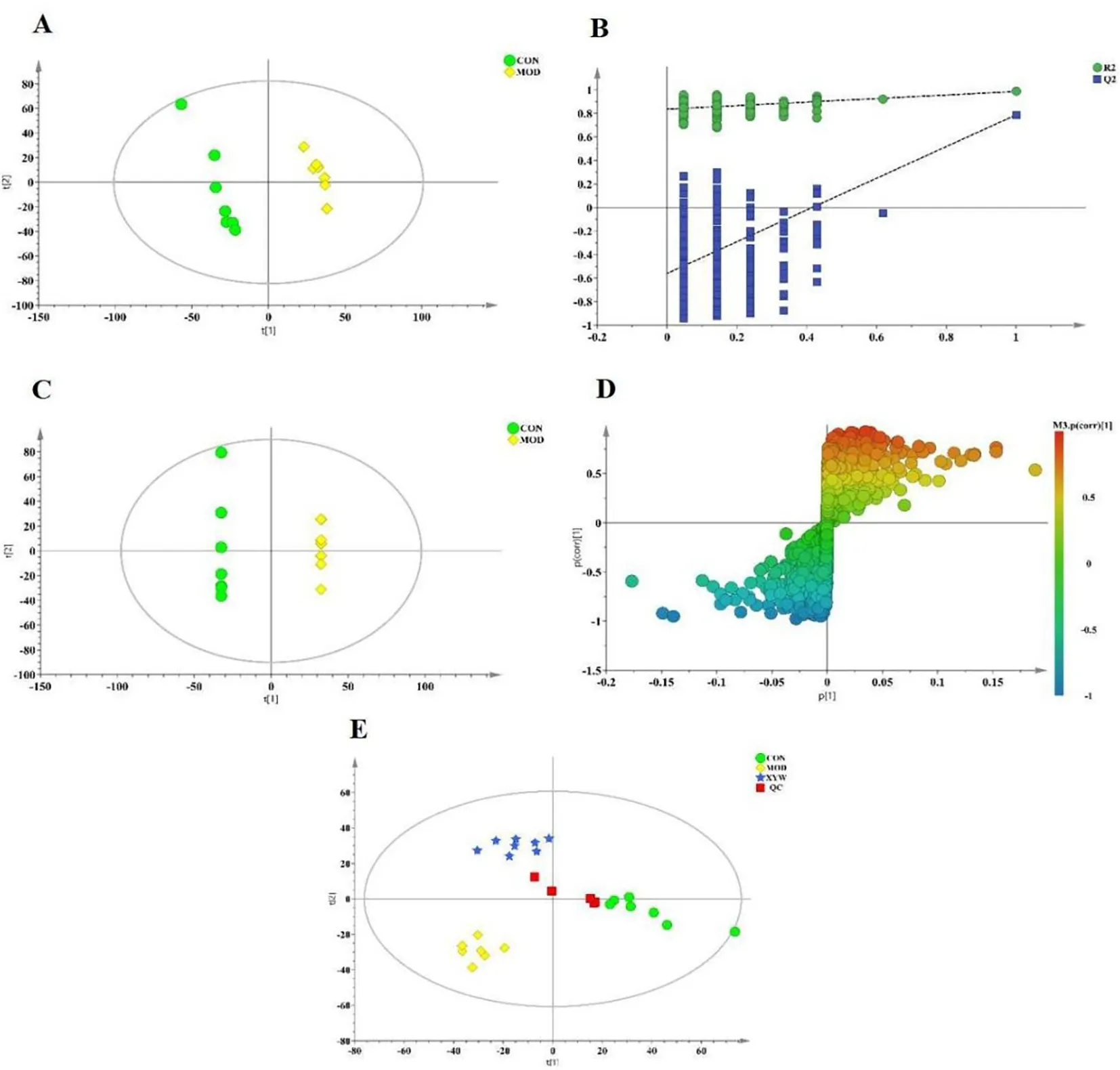
注:“CON”为对照组,“MON”为模型组,“XYW”为治疗组;“QC”为质控样本A.对照组与模型组PLS-DA得分图;B.PLS-DA模型验证图;C.对照组与模型组OPLS-DA得分图;D.S-plots图;E.不同组别大鼠粪便样本数据PLS-DA得分图
3.5.2 差异代谢物分析
取对照组和模型组大鼠粪便样本数据进行OPLS-DA分析,寻找与NASH相关的差异代谢物。根据S-Plots图中的VIP值(VIP>1)和t检验(P<0.05)结果,筛选出对组分贡献较大的代谢物。结果表明,与对照组比较,模型组大鼠粪便中乙酰左旋肉碱、组胺、丙酮酸、L-丝氨酸、胞嘧啶等57个代谢物发生了显著性变化,给予逍遥丸干预后,25个差异代谢物的含量出现显著性改善,见图4。
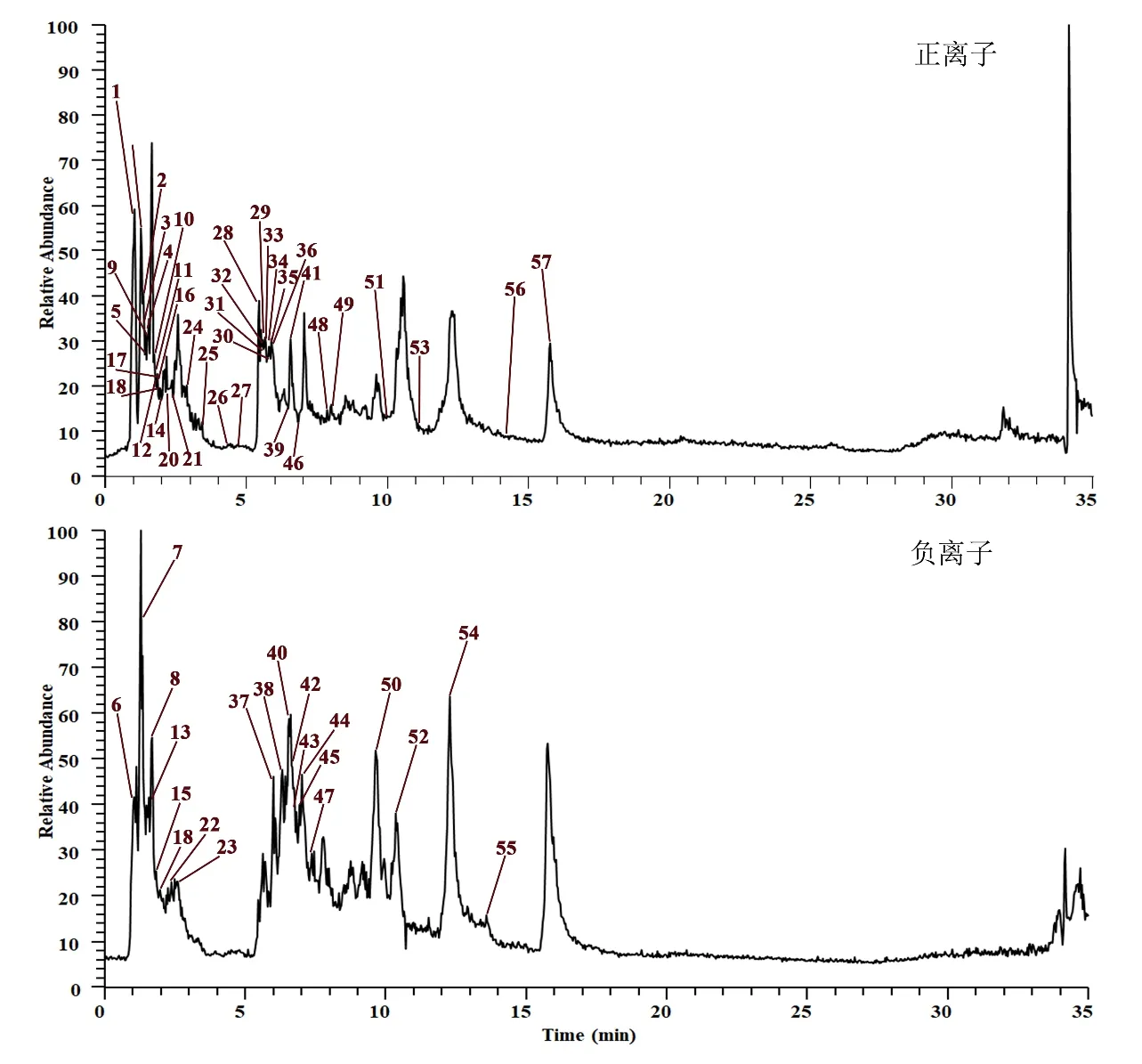
图4 各组大鼠粪便样本的LC-MS正负离子总离子图
3.5.3 代谢通路分析
MetaboAnalyst 5.0通路富集分析结果(图5)显示,模型组大鼠粪便中的差异代谢物涉及10条与NASH最相关的代谢途径(pathway impact>0.1)。具体包括: a.D-谷氨酰胺和D-谷氨酸代谢;b.丙氨酸、天冬氨酸和谷氨酸代谢;c.组氨酸代谢;d.精氨酸生物合成;e.嘌呤代谢;f.精氨酸和脯氨酸代谢;g.甘氨酸、丝氨酸和苏氨酸代谢;h.半胱氨酸与蛋氨酸代谢;i.苯丙氨酸代谢;j.氨酰-tRNA生物合成,见图5A。进一步研究表明,给予逍遥丸干预后,其中5条代谢通路发生了一定的变化,见图5B。

A.与NASH相关的代谢通路分析;B.逍遥丸干预后的代谢通路分析
3.6 各组大鼠肝脏组织PPARα、PGC1α蛋白表达比较
与对照组比较,模型组大鼠肝脏组织PPARα、PGC1α蛋白表达显著下降(P<0.01);与模型组比较,治疗组大鼠肝脏组织PPARα、PGC1α蛋白表达显著升高(P<0.05),见图6、表3。
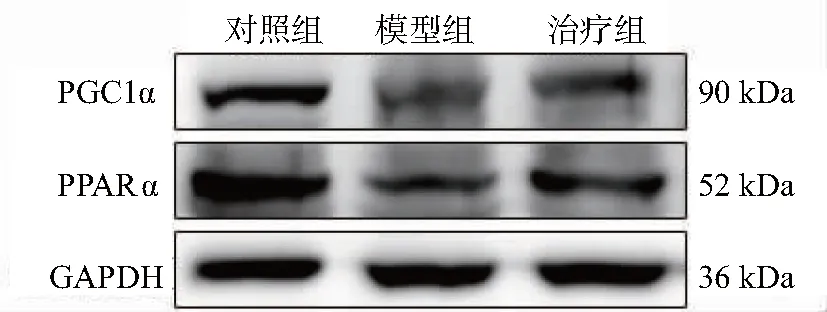
注:过氧化物酶体增殖物激活受体α(PPARα),过氧化物酶体增殖子活化受体γ共激活因子-1α(PGC1α)
表3 各组大鼠肝脏组织PPARα、PGC1α蛋白表达比较
4 讨论
高糖高脂饮食诱导NASH的造模方法有操作简单、重复性好、动物死亡率低、与人类病变的形成过程有较高的相似性等优点,但造模周期长,模型动物在短期内不易表达明显的疾病表型,不利于进行机制研究。CCl4皮下注射可诱导形成以肝细胞单纯性大疱性脂肪变为主的NASH病变,其造模速度快、肝脏病理变化与人类NASH相似[6]。本实验采用高糖高脂饮食+40% CCl4豆油溶液皮下注射的复合造模方法,能够大大缩短造模时间,增加模型稳定性,用药4周后通过血清生化及炎症指标、肝脏病理学检测,证明NASH模型复制成功[7]。
PPARα和PGC1α是脂肪酸β氧化的主要调控因子,在肝脏中高表达,主要通过调控过氧化物酶、线粒体和微粒体氧化代谢体系上关键酶的转录表达而发挥作用[8-11]。正常机体内PPARα、 PGC1α有较高表达,当其受到抑制时,肝组织内脂肪酸代谢通路上起关键作用的限速酶转录异常,导致脂肪在肝细胞内不能正常氧化分解而过度沉积,同时还可引发炎性细胞聚集,从而加剧NASH的发生发展。众多研究也已证实,NASH发生时,肝脏中PPARα与PGC1α表达下降[12-15]。本实验中模型组大鼠肝脏组织中PPARα与PGC1α的蛋白表达降低证实了脂肪酸代谢异常在NASH模型中确实存在。
本实验采用LC-MS技术对NASH大鼠粪便代谢产物进行高通量分析,通过多元统计分析发现,模型组大鼠粪便中乙酰左旋肉碱含量明显减少,提示脂肪酸进入线粒体参与氧化代谢受阻,即出现了脂肪酸氧化代谢障碍。乙酰左旋肉碱将脂肪酸从细胞质转运至线粒体,在线粒体内参与脂肪酸氧化过程中能量的产生和释放[16]。另一方面,乙酰左旋肉碱不仅为脂肪酸的氧化提供能量,还可以消除使细胞膜不稳定的自由基。乙酰左旋肉碱浓度降低可导致细胞氧化损伤、脂肪酸合成和能量代谢紊乱,最终导致NASH[17]。另外,丙酮酸是机体三大能量代谢的中间产物。研究证实,丙酮酸能够丰富三羧酸循环池,从而增加能量消耗,此过程会导致细胞内AMP依赖的蛋白激酶(AMP-activated protein kinase,AMPK)含量增加,并使乙酰辅酶A羧化酶(acetyl-CoA carboxylase,ACC)磷酸化水平上升而降低其活性,进而减少脂肪酸合成并促进脂肪酸氧化代谢[18]。本实验通过多元统计分析显示模型组大鼠丙酮酸含量降低,逍遥丸干预后明显回升,由此推测,逍遥丸治疗NASH可能通过调控脂肪酸代谢通路而发挥作用。本实验运用Western blot检测,发现逍遥丸可以使模型组大鼠肝组织中脂肪酸β氧化的关键酶PPARα、PGC1α的蛋白表达升高,证实了逍遥丸确实具有调控脂肪酸代谢的作用。
综上所述,逍遥丸可通过上调PPARα、PGC1α在NASH大鼠肝组织中的表达来诱导脂肪酸β氧化,并能够改善粪便代谢物谱、减轻脂肪在肝细胞内堆积以缓解NASH。本实验为从代谢通路研究NASH的发病和治疗机制提供了思路和前期基础,尚需更多的体内外实验进一步验证。

